印度梨形孢缓解油菜乙草胺药害及其作用机制
韩 飞,朱 祥,常 悦,董 倩,李俊凯
(长江大学 农学院 农药研究所,湖北 荆州 434025)
随着大范围推广少耕、免耕栽培技术,种植油菜对除草剂的需求量呈逐年增加趋势。乙草胺(Acetochlor)是适用于防除禾本科及部分阔叶杂草的酰胺类除草剂,具有药效好、成本低廉的特点,是我国需求量最大的酰胺类除草剂之一[1]。然而,乙草胺对作物存在隐性药害[2-3],特别是用药量过大或施药后遇持续低温高湿天气,会严重影响作物产量。截至目前,乙草胺的安全剂主要应用在预防除草剂对单子叶作物产生药害方面,而预防除草剂对双子叶作物产生药害仍然缺乏有效手段[4]。
内生真菌印度梨形孢(Piriformosporaindica)是印度科学家VERMA等[5]在印度的塔尔沙漠中发现的,其作用与丛枝菌根(Arbuscular mycorrhizal)真菌类似。因其可以促进植株生长和种子萌发,增加植物生物量、根系生物量及侧根数[6-7],还能提高植物对N、P、K的吸收[8],增强植物抗旱[9]、抗盐[10]、抗涝渍[11]、抗病[12]等功能而备受关注,但是否能对作物药害产生缓解作用,尚未见相关报道[13]。以P.indica为供试材料,通过拌种处理,在盆栽试验条件下,探索P.indica缓解油菜乙草胺药害的保护措施,并试图探明P.indica缓解药害的机制,旨在为油菜大田生产中乙草胺药害的预防提供理论依据和借鉴措施,并为P.indica在田间的应用提供依据。
1 材料和方法
1.1 试验材料
1.1.1 生物材料 蓉油14号油菜(BrassicanapusL.)种子购自四川邡牌种业有限公司;P.indica由德国耶拿大学RALF Oelmüer教授惠赠,用KM (Kaefe medium)固体培养基对P.indica进行活化和增殖培养,黑暗条件下培养4 d[14]。
1.1.2 药剂 50%乙草胺乳油购自山东胜邦绿野化学有限公司;乙草胺标准品购自国家标准样品发行中心;谷胱甘肽S-转移酶(GST)测定试剂盒、还原型谷胱甘肽(GSH)测定试剂盒、超氧化物歧化酶(SOD)分型测定试剂盒均购自南京建成生物工程研究所;甲醇、石油醚、乙酸乙酯、无水硫酸钠等均为分析纯。
1.1.3 试验仪器 FA2004电子天平(上海舜宇恒平科学仪器有限公司) 、紫外分光光度计UV3200S(上海美谱达仪器有限公司)。
1.2 试验方法
1.2.1 盆栽法测定P.indica对油菜生长的影响 在塑料盆(16 cm×16 cm)中加入定量过筛的风干土,并用一定量水将其浸湿,每1 kg油菜籽分别用5、10、20、50 gP.indica菌丝进行拌种,并播于已装土的塑料盆中。每盆25粒,每处理重复3次,覆盖1 cm土,同时设未经P.indica菌丝处理的种子为空白对照(CK1),放于网室中。播后10 d测定株高、根长以及单株鲜质量,计算P.indica拌种对油菜的促长率(P.indica拌种测定值,表示试验中用P.indica拌种后测量得到的油菜幼苗株高、根长以及单株鲜质量值;CK1测定值,表示试验中空白对照CK1测量得到的油菜幼苗株高、根长以及单株鲜质量值)。
促长率=(P.indica拌种测定值-CK1测定值)/CK1测定值×100%
(1)
1.2.2 盆栽法测定P.indica缓解乙草胺对油菜的药害 播前处理如1.2.1中所述,播后1 d用有效成分分别为0、400、800、1 200、2 400 g/hm2的乙草胺喷雾进行土壤封闭,并设未经P.indica菌丝及乙草胺处理的种子为空白对照(CK2),播后10 d测定株高、根长以及单株鲜质量,并计算乙草胺对油菜的抑制率(CK2测定值,表示试验中空白对照CK2测量得到的油菜幼苗株高、根长以及单株鲜质量值;单施乙草胺测定值,表示试验中单独施用乙草胺时油菜幼苗株高、根长以及单株鲜质量值)以及P.indica对油菜药害的恢复率(P.indica拌种后施用乙草胺测定值,表示试验中经P.indica拌种再施用乙草胺后测量得到的油菜幼苗株高、根长以及单株鲜质量值)。
抑制率=(CK2测定值-单施乙草胺测定值)/
CK2测定值×100%
(2)
恢复率=(P.indica拌种后施用乙草胺测定值-
单施乙草胺测定值)/CK2测定值×100%
(3)
1.2.3 GST、GSH及SOD的提取与测定 试验处理过程如1.2.2所述,经不同拌种量(1 kg油菜籽添加5、10 g菌丝)拌种,再喷施不同有效成分的乙草胺(600、1 200、1 800 g/hm2),并设未经P.indica菌丝及乙草胺处理的种子为空白对照(CK3),于油菜播后10、15 d,取油菜幼苗的地上部分,并严格按照试剂盒说明书进行GST、GSH、SOD的提取与测定。
1.3 数据处理
采用Excel 2007对数据进行处理,利用SPSS 20.0进行显著性分析。
2 结果与分析
2.1 盆栽条件下P.indica对油菜的促生作用
由表1可知,与CK1对比,在拌种量为1 kg油菜籽添加50 gP.indica菌丝时,P.indica对油菜的株高、根长、单株鲜质量都有一定的抑制作用。而在1 kg油菜籽添加10 gP.indica菌丝时,P.indica对油菜的促生效果显著,对株高、根长、单株鲜质量的促长率分别为25.16%、31.36%、30.24%。

表1 P.indica拌种对油菜生长的影响
注:同列不同字母表示处理间差异显著(P<0.05),下同。表中负值表示在该拌种浓度下P.indica对油菜生长有一定的抑制作用。
Note:Different letters in the same column indicate significant different between different treatments (P<0.05),the same below.A negative value in the table indicates thatP.indicahas a certain inhibitory effect on the growth of rapeseed at the seed dressing concentration.
2.2 盆栽条件下P.indica缓解乙草胺对油菜药害的效果
在盆栽条件下,与CK2对比,施用有效成分分别为400、800、1 200、2 400 g/hm2的乙草胺,均对油菜的株高、根长、单株鲜质量造成不同程度的影响。其中,对株高抑制率分别为29.12%、34.75%、48.66%、48.51%;对根长抑制率分别为22.03%、27.54%、26.69%、27.12%;对单株鲜质量抑制率分别为46.98%、53.02%、53.02%、79.87%。
用乙草胺进行土壤封闭后,出芽的油菜会出现叶片卷曲、皱缩以及根系缩短、肿胀等现象,用P.indica菌丝进行拌种的油菜在出芽后上述不良情况相对较轻。其中,1 kg油菜籽添加10 gP.indica菌丝时,对使用不同有效成分(400、800、1 200、2 400 g/hm2)的乙草胺药害总体缓解效果最好,其生长情况基本上与CK2持平,甚至优于CK2。其中,对株高的药害恢复率分别为30.79%、60.99%、26.99%、26.49%,对根长的药害恢复率分别为33.69%、21.51%、58.75%、31.67%,对单株鲜质量的药害恢复率分别为75.92%、45.50%、7.25%、33.33%。此外,1 kg油菜籽添加5 gP.indica菌丝的试验组,也对乙草胺药害具有良好的缓解效果(表2)。

表2 P.indica拌种缓解乙草胺对油菜药害的效果
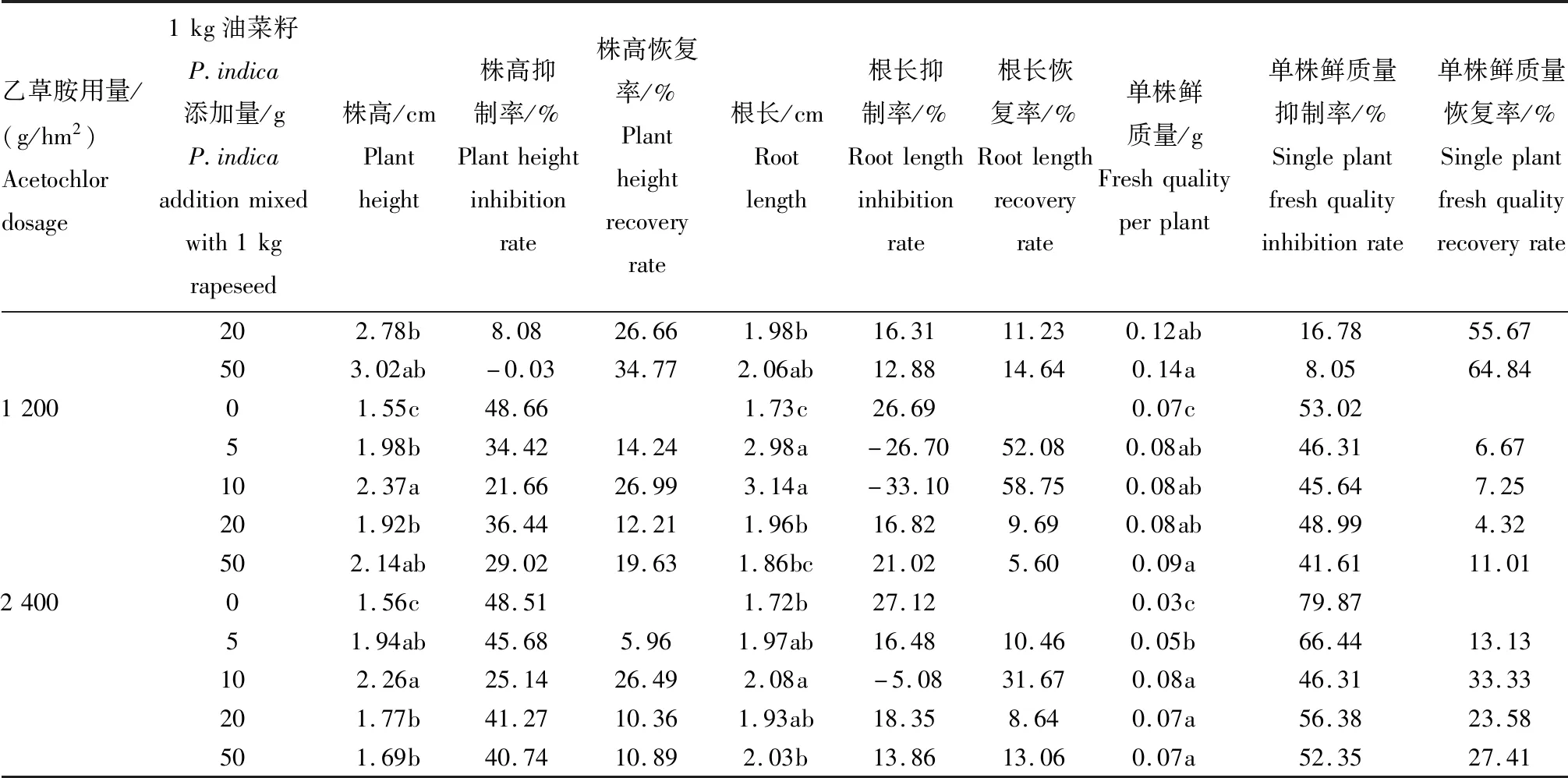
续表2 P.indica拌种缓解乙草胺对油菜药害的效果
2.3 盆栽条件下P.indica拌种对油菜幼苗GSH质量浓度以及GST、SOD活性的影响
2.3.1P.indica拌种10 d后对油菜幼苗GSH质量浓度以及GST、SOD活性的影响 如表3所示,经P.indica菌丝单独拌种10 d后,油菜幼苗的GSH质量浓度以及GST、SOD活性与CK3相比,均有显著提高。1 kg油菜籽添加5、10 g菌丝拌种后,在不施用乙草胺的情况下,GSH质量浓度分别为0.33、0.31 g/L,高于对照组的0.25 g/L;GST活性分别为138.27、150.74 mol/(mg·min),高于对照组的117.53 mol/(mg·min);SOD活性分别为38.64、33.85 U/g,高于对照组的23.88 U/g。
经不同拌种量(1 kg油菜籽添加5、10 g菌丝)拌种后,再喷施不同有效成分的乙草胺(600、1 200、1 800 g/hm2),油菜中的相关解毒酶的活性及质量浓度均有增加。2组不同拌种量的处理组(1 kg油菜种子添加5、10 g菌丝),其对油菜的酶活性及质量浓度的影响整体相当。
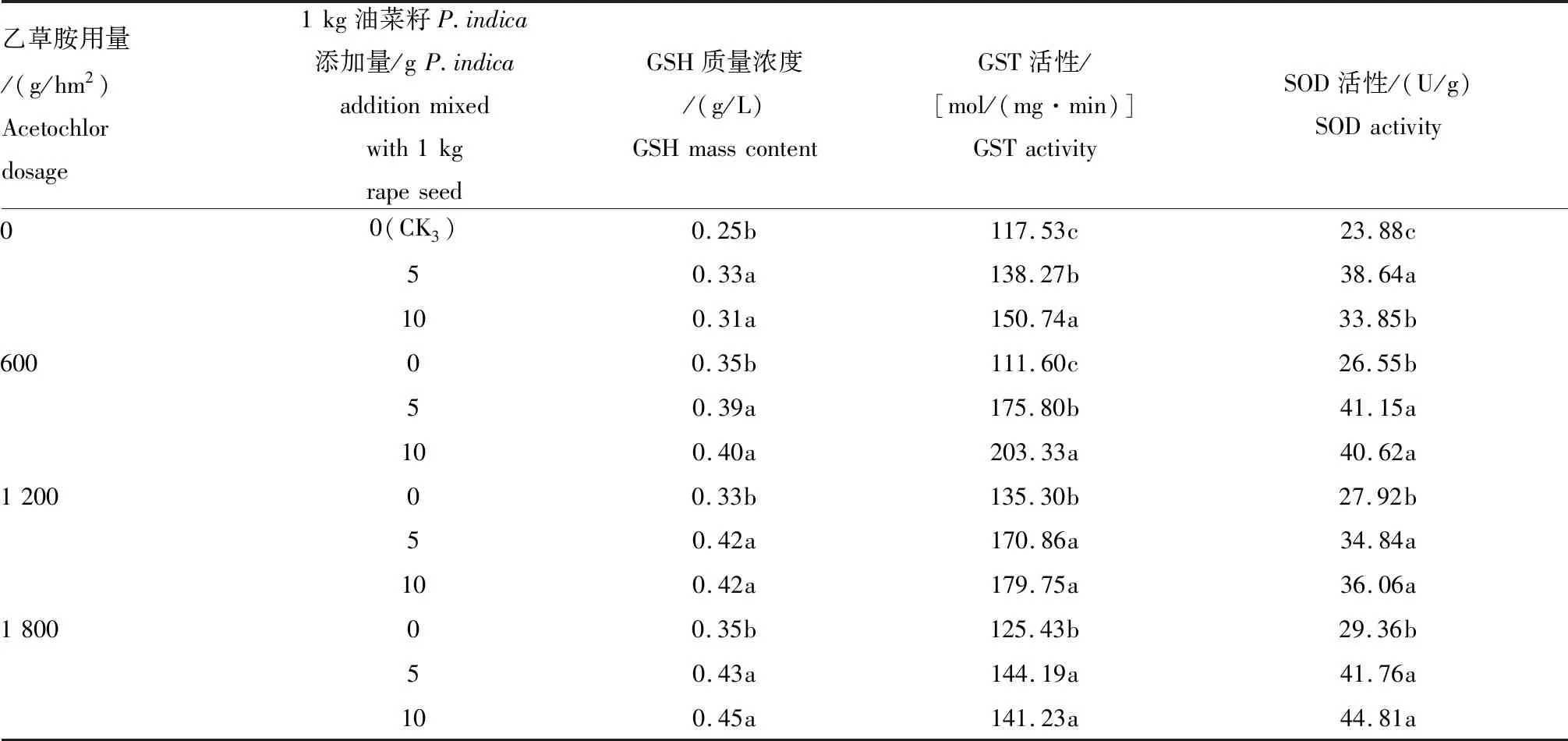
表3 P.indica拌种对油菜幼苗GSH质量浓度以及GST、SOD活性的影响(10 d后)Tab.3 Effect of P.indica seed dressing on GSH mass content,GST and SOD activities of rape seedlings (after 10 d)
2.3.2P.indica拌种15 d后对油菜幼苗GSH质量浓度以及GST、SOD活性的影响 由表4可知,15 d后,空白对照(CK3)中的GSH质量浓度、GST及SOD活性有明显提高,经P.indica菌丝单独拌种后,油菜幼苗中的相关解毒酶的活性及质量浓度依然高于CK3,单独使用乙草胺的油菜其相关酶质量浓度及活性总体略高于CK3。
经P.indica菌丝拌种的油菜种子,再喷施有效成分分别为600、1 200、1 800 g/hm2的乙草胺,油菜中的相关解毒酶的活性及质量浓度均高于单独使用乙草胺的处理组,也高于CK3。以乙草胺浓度为600 g/hm2为例,1 kg油菜籽用5 g菌丝拌种试验组的GSH质量浓度为0.58 g/L,GST、SOD的活性分别为181.41 mol/(mg·min)、54.70 U/g;1 kg油菜籽用10 g菌丝拌种试验组的GSH质量浓度为0.60 g/L,GST、SOD的活性分别为203.94 mol/(mg·min)、59.34 U/g,均高于单用乙草胺时GSH的质量浓度(0.41 g/L)及GST、SOD的活性[146.48 mol/(mg·min)、46.86 U)]。
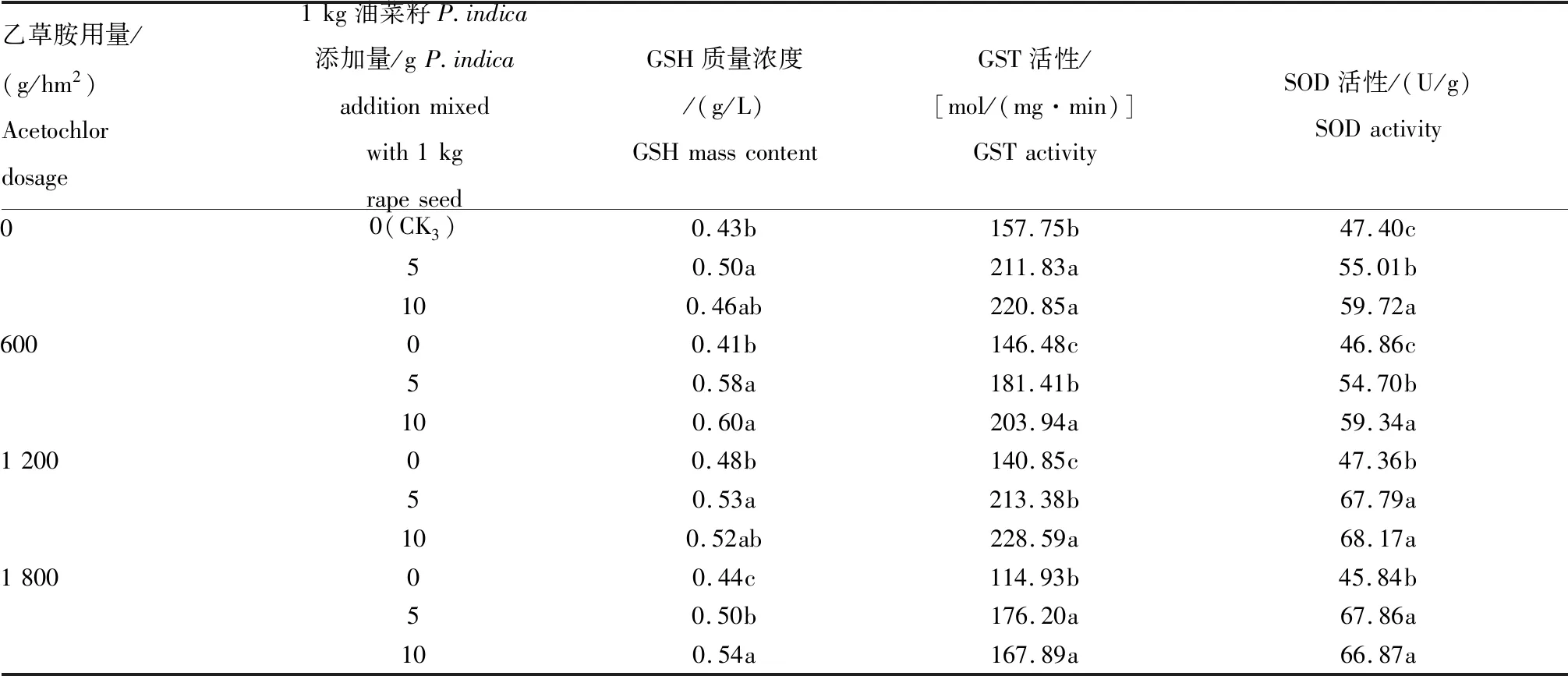
表4 P.indica拌种对油菜幼苗GSH质量浓度以及GST、SOD活性的影响(15 d后)Tab.4 Effect of P.indica seed dressing on GSH mass content and GST and SOD activities of rape seedlings(after 15 d)
3 结论与讨论
植物中的SOD、GSH是具有特殊功能的多肽,其主要功能是清除在逆境环境下植物体内积累的过量活性氧,在植物脱毒和维持氧化还原缓冲液中起重要作用。相对于SOD,GSH自身并不能起到脱毒作用,必须在GST催化下,才能与有毒物质产生反应,将其转化为无害或低毒物质[15-16]。根据目前研究结果,酰胺类除草剂安全剂的作用机制主要为结构活性(QSAR)机理论[17]、谷胱甘肽轭合作用机理论[18]以及植物细胞色素P450催化代谢论[19],而乙草胺通常在植物体内的主要解毒机制是谷胱甘肽轭合作用,其通过在GST催化下迅速与GSH进行轭合反应,使乙草胺对植物丧失生理毒性[20-21]。
本试验结果表明,当乙草胺有效成分施用量为400、800、1 200、2 400 g/hm2时,用50 gP.indica菌丝拌种1 kg油菜籽时,均对油菜的药害恢复具有良好效果。同时乙草胺还能对油菜幼苗的GSH质量浓度、GST及SOD活性具有一定的刺激作用,适量P.indica拌种可以通过提高油菜相关解毒酶的活性及质量浓度,加强油菜自身对乙草胺的代谢,从而缓解乙草胺药害对油菜的影响,这也是首次对P.indica缓解作物药害方面进行报道。P.indica菌丝浓度较高(50 gP.indica菌丝拌种1 kg油菜籽)时,油菜幼苗在相关生长指标上均表现了一定的抑制作用,这也与陈佑源[22]的研究结果一致,但在喷施乙草胺后,对乙草胺药害也有一定的缓解作用。根据DESHMUKH等[23]的研究,P.indica在接种转基因大麦时,用荧光标记的BI-1基因(普遍存在于真核细胞中,控制细胞程序性死亡,阻止细胞死亡)高度表达,P.indica的定殖与繁殖受到强烈抑制,表明P.indica在定殖过程需要寄主细胞死亡。因此,油菜在生长初期出现上述情况,推测是由于P.indica的定殖与繁殖同油菜幼苗争夺营养而引起的。同时在试验中,5 gP.indica菌丝拌种与10 g菌丝拌种的试验组其酶活性及质量浓度虽然接近,但在油菜幼苗的生理指标上,后者相对占优势。综上所述,P.indica对油菜苗期的乙草胺药害具有较好的缓解效果,这也为P.indica菌肥在作物上更好的运用提供了新的研究思路。

