一个抗咪唑乙烟酸长芒苋种群的发现
吉美静 黄兆峰 崔海兰 陈景超 于海燕 张金鹏 李香菊


摘要:以咪唑乙烟酸为靶标除草剂,就几种苋属杂草对咪唑乙烟酸的抗药性进行研究。结果表明,供试皱果苋、反枝苋和其中的一个长芒苋P1种群(北京种群)对咪唑乙烟酸比较敏感,而在长芒苋中发现一个对咪唑乙烟酸有抗药性的P2种群(山东种群),在4倍推荐剂量下仍能全部存活。分子检测发现该种群ALS基因的第574位和第653位氨基酸发生了单碱基突变,分别为色氨酸(Trp)突变为亮氨酸(Leu)、丝氨酸(Ser)突变为天冬氨酸(Asp),种群中上述2种突变类型所占比例分别为38.9%、58.3%,2.8%的植株未检测到突变。
关键词:苋属杂草;长芒苋;咪唑乙烟酸;抗性种群;ALS基因突变
中图分类号:S451.2 文献标志码:A 文章编号:1003-935X(2020)03-0023-05
A New Imazethapyr-Resistant Population of Amaranthus palmeri
JI Mei-jing, HUANG Zhao-feng, CUI Hai-lan, CHEN Jing-chao, YU Hai-yan, ZHANG Jin-peng,LI Xiang-ju
(Institute of Plant Protection, Chinese Academy of Agricultural Sciences,Beijing 100193,China)
Abstract:The resistance of several Amaranthus weeds to imazethapyr used as the target herbicide was studied.The result showed that the populations of A. retroflexus and A. viridis and P1 population of A. palmeri (Beijing population) were sensitive to imazethapyr,while a new imazethapyr-resistant P2 population of A. palmeri (Shandong population) was dicoveried. And this P2 population were still survived at 4 times recommended dose of imazethapyr. The molecular detection result showed that there were single nucleotide changes in Trp574 and Ser653 of ALS gene in this population (Trp-Leu and Ser-Asp), respectively. The proportion of two mutations accounted for 38.9% and 58.3% in the P2 population, while no mutation was found in 2.8% of the detected gene sequence.
Key words:Amaranthus palmeri; imazethapyr;herbicide resistant population;ALS gene mutation
雜草抗药性已经成为影响农业生产和粮食安全的世界性难题之一。早在20世纪50年代,美国和加拿大就先后发现竹节菜(Commelina diffusa)和野胡萝卜(Daucus carota)对2,4-二氯苯氧乙酸(2,4-D)产生抗性[1-2];1970年,华盛顿西部发现北千里光(Senecio dubitabilis)对莠去津产生抗药性[1]。随着除草剂的大范围应用,抗性杂草报道逐年增加[3-4]。国际抗性杂草数据库(International Herbicide-Resistant Weed Database)中的数据显示,截至2020年11月在其网站上登记的抗性杂草有262种,包括双子叶杂草152种和单子叶杂草110种,共514个抗性生物型(species×site of action)。其中,对乙酰乳酸合成酶(ALS)抑制剂类除草剂产生抗药性的杂草有165种,居第1位,涉及苋科、菊科、藜科、蓼科、十字花科、石竹科、千屈菜科、泽泻科、旋花科、雨久花科、禾本科、莎草科等植物。苋科杂草对ALS抑制剂产生抗性的较多,仅苋属就有北美苋(Amaranthus blitoides)、凹头苋(A. blitum)、绿穗苋(A. hybridus)、长芒苋(A. palmeri)、鲍氏苋(A. powellii)、反枝苋(A. retroflexus)、刺苋(A. spinosus)、糙果苋(A. tuberculatus)、皱果苋(A. viridis)等9种抗性杂草[1]。
长芒苋(A. palmeri)是一年生苋科苋属杂草,雌雄异株,原产于墨西哥西北部和美国的南加州至新墨西哥州到得克萨斯州一带,后入侵至世界各地,现欧洲、大洋洲、亚洲等地均有分布[5-6]。我国1985年首次在北京市丰台区南苑乡发现长芒苋[7-8],目前上海、安徽、江西、福建、河南、湖北、湖南、广东、广西、辽宁、江苏、浙江、河北、北京等地均有长芒苋分布的报道。长芒苋植株生长迅速、适应性强、繁殖系数高,对生境中的其他植物及农作物生长构成严重威胁。据报道,长芒苋在美国玉米、大豆、甘薯、花生、高粱、棉花等田中均有不同程度的危害,密度为0.11~10.5株/m2时,导致上述作物减产6%~91%[6]。长芒苋对除草剂的抗性严重,目前已经发现对氟乐灵、莠去津、草甘膦、ALS抑制剂(灭草喹、氯嘧磺隆、嘧草硫醚等)、对羟基苯基丙酮酸双氧化酶(HPPD)抑制剂(硝磺草酮)等产生抗性及多抗性,其中以ALS抑制剂抗性较为普遍。长芒苋被我国列为入侵性杂草[5],对农业生产及生态环境有较大危害,一旦产生抗性将加剧其危害程度及治理难度。
基于农田杂草抗性监测工作的需要,我们就几种苋属杂草对ALS抑制剂的抗性进行例行监测。在以咪唑啉酮类除草剂咪唑乙烟酸为靶标药剂进行监测时发现,受试种群中一个长芒苋种群对咪唑乙烟酸产生了抗性。因此,本研究对苋属4个不同种群对咪唑乙烟酸的抗性计量进行测定,并对不同种群的ALS靶点基因进行检测,分析ALS靶点基因突变与植株存活的关系,以期明确ALS靶点基因突变是否会导致植株产生抗药性。
1 材料與方法
1.1 试验材料
苋属杂草种子:反枝苋、皱果苋、长芒苋等4个种群(其中长芒苋种群2个,分别为P1和P2)的种子,分别采自河北省廊坊市、黑龙江省黑河市、北京市昌平区(P1)和山东省潍坊市(P2)。
供试药剂及试剂:5%咪唑乙烟酸水剂,山东先达农化股份有限公司生产;植物基因组DNA提取试剂盒、2×Pfu PCR Master Mix,购自天根生化科技(北京)有限公司;Trans2K DNA marker,购自北京全式金生物技术有限公司。
仪器设备:ASS-4型行走式喷雾塔,Tee Jet8003扇形喷头,由国家农业信息化工程技术研究中心研制;PCR仪,型号为AG-22331,购自德国Eppendorf公司;低温离心机,型号为Centrifuge 5417R,购自德国Eppendorf公司;全自动数码凝胶图像分析系统,型号为Tanon1600,购自上海天能科技有限公司;电泳槽,型号为JYC600C,购自北京君意东方电泳设备有限公司。
1.2 试验方法
1.2.1 供试材料培养 本试验于2020年6—8月进行,采用盆栽法培养供试苋属杂草幼苗。于直径为9 cm的盆钵中分别种植上述供试杂草种子,每盆撒播20粒,覆土1 cm。将盆钵放入装有水的托盘中,以盆钵底部渗灌方式浇水,每隔3 d浇水1次,保持土壤湿度。盆钵置于自然光照网室大棚内培养,温度为25~35 ℃。幼苗长至2~3叶期进行间苗,每盆保留6株分布均匀、长势基本一致的杂草幼苗待用。
1.2.2 不同苋属种群对除草剂抗性剂量的测定 于杂草4~5叶期,采用ASS-4型行走式喷雾塔喷施除草剂咪唑乙烟酸,喷雾压力为 0.275 MPa,喷液量为367.5 L/hm2。分别设置清水对照(CK)、75(即登记的推荐剂量,记为X)、150(记为2X)、300 g a.i. /hm2(记为4X)等4个处理。每个处理重复3次。施药后 21 d,目测观察植株长势及株高;调查植株存活数,植株有绿色组织,则视为存活。
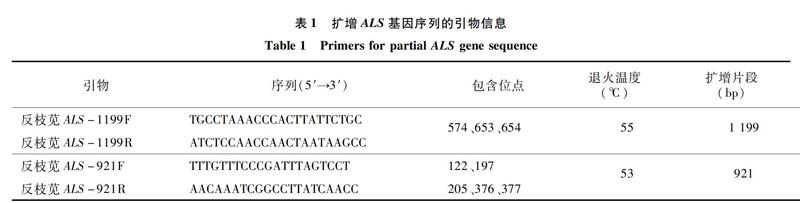
1.2.3 不同苋属种群ALS靶点基因的分子检测 在所有试材喷施除草剂咪唑乙烟酸之前,对各种群每盆幼苗进行单株标记,并剪取所有处理单株倒2叶的部分叶片,放入-80 ℃冰箱内保存,用于后续靶点基因的分子检测。根据GenBank中反枝苋ALS基因的序列(登录号:AF363369.1),设计引物(表1),扩增片段包括ALS基因保守区目前已报道的8个突变位点。其中,反枝苋ALS-1199F/R扩增片段长度为1199 bp,包括第574、第653、第654位等3个位点;反枝苋ALS-921F/R扩增片段长度为921 bp,包括第122、第197、第205、第376、第377位等5个位点,引物均由北京六合华大基因科技有限公司合成。
采用植物基因组提取试剂盒提取上述几种苋属杂草叶片全基因组DNA,提取方法参照试剂盒说明书。PCR扩增反应25 μL体系:2×Pfu PCR Master Mix,12.5 μL;ddH2O,10.5 μL;上下游引物,各0.5 μL;DNA模板,1 μL。PCR程序参数设定:95 ℃预变性3 min;94 ℃变性30 s,53(反枝苋ALS-921F/R)/55(反枝苋ALS-1199F/R) ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸 10 min。扩增产物于1%琼脂糖凝胶中进行电泳检测。
1.3 数据处理及分析
利用Excel软件对不同种群苋属杂草的存活情况进行统计分析;利用Seq Man软件将测序后获得的序列与其对应的GeneBank中ALS基因序列进行比对,寻找序列中8个被报道突变位点的差异性。
将单株分子检测后的位点突变情况与植株存活程度进行比较,分析靶点突变和植株存活的对应关系,明确ALS靶点基因突变是否会导致植株产生抗药性。
2 结果与分析
2.1 不同苋属杂草对咪唑乙烟酸的抗性程度
喷施除草剂后目测观察,喷施 75 g a.i./hm2 咪唑乙烟酸即可明显抑制反枝苋、皱果苋和长芒苋P1种群植株生长。在2X剂量下,大部分反枝苋植株死亡,存活的植株也仅剩1~2张叶片,接近死亡;长芒苋P1种群(北京种群)的表现与反枝苋类似;皱果苋植株全部死亡。表明咪唑乙烟酸对上述3种杂草有较好的防治效果。但长芒苋P2种群(山东种群)在咪唑乙烟酸4X剂量下仍能正常生长,株高与空白对照几乎无差别。
将施药后21 d调查的不同种群植株存活情况列于表2。由表2可以看出,空白对照处理所有种群的植株均存活;在推荐剂量(X)、2X和4X剂量下,反枝苋种群存活率分别为38.89%、22.22%、0;皱果苋种群存活率分别为5.56%、0、0;长芒苋P1种群存活率分别为38.89%、16.67%、0。而长芒苋P2种群,除在2X推荐剂量下植株存活率为88.89%(18株受试植株仅2株死亡)外,在其他各处理下的存活率均为100%。结果表明,长芒苋P2种群对咪唑乙烟酸存在较高水平的抗性,而其他3个受试同属种群对咪唑乙烟酸仍较敏感。
2.2 不同苋属种群的靶点突变分子检测结果
将不同苋属种群测序后的ALS基因序列与GenBank中各种群的ALS基因序列对比后,发现长芒P2种群的ALS基因序列发生了氨基酸取代,突变类型有2种,分别为574位色氨酸(Trp)突变为亮氨酸(Leu)和653位丝氨酸(Ser)突变为天冬氨酸(Asp),各突变类型检出比例分别为38.9%、58.3%,2株植株未检测到突变(表3)。反枝苋、皱果苋和长芒苋P1种群的ALS基因序列经对比后,均未发现突变。
将单株分子检测所测得差异性位点结果与“2.1”节中不同处理植株存活程度进行比对,发现P2种群中2株未检测到靶标基因突变的植株即为2X处理剂量下2株死亡的长芒苋植株。进一步说明,该种群是由于基因突变才导致对咪唑乙烟酸产生抗性。
3 小结与讨论
本研究通过不同苋属种群对咪唑乙烟酸的抗性剂量测定试验发现,反枝苋、皱果苋和长芒苋P1种群对咪唑乙烟酸都较为敏感,其ALS基因序列经对比,均未发现基因突变。而长芒苋P2种群在2倍推荐剂量下大部分植株存活,对靶标位点的分子检测后发现,长芒苋P2种群存活植株ALS基因发生了氨基酸取代。将分子检测结果与不同处理植株存活程度进行比对发现,长芒苋P2种群中2株未检测到靶标基因突变的植株即为2X处理剂量下2株死亡的长芒苋植株,表明长芒苋P2种群是由于基因突变才导致对咪唑乙烟酸产生抗性。
杂草抗药性是当前全球杂草治理面临的重要难题。我国目前对苋属杂草抗性的研究主要集中在反枝苋。如葛鲁安等报道了玉米田中的反枝苋对烟嘧磺隆具有抗药性,抗性倍数达13.7倍[9],袁雪等报道,黑龙江一处大豆连作地的反枝苋对噻吩磺隆的抗性指数达66.17,产生了高水平抗性[10]。陈金奕等报道,黑龙江省嫩江县和嫩北农场的反枝苋种群对咪唑乙烟酸的抗性指数大于90,表现出高水平抗性[11]。在本研究中,反枝苋在2倍咪唑乙烟酸推荐剂量下,仅1~2株植株存活,皱果苋无存活植株,靶基因分子检测后未发现上述2种杂草的靶基因突变,表明廊坊市反枝苋种群和黑河市受试皱果苋种群对咪唑乙烟酸基本无抗性。与上述苋属种群不同的是,长芒苋P2种群对咪唑乙烟酸产生靶標抗性。长芒苋在我国被列为入侵性杂草,目前尚无抗性研究报道。其抗性基因的扩散蔓延以及可能与其他同属植物杂交导致的抗性基因漂移应引起重视。
化学除草剂的长期选择性压力,导致杂草对多种除草剂产生了交互抗性和多抗性[4,6]。1997年美国发现对咪唑乙酸产生高水平抗性的长芒苋,抗性指数达2 800[12];长芒苋目前也被列为美国棉花田、大豆田十大难治杂草之一[6]。除此之外,近几年,阿根廷[13]、巴西[14]、西班牙[15]等国家也相继报道了抗ALS抑制剂的长芒苋生物型。
在本研究中,我们采用剂量测定与靶基因突变分子检测同步进行的手段,快速发现了1种对咪唑乙烟酸产生抗性的长芒苋种群,从初筛结果来看,该种群抗性水平及抗性频率均较高,有必要设计多个剂量梯度进一步测定抗性指数以及进行多抗及交互抗性研究。
参考文献:
[1]Heap I. International survey of herbicide-resistant weeds[J].Wead Technology,1990,4(1):220.
[2]苏少泉. 激素类除草剂的发展与杂草抗性[J]. 农药研究与应用,2011,15(6):1-6.
[3]韩庆莉,沈嘉祥. 杂草抗药性的形成、作用机理研究进展[J]. 云南农业大学学报,2004,19(5):556-561.
[4]张朝贤,倪汉文,魏守辉,等. 杂草抗药性研究进展[J]. 中国农业科学,2009,42( 4):274 -1289.
[5]曹晶晶,王 瑞,李永革,等. 外来入侵植物长芒苋在中国不同地区的表型变异与环境适应性[J]. 植物检疫,2020,34(3):25-31.
[6]Ward S M,Webster T M,Steckel L E. Palmer amaranth (Amaranthus palmeri):a review[J]. Weed Technology,2013,27(1):12-27.
[7]李振宇. 长芒苋——中国苋属一新归化种[J]. 植物学通报,2003,20(6):734-735.
[8]车晋滇. 外来入侵杂草长芒苋[J]. 杂草科学,2008(1):58-60.
[9]葛鲁安,王 豪,赵 宁,等. 玉米田反枝苋对烟嘧磺隆的抗性水平及靶标抗性分子机理[J]. 农药学学报,2018,20(5):595-600.
[10]袁 雪,黄兆峰,黄红娟,等. 黑龙江省反枝苋对噻吩磺隆的抗性水平及其分子机制[J]. 植物保护学报,2017,44(3):527-528.
[11]陈金奕,张朝贤,黄红娟,等. 反枝苋对咪唑乙烟酸抗性水平及分子机制[J]. 植物保护,2015,41(2):130-134.
[12]Sprague C L,Stoller E W,Wax L M,et al. Palmer amaranth (Amaranthus palmeri) and common water hemp (Amaranthus rudis) resistance to selected ALS-inhibiting herbicides[J]. Weed Science,1997,45(2):192-197.
[13]Larran A S,Palmier V E,Perotti V E. Target-site resistance to acetolactate synthase (ALS)-inhibiting herbicides in Amaranthus palmeri from Argentina[J]. Pest Management Science,2017,73(12):2578-2584.
[14]Kupper A,Borgato E A,Patterson E L,et al. Multiple resistance to glyphosate and acetolactate synthase inhibitors in palmer amaranth (Amaranthus palmeri) identified in Brazil[J]. Weed Science,2017,65(3):317-326.
[15]Torra J,Royo-Esnal A,Romano Y,et al. Amaranthus palmeri a new invasive weed in Spain with herbicide resistant biotypes[J]. Agronomy,2020,10(7):993.
收稿日期:2020-09-15
基金项目:国家现代农业产业技术体系建设专项(编号:CARS-25)。
作者简介:吉美静和黄兆峰为本文共同第一作者。
通信作者:李香菊,博士,研究员,主要从事农田杂草生态与防除研究。E-mail:xjli@ippcaas.cn。

