牛肉酶解工艺优化及其氨基酸组成分析
刘斯汝 罗龙龙 任卫合 丁功涛 谢雕雕 冶文博 陈士恩 Sharizah ALIMAT
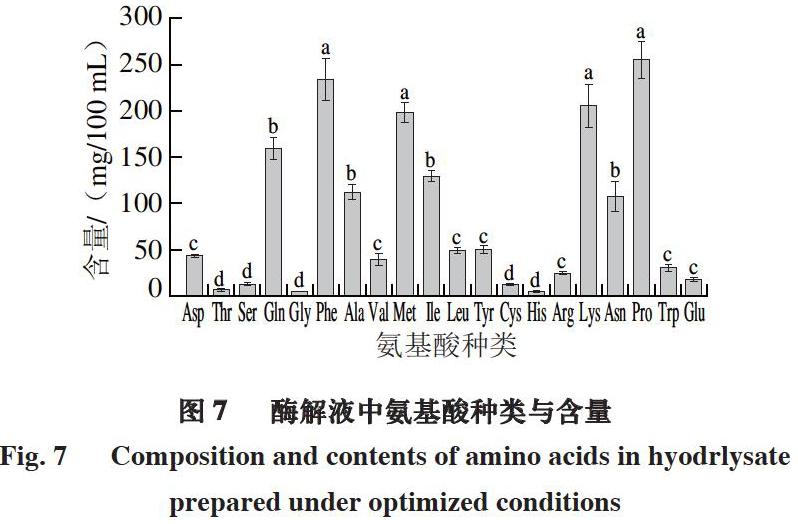

摘 要:采用牛肉屠宰加工中废弃碎肉渣制成的冻干肉粉为原材料,以蛋白酶解度为评价指标,探究碱性蛋白酶与风味蛋白酶组成的复合酶最佳酶解条件。在单因素试验基础上,采用5因素3水平正交试验对酶解条件进行优化,并测定最终酶解液中游离氨基酸的种类与含量。结果表明:最佳酶解工艺为酶添加量4%、碱性蛋白酶与风味蛋白酶质量比1∶5、酶解温度50 ℃、pH 8.5、肉粉蛋白添加量5%、酶解时间8 h,在该条件下,牛肉蛋白水解度为(45.7±0.6)%;酶解液中氨基酸分为3 个含量区段,其中脯氨酸含量最高,为(256.20±18.65) mg/100 mL,甘氨酸含量最低,为(4.46±0.56) mg/100 mL。
关键词:风味蛋白酶;碱性蛋白酶;牛肉;氨基酸
Abstract: Beef trimmings as a waste from beef slaughter and processing were ground and freeze-dried before being hydrolyzed with combinations of alkaline protease and flavourzyme. Hydrolysis conditions were optimized using one-factor-at-a-time method combined with a five-factor, three-level orthogonal array design based on degree of hydrolysis (DH). The amino acid composition of the hydrolysate prepared using the optimized conditions was determined. The optimum hydrolysis conditions were found to be total enzyme amount of 4%, alkaline protease/flavourzyme ratio of 1:5 (m/m), temperature of 50 ℃, pH of 8.5, substrate concentration of 5%, and time of 8 h. Experiments conducted under these conditions gave a DH of (45.7 ± 0.6)%. In the resulting hydrolysate, the contents of proline and glycine were the highest and lowest, (256.20 ± 18.65) and (4.46 ± 0.56) mg/100 mL, respectively.
Keywords: flavourzyme; alkaline protease; beef; amino acid
DOI:10.7506/rlyj1001-8123-20200824-206
中圖分类号:TS201.1 文献标志码:A 文章编号:1001-8123(2020)11-0021-06
重猪肉、轻牛羊肉的肉品消费结构一直是我国人民的消费现状[1],随着经济的发展,自2012年后我国牛肉的消费需求迅速上升,这其中主要以受到西餐文化影响的沿海发达地区为主,且城镇明显高于乡村,截止到2017年,我国牛肉消费总量为794 万t,位居世界第一[2]。目前我国肉牛生产养殖与初级屠宰加工地大多位于我国西部与北方地区,随着牛肉供求矛盾的日益上升,加上当地经济水平低下,使得肉牛屠宰加工规范的监管力度严重不足,这导致牛肉在屠宰初加工中产生了大量副产品与废弃物[3-4]。其中骨、血液、内脏、油脂及碎肉残渣等为主要副产品,对于这些副产品的处理,目前主要用于制备工业油、骨粉、肥料及燃料等,现有的研究对于此类副产品的处理多采用酶解法、化制法及微生物发酵法等[5],其中酶解法是最为环保、安全、高效及高质量的方法。由于不同酶切割位点不同,单一酶的酶解效果普遍较差,而复合酶可以使得不同酶切割位点相互补充,因此成为目前常用的酶解方法之一[6]。目前常用的酶制剂有风味蛋白酶、碱性蛋白酶、菠萝蛋白酶及木瓜蛋白酶等,木瓜蛋白酶与菠萝蛋白酶常用于植物的酶解及肉的嫩化工艺[7-8],而Drenth等[9]发现,木瓜蛋白酶对蛋白胨的酶解效果较差。Pavan等[10]在菠萝蛋白酶的研究中发现其对肌纤维蛋白原酶解效果较差。目前碱性蛋白酶与风味蛋白酶是肉类酶解中常用的酶,碱性蛋白酶对肽键、酰胺键及酯键等均有良好的水解效果,而风味蛋白酶具有改善酶解产品质量、降低成本及提高水解度等优点[11-12]。另外,以往研究牛肉酶解的工艺较为单一,酶解效率低下,时间成本高昂,因此提出利用碱性蛋白酶与风味蛋白酶组成的复合酶对牛肉的酶解工艺进行优化,选出最优酶解条件,并测定酶解液中氨基酸成分及含量,为牛肉副产品酶解产物在氨基酸有机肥及动物氨基酸饲料添加剂等方面的应用提供参考,为屠宰副产物高值化利用提供依据。
1 材料与方法
1.1 材料与试剂
牛肉屠宰加工废弃副产品,即牛肉碎渣边角料来自甘肃天祝县华藏寺屠宰场的西门塔尔牛,以下简称牛肉副产品。
碱性蛋白酶(400 000 U/g)、风味蛋白酶(200 000 U/g) 广西庞博生物工程有限公司;甲醛、氢氧化钠、盐酸、硫酸、三氯乙酸、茚三酮(均为分析纯) 武汉赛维尔有限责任公司兰州分公司。
1.2 仪器与设备
0.45 μm、0.22 μm滤膜 天津津腾实验设备有限公司;LGJ-20F真空冷冻干燥机 北京松源华兴生物技术有限公司;JRJ-100绞肉机 瑞恒食品机械公司;XL-06A粉碎机 旭朗机械有限公司;J-HH-4A恒温水浴锅 上海胜卫电子科技公司;Kjeltec8200凯氏定氮仪 丹麦福斯分析仪器公司;Seven2Go酸度计 瑞士梅特勒-托利多集团;HT-1010全自动氨基酸分析仪 青岛海泰亿诺科技有限公司。
1.3 方法
1.3.1 样品前处理
肉样经绞肉机搅碎后置于真空冷冻干燥机中-45 ℃冷冻干燥36 h后取出,冻干样品用粉碎机粉碎后置于干燥的蓝口瓶中,封口膜密封,4 ℃保存备用。
1.3.2 样品蛋白质含量测定
参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》,采用凯氏定氮法测定。测得干燥后的肉粉中蛋白质含量为73.6%。
1.3.3 蛋白水解度测定
参照GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》,采用甲醛滴定法测定。
1.3.4 单因素试验
取500 mL锥形瓶,加入100 mL蒸馏水,加入冻干肉粉,根据冻干肉粉加入量及其蛋白质含量计算得到肉粉蛋白添加量,加入不同比例的碱性蛋白酶与风味蛋白酶(加入量为在冻干肉粉蛋白中占比),将酶解体系放入恒温摇床定时反应,每个实验重复5 次。
以蛋白水解度为指标,分别按酶添加量(1%、2%、3%、4%、5%)、酶添加比例(碱性蛋白酶与风味蛋白酶质量比1∶1、1∶2、1∶3、1∶4、1∶5)、肉粉蛋白添加量(4%、5%、6%、7%、8%)、pH值(7.0、7.5、8.0、8.5、9.0)、酶解温度(40、45、50、55、60 ℃)、酶解时间(2、4、6、8、10 h)的顺序对各个单因素对蛋白水解度的影响进行研究,且以碱性蛋白酶与风味蛋白酶质量比1∶1、肉粉蛋白添加量5%、pH值7.5、酶解温度45 ℃、酶解时间6 h作为起始条件,前一因素单因素试验中蛋白水解度最大值对应的条件作为后一因素水平,依次类推。
1.3.5 正交试验
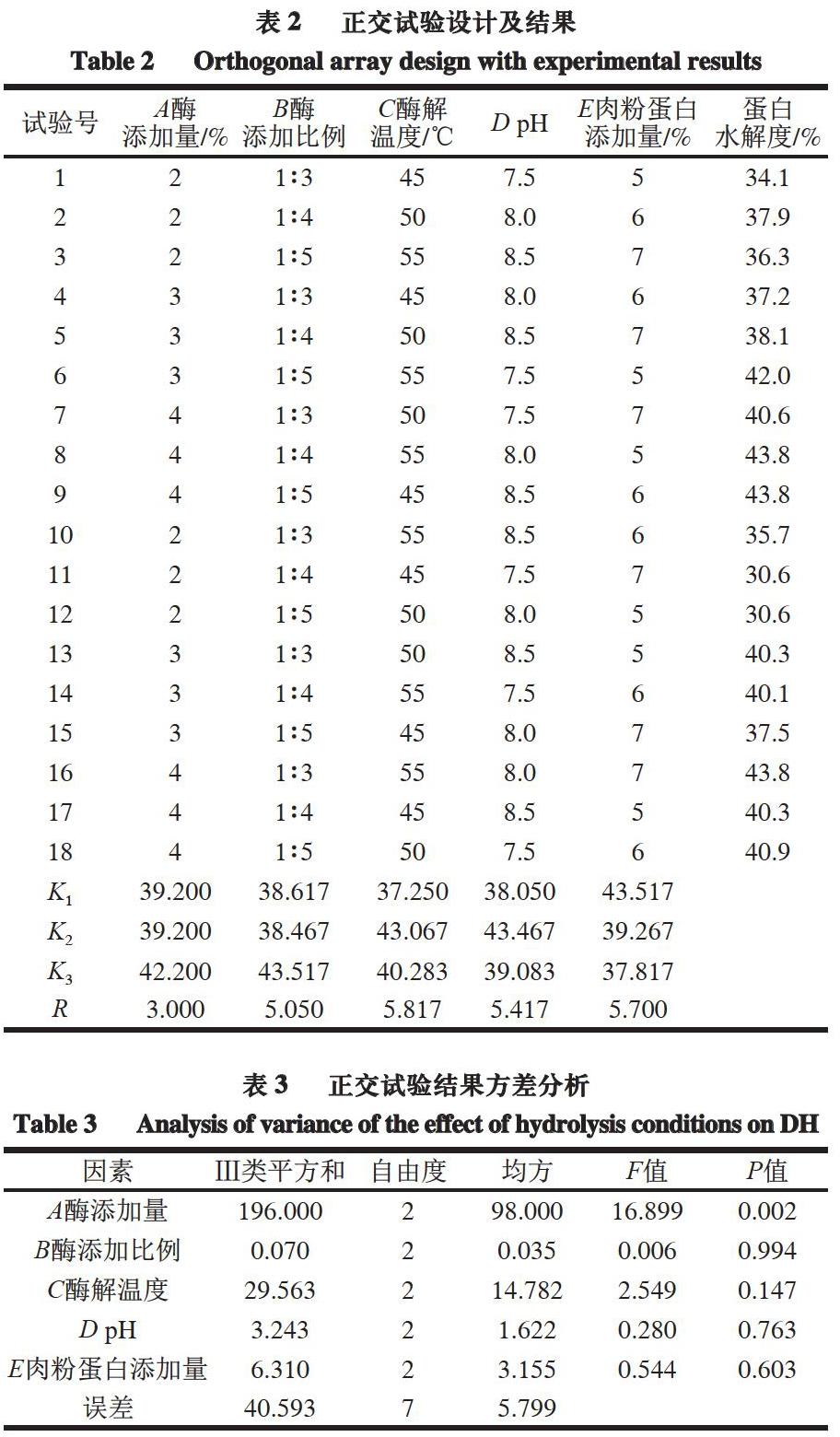
在单因素试验基础上,以蛋白水解度为指标,以酶解温度、pH值、肉粉蛋白添加量、酶添加量、酶添加比例为考察指标,设计L18(35)正交试验,优化酶解工艺,正交试验因素水平见表1。
1.3.6 酶解液中氨基酸组成测定
按照最佳酶解条件酶解后,酶解液置于100 ℃水浴中灭活15 min,待酶解液冷却,纱布粗滤后将样品经0.45 μm滤膜过滤,静置20 min;向1 mL样品中加入0.25 mL 37 g/100 mL三氯乙酸,混匀,4 ℃过夜(12 h)。过夜样品8 000 r/min离心3 min后取上清液,0.22 μm过膜稀释20 倍后,使用全自动氨基酸分析仪测定。
1.4 数据处理
采用SPSS软件对结果进行统计学分析,实验数据以平均值±标准差表示,对单因素试验结果进行Duncans新复极差法差异显著性分析,正交试验结果采用多因素方差分析进行差异显著性分析。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 酶添加量对牛肉副产品蛋白水解度的影响
由图1可知,随着酶添加量的增加,蛋白水解度不断上升,在酶添加量为3%时达到最大,酶添加量增加至4%时,蛋白水解度略微下降但与酶添加量3%时差异不显著,当酶添加量增加至5%时,蛋白水解度出现显著下降趋势。由此可见,在底物充分的情况下,在一定范围内增加酶的用量反应速率也会相应增加,因此酶解效率得以显著提升[13]。当酶添加过量时,水解度出现下降趋势,原因可能是过量的酶分子相互竞争,使其无法与底物分子的活性位点高效结合,导致酶促反应速率下降,单位时间内的水解度降低[14]。综合考虑选择酶添加量2%~4%作为酶添加量优化水平。
2.1.2 酶添加比例对牛肉副产品蛋白水解度的影响
由图2可知,酶添加比例为1∶4时,蛋白水解度达到最大,且较其余各添加比例均存在显著差异(P<0.05)。之后,随着酶添加比例升高,蛋白水解度逐渐下降,这可能与碱性蛋白酶和风味蛋白酶的酶切位点不同有关[15],碱性蛋白酶作为内切酶,在水解过程中能切断多肽内部的肽键,形成短的肽链[16],能更大程度将蛋白质水解为大分子肽段,而风味蛋白酶具有内切酶与外切酶2 种活性,能更好地将大分子肽段分解为氨基酸和小分子多肽[17],因此随着风味蛋白酶添加比例的增加,蛋白水解度有一定程度的下降。综合考虑选择酶添加比例1∶3~1∶5作为复合酶添加比例优化范围。
2.1.3 肉粉蛋白添加量对牛肉副产品蛋白水解度的影响
由图3可知,当肉粉蛋白添加量为6%时,蛋白水解度达到最大,之后随着肉粉蛋白添加量的升高,蛋白水解度逐渐下降。这是由于在酶添加量保持不变条件下,一定范围内,酶促反应速率與肉粉蛋白添加量呈正比,但是过量的底物会增大水解液的黏稠程度,导致蛋白酶在水解液中分布不均,蛋白酶分子与底物分子结合效率降低,从而抑制水解反应的进行;过量的底物与酶分子结合,生成无活性的中间产物,也会影响酶的活性[18]。因此选择肉粉蛋白添加量5%~7%作为优化范围。
2.1.4 pH值对牛肉副产品蛋白水解度的影响
酶在最适的pH值范围表现出较好活性,过高或过低的pH值均会导致酶活性降低[19]。由图4可知,pH值较低时,蛋白水解度随着pH值升高不断上升,在pH 8.0时达到峰值,之后随着pH值升高蛋白水解度显著下降(P<0.05),其原因可能为过高的pH值改变了酶分子与底物分子的带电状态,从而降低了酶与底物的结合效率,过低或过高的pH值都会影响酶的稳定性,因此导致蛋白水解度逐渐下降。综合考虑选择pH 7.5~8.5作为pH值的优化范围。
2.1.5 酶解温度对牛肉副产品蛋白水解度的影响
由图5可知,当酶解温度为50 ℃时,蛋白水解度达到最大,较其他各组均有显著差异(P<0.05),而后随着酶解温度的升高,蛋白水解度逐渐下降,这是由于随着酶解温度升高,反应物分子获得能量,分子运动速率加快,使得有效碰撞次数增加,酶促反应速率加快,但过高或过低的酶解温度均会影响酶的活性,温度过低不仅影响酶活力,还会使得酶与底物结合效率降低,抑制酶促反应速率,温度过高则会导致蛋白酶结构发生不可逆的破坏,从而影响酶解效果[20],因此选择酶解温度45~55 ℃作为优化水平。
2.1.6 酶解时间对牛肉副产品蛋白水解度的影响
由图6可知,在8 h前,随着酶解时间的延长,蛋白水解度逐渐升高,8 h后增加趋于平缓,且随着酶解时间的延长,蛋白水解度无显著增加,这可能是由于长时间的酶促反应使得反应体系中底物含量降低,从而导致酶分子与底物分子结合速率减慢,反应速率下降,最终导致水解度增加趋势平缓。另外,水解产物使得反应体系的pH值逐渐下降,酶的活性也会受到一定程度的影响[21]。继续延长反应时间,反应效果并不显著,增加反应时间还会增加成本。因此选择8 h作为复合酶酶解时间。
2.2 正交试验结果与分析
在单因素试验基础上,以蛋白水解度作为指标,选择酶添加量、酶添加比例、肉粉蛋白添加量、酶解温度、pH值为自变量,进行5因素3水平的正交试验。
由表2~3可知,各因素对于酶解效果的影响程度为C>E>D>B>A,即酶解温度>肉粉蛋白添加量>pH值>酶添加比例>酶添加量,酶解最佳工艺为A3B3C2D2E1,即酶添加量4%、酶添加比例1∶5、酶解温度50 ℃、pH 8.5、肉粉蛋白添加量5%、酶解时间8 h。因素A,即酶添加量对酶解效果的影响极显著(P<0.01),从而进一步说明酶添加量在反应中的重要作用。
2.3 验证实验结果
依据正交试验中得到的最佳酶解条件,进行3 次平行验证实验,结果表明,在最佳水解条件A3B3C2D3E1下得到蛋白水解度为(45.7±0.5)%,高于正交试验中的最高值(43.8±0.8)%,表明本研究的酶解工艺具有较高的可行性。故确定复合酶对于牛肉蛋白质的最佳酶解工艺为酶添加量4%、酶添加比例1∶5、酶解温度50 ℃、pH 8.5、肉粉蛋白添加量5%、酶解时间8 h。
2.4 酶解液氨基酸组成测定结果
由图7可知,最终测定牛肉酶解产物中氨基酸组成后发现,酶解液中含有20 种氨基酸,其分布可按照含量大致分为3 个区段,高含量区段为脯氨酸、赖氨酸、苯丙氨酸及甲硫氨酸,其中脯氨酸含量最高,中含量区段为谷氨酰胺、丙氨酸、异亮氨酸及天冬氨酸,剩余均为低含量区段,其中甘氨酸与苏氨酸含量最低。
3 讨 论
研究表明,分子质量较小的氨基酸及多肽能迅速被动植物吸收利用[22],因此将动物屠宰废弃物制成氨基酸肥料或饲料添加剂,可以使得屠宰加工废弃物在种植、养殖行业实现高价值的回收利用,从而达到循环经济的目的。现如今氨基酸肥料及饲料添加剂领域大多以发酵产出及菌类产出为主,而使用动物肉制品酶解生产由于成本较高,几乎没有相关研究[23],鉴于以往屠宰废弃物焚烧、粉碎添加饲料等处理方式,酶解法具有高效、安全等传统方法无可比拟的优势。关于氨基酸制剂对动植物的影响研究甚多,如陈伟等[24]对草莓的研究中发现,氨基酸肥能显著提高草莓绿素含量,从而提高草莓产量,改善草莓果实品质。张书强等[25]发现,多肽肥料具有提高农作物产量、改善品质、提高抗逆性等作用。在动物研究方面,常银莲等[26]发现,增加饲料中支链氨基酸水平能够促进肉鸡肠道生长发育并加快损伤肠道的修复。另有研究发现,饲料中氨基酸的合理添加能显著提高育肥猪的生长性能,有效改善育肥猪机体的免疫能力并缩短育肥周期[27]。由此可见,动物屠宰副产品酶解产物在动植物肥料、饲料等应用方面具有广阔的前景。
脯氨酸是植物的四大必需氨基酸之一,对促进植物生长具有重要意义,由于哺乳动物可以自身合成脯氨酸,因此外源添加对于动物意义不大[28];赖氨酸对动物而言具有提高免疫力、减少应激、缓解焦虑情绪等作用[29],苯丙氨酸是合成神经递质的重要氨基酸,甲硫氨酸具有保护肝脏、减少肝脏毒副作用、合成蛋白及减少动物应激等作用[30-31],高含量的甲硫氨酸可以有效减少酶解产物中丙氨酸及天冬氨酸的肝脏毒副作用[32]。由此可见,牛肉酶解产物适合在植物领域广泛应用,而在动物饲料添加剂中更适合在动物运输、外界应激较强的情况下使用。
4 结 论
在单因素试验基础上,通过正交试验优化屠宰加工中废弃牛肉碎肉的复合酶酶解工艺,确定最佳酶解工艺为酶添加量4%、碱性蛋白酶与风味蛋白酶添加比例1∶5、酶解温度50 ℃、pH 8.5、肉粉蛋白添加量5%、酶解时间8 h,在此条件下,蛋白酶解度为(45.7±0.5)%,高于正交試验中的最高值(43.8±0.8)%;酶解液中氨基酸种类丰富,酶解产物在氨基酸液体肥、动物饲料添加剂等方面具有较高的实用价值。
参考文献:
[1] 何忠伟, 赵海燕, 刘芳, 等. 中国肉牛肉羊生产消费特征及展望[J]. 农业展望, 2013, 9(9): 50-56. DOI:10.3969/j.issn.1673-3908.2013.09.012.
[2] 王楚婷, 刘爱军, 王远浓. 中国牛肉市场的供给与需求分析[J]. 福建茶叶, 2020, 42(3): 57-59.
[3] 韩志立. 肉牛屠宰加工中影响牛肉品质的关键工序的探讨[J]. 肉类工业, 2017(9): 46-48. DOI:10.3969/j.issn.1008-5467.2017.09.011.
[4] 吴斌. 浅谈如何加强牛羊家禽屠宰监督管理工作[J]. 中國畜禽种业, 2019, 15(8): 57-58. DOI:10.3969/j.issn.1673-4556.2019.08.045.
[5] 倪娜, 齐月, 穆莎茉莉, 等. 畜禽屠宰副产物附加值提升技术的研究与应用[J]. 黑龙江畜牧兽医, 2015(6): 67-70. DOI:10.13881/j.cnki.hljxmsy.2015.0953.
[6] 许雄, 孙灵霞, 李苗云, 等. 酶解畜禽骨肉的研究进展[J]. 安徽农业科学, 2008, 36(9): 202-203; 239. DOI:10.3969/j.issn.0517-6611.2008.09.086.
[7] WANG Xianrong. Research and application of papain[J]. Journal of China Agricultural University, 2005, 10(6): 11-15. DOI:10.3321/j.issn:1007-4333.2005.06.004.
[8] 吴茂玉, 马超, 乔旭光, 等. 菠萝蛋白酶的研究及应用进展[J]. 食品科技, 2008(8): 17-20. DOI:10.3969/j.issn.1005-9989.2008.08.005.
[9] Drenth J, Jansonius J N, Koekoek R. The structure of papain[J]. Advances in Protein Chemistry, 1971, 25: 79-115. DOI:10.1038/218929a0.
[10] Pavan R, Jain S, Shraddha, et al. Properties and therapeutic application of bromelain: a review[J]. Biotechnology Research International, 2012(1): 1-6. DOI:10.1155/2012/976203.
[11] Osamu T, Yohei Y, Takehiko I, et al. An alkaline protease of an alkalophilic Bacillus sp.[J]. Current Microbiology, 1986, 14(1): 7-12. DOI:10.1007/BF01568094.
[12] 刘睿, 李才国, 刘鼎一. 7S球蛋白的风味蛋白酶改性和功能性质评价[J]. 华中农业大学学报(自然科学版), 2007, 26(2): 263-266. DOI:10.13300/j.cnki.hnlkxb.2007.02.029.
[13] Barabino R C, Gray D N, Keyes M H. Coupled reactions of immobilized enzymes and immobilized substrates: clinical application as exemplified by amylase assay[J]. Clinical Chemistry, 1978, 24(8): 1393-1398. DOI:10.1016/S0009-9120(78)80019-8.
[14] 陈银霞. 影响酶促反应速度的外因研究[J]. 现代农业科技, 2008(18): 238-239. DOI:10.3969/j.issn.1007-5739.2008.18.166.
[15] Mandana L, Keyvan B, Hashem N. Evaluation of alkaline protease production and optimization of culture medium by Yarrowia lipolytica[J]. Geomagnetism and Aeronomy, 2015, 13(8): 2174-2182. DOI:10.1021/ma00162a012.
[16] 孔露, 孔茂竹, 余佳熹, 等. 响应面优化碱性蛋白酶法提取藜麦淀粉工艺[J]. 食品研究与开发, 2020, 41(2): 100-106.
[17] LI Feng, YAN Qiao, ZOU Yufeng, et al. Effect of flavourzyme on proteolysis, antioxidant capacity and sensory attributes of Chinese sausage[J]. Meat Science, 2014, 98(1): 34-40. DOI:10.1016/j.meatsci.2014.04.001.
[18] 陈铁茹, 王亚杰. 影响酶促反应因素的探讨[J]. 黑龙江医学, 2002, 26(6): 443. DOI:10.3969/j.issn.1004-5775.2002.06.038.
[19] Bee G, Anderson A L, Lonergan S M, et al. Rate and extent of pH decline affect proteolysis of cytoskeletal proteins and water-holding capacity in pork[J]. Meat Science, 2007, 76(2): 359-365. DOI:10.1016/j.meatsci.2006.12.004.
[20] 黄瑞林, 李铁军, 譚支良, 等. 透析管体外消化法测定饲料蛋白质消失率的适宜酶促反应条件研究[J]. 动物营养学报, 1999(4): 51-58.
[21] 王永梅, 张锋. “探究pH对酶活性影响”实验的拓展[J]. 生物学教学, 2018, 43(10): 37-38. DOI:10.3969/j.issn.1004-7549.2018.10.021.
[22] 尹树花, 郭丽梅, 刘宏魏. 酶解植物蛋白制备小分子肽的研究进展[J]. 江西饲料, 2007(4): 11-14. DOI:10.3969/j.issn.1008-6137.2007.04.005.
[23] 李荣华, 刘友民. 氨基酸生物有机肥及其制备方法[J]. 科技开发动态, 2005(7): 42-43.
[24] 陈伟, 陈謇, 应霄, 等. 叶面喷施含氨基酸水溶肥在草莓上的施用效果[J]. 浙江农业科学, 2020, 61(2): 239-242. DOI:10.16178/j.issn.0528-9017.20200210.
[25] 张书强, 许孝瑞, 王萌. 多肽在作物生长发育中的作用与展望[J]. 中国农业信息, 2014(1): 288-297. DOI:10.3969/j.issn.1672-0423.2014.01.238.
[26] 常银莲, 刘国华, 常文环, 等. 支链氨基酸对肉鸡生长性能及肠道发育的影响[J]. 动物营养学报, 2016, 28(1): 79-91. DOI:10.3969/j.issn.1006-267x.2016.01.012.
[27] 王伟明, 张立泰, 何健. 补充氨基酸之猪低蛋白质饲粮研究进展[J]. 养猪, 2018(5): 25-31. DOI:10.13257/j.cnki.21-1104/s.2018.05.007.
[28] HILT Z T, MORRELL C N. Essential amino acids: essential in arterial thrombosis[J]. Circulation, 2020, 142(1): 65-67. DOI:10.1161/CIRCULATIONAHA.120.046817.
[29] 王帅, 王红芳, 刘振国, 等. 赖氨酸在蜜蜂中的营养功能及其研究进展[J]. 蜜蜂杂志, 2016, 36(10): 9-11. DOI:10.3969/j.issn.1003-9139.2016.10.004.
[30] ADAMSKA-BARTLOMIEJCZYK A, LIPINSKIP F J, PIEKIELNA-CIESIELSKA J, et al. Pharmacological profile and molecular modeling of cyclic opioid analogues incorporating various phenylalanine derivatives[J]. ChemMedChem, 2020, 15(14): 1322-1329. DOI:10.1002/cmdc.202000248.
[31] 范秋丽, 马现永. 甲硫氨酸的生产及其在畜禽饲料中应用研究[J]. 广东饲料, 2017, 26(6): 30-32.
[32] 鲁海军, 单安山. 蛋氨酸及其类似物的作用及应用[J]. 饲料博览, 2005(3): 14-17. DOI:10.3969/j.issn.1001-0084.2005.03.005.

