外源ABA对低温胁迫下小豆幼苗生理及产量的影响
项洪涛,李 琬,郑殿峰,王诗雅,何 宁,王曼力,王彤彤,杨纯杰,李 博
(1.黑龙江省农业科学院耕作栽培研究所,黑龙江 哈尔滨 150086;2. 广东海洋大学滨海农业学院,广东 湛江 524088;3.黑龙江八一农垦大学农学院,黑龙江 大庆 163319)
小豆(Vignaangularis),又名红豆、赤小豆、红小豆等,是豆科豇豆属一年生草本植物,属药食兼用作物。小豆对环境的适应性很强,在瘠薄地、盐碱地、干旱地均可生长,是喜温喜光不耐冷、短日照作物,在东亚地区有较长的栽培历史[1]。温度是作物生长的重要环境条件,每种植物都有其独特的最佳生育温度,小豆对温度条件较为敏感,最适生育温度是20℃~24℃,低于该温度即发生低温胁迫甚至产生冷害[2]。低温在植物生长的不同时期均可能发生,并对农业可持续发展造成严重威胁[3]。小豆因其遗传特性,子叶不出土,所以在种子萌发和幼苗建植期活力较弱,对低温的抵御和适应能力差,更容易受到低温伤害。低温影响植物生长和代谢,使植株体内活性氧(reactive oxygen species,ROS)自由基大量积累,植物通过体内的防御机制能够清除一部分ROS,但未被及时清除的ROS积累在植物体内,加剧植物细胞膜脂过氧化伤害,并对细胞膜系统产生损害[4],破坏作物正常的理化代谢功能和途径,最终造成作物减产。
植物内源激素调控植物的生长及对逆境的应答[5]。ABA是20世纪60年代发现和鉴定出的一种植物内源激素,在植物对胁迫耐受性和抗性中发挥着重要作用。外源激素通过改变内源激素水平调节植物生理代谢,低温胁迫下外源ABA能够促进植物体内ABA的合成和运输[6],进而调控植物的抗逆性。项洪涛等[7]研究得出,外源ABA能够提高低温胁迫下植物体内SOD、POD以及CAT的活性,并可同时提高脯氨酸、可溶性糖等可溶类物质的含量,抵御低温伤害。李平等[8]研究得出低温条件下外源ABA能够降低黄瓜叶片内MDA的积累,缓解胁迫。方彦等[9]研究得出,外源ABA能提高油菜种子的抗氧化酶活性,同时减缓膜质过氧化物MDA的积累,具有提高作物抗寒性的诱导效应。Xiang等[10]研究表明,低温条件下外源ABA能提高水稻叶片内脯氨酸、可溶性糖和可溶性蛋白含量,有效提高SOD、POD和CAT活性,增强水稻的抗冷性。蒲高斌等[11]研究得出低温胁迫下外源ABA能有效提高西瓜幼苗叶片中SOD和CAT活性、降低MDA的积累,维持膜的完整性,同时促进渗透保护物质脯氨酸和可溶性糖的增加,增强植株的抗寒性,同时也表明这是外源ABA有效提高西瓜幼苗抗冷性、减轻低温对西瓜苗伤害的主要生理基础。但鲜有关于外源ABA提高小豆幼苗抗性的报道。叶片是小豆重要的光合器官,起到合成并供给同化产物的重要作用,当小豆受到低温胁迫时,叶片的光合能力首先会遭受影响,对养分供给、生理代谢都会产生阻碍并影响幼苗建植,最终导致产量下降。本试验于幼苗期对小豆进行低温处理,开展低温胁迫下ABA对小豆叶片抗逆生理及产量的影响研究,旨在分析外源ABA抵御小豆苗期低温的作用,丰富东北地区小豆抗冷技术工程体系,为小豆耐冷栽培、高产优质生产提供理论支持。
1 材料与方法
1.1 试验材料
小豆试验品种选用龙小豆4号和天津红。龙小豆4号为耐冷品种,天津红为冷敏品种。供试材料由国家食用豆产业技术体系芸豆育种岗位专家魏淑红研究员馈赠。
供试植物外源激素为ABA,由国家食用豆产业技术体系栽培生理岗位实验室提供。
1.2 试验设计
试验于2019年4月30日和5月25日在黑龙江省农业科学院耕作栽培研究所盆栽场及人工气候室内进行接种,开展2次重复性试验,由于2次试验规律一致,本研究选用4月30日播种试验所测数据。采用盆栽方式,试验用盆高30 cm、直径25 cm,每盆装自然风干壤土7.0 kg,播种后覆土200 g,每盆保苗15株(5穴×3株)。试验用土取自哈尔滨市道外区民主乡,土壤类型为草甸黑土。供试土壤的理化性质:土壤容重约为1.72 g·cm-3,最大田间持水量约为25.65%,有机质含量26.3 g·kg-1、全氮1.46 mg·g-1、全磷0.66 mg·g-1、缓效钾325.7 mg·kg-1、碱解氮0.165 g·kg-1、速效磷41.25 mg·kg-1、速效钾156.7 mg·kg-1、土壤pH 6.69。4月18日播种(阳光型人工气候室内播种,哈尔滨地区4月中旬室外温度相对偏低,不利出苗),每品种分别播种75桶,选取长势均匀的样本进行试验,试验共设6个处理,每个处理设3次重复,具体设计见表1。待植株生长至幼苗期时(4月30日,此时真叶完全展开,第一片复叶露头)进行低温处理,处理温度为恒定4℃。进行低温处理当天上午10∶00,采取叶面喷施方式施用外源ABA,使用浓度为20 mg·L-1(该浓度系课题组前期浓度比较试验所得),折合用液量为22.5 mL·m-2。喷施完毕后,于当晚20∶30进入事先预冷的人工气候室冷房内进行低温处理,持续时间为12 h,CK处理温度为人工气候室内自然温度(当日夜间温度为17℃),次日上午8∶30停止低温处理。并进行第一次取样,之后每天上午8∶30取样,共取样5次,记为取样第1~5天。

表1 试验设计方案
1.3 测定项目及方法
1.3.1 取样方法 低温处理后,连续取样5次,每天上午8∶30取样一次,各处理分别进行取样,将小豆植株叶片迅速剪下装入标记好的自封袋内,并立即放入液氮中,而后置于-80℃冰箱中保存,供测定生理指标使用。
待到5月15日,各处理分别移至室外盆栽场10盆,每日观察并进行间苗、拔草等,最终每桶保苗5株(5穴×1株),根据实际气温和降雨情况,适时浇水直至成熟,进行产量调查。
1.3.2 测定方法 采用氮蓝四唑(NBT)法测定超氧化物歧化酶(SOD)活性,愈创木酚法测定过氧化物酶(POD)活性,采用分解过氧化氢含量速率法测定过氧化氢酶(CAT)活性,采用硫代巴比妥酸(TBA)法测定丙二醛(MDA)含量,可溶性蛋白含量的测定采用考马斯亮蓝G-250染色法;具体操作规程按照李合生等[12]的方法;可溶性糖含量测定采用硫酸蒽酮比色法,脯氨酸含量测定采用茚三酮比色法;具体操作规程按照张宪政等[13]的方法。
1.4 数据处理
试验所有数据利用Excel 2010进行处理和作图,使用DPS软件进行显著性差异分析。
2 结果与分析
2.1 外源ABA对低温胁迫下小豆幼苗叶片H2O2和MDA含量的影响
2.1.1 对叶片H2O2含量的影响 由图1可知,幼苗期低温处理后,随着取样时间的延续小豆叶片H2O2含量呈下降趋势。第1天取样,龙小豆4号H2O2含量的高低顺序为T2>T3>T1,其中T2较T1高34.82%,T3较T2低7.63%,方差分析结果表明各处理间差异极显著;天津红H2O2含量的高低顺序为T5>T6>T4,其中T5较T4高27.10%,T6较T5低8.36%,方差分析结果表明各处理间差异也达到极显著水平。第2天取样,龙小豆4号H2O2含量的高低顺序为T2>T3>T1,方差分析结果表明T2极显著高于T1、显著高于T3,但T1和T3之间没有显著差异;天津红H2O2含量的高低顺序为T5>T6>T4,方差分析结果表明T5极显著高于T4和T6,而T6显著高于T4,未达到极显著水平,说明外源ABA预喷施能够相对降低H2O2含量。从第3天取样开始,不论是龙小豆4号还是天津红,方差分析结果表明各处理H2O2含量之间没有显著差异。
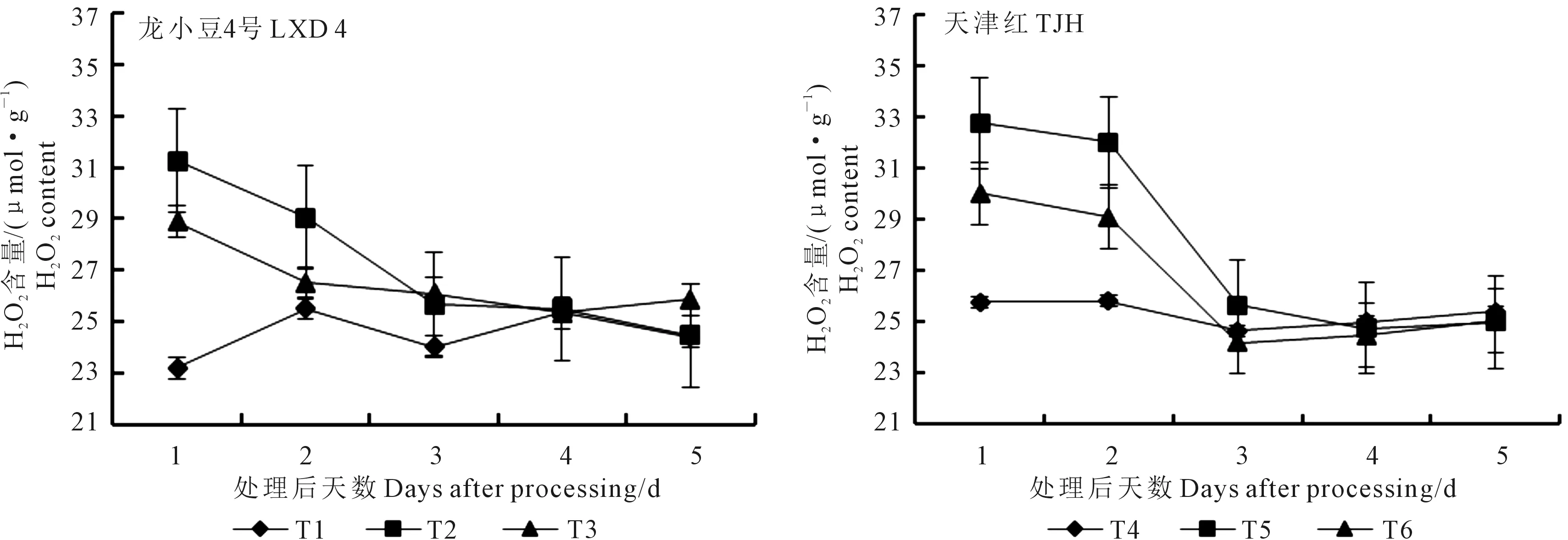
图1 外源ABA对低温胁迫下小豆幼苗叶片H2O2含量的影响
2.1.2 对叶片MDA含量的影响 由图2可知,幼苗期低温处理后,随着恢复自然温度时间的延长,小豆茎内MDA含量呈下降趋势。前3次取样,龙小豆4号MDA含量的高低顺序为T2>T3>T1;天津红MDA含量的高低顺序为T5>T6>T4。第1天取样,龙小豆4号T2较T1高65.56%,T3较T2低10.18%,经方差分析可知各处理间差异极显著;天津红T5较T4高83.79%,T6较T5低20.27%,方差分析结果表明各处理间差异达到极显著水平。第2天取样时,方差分析结果表明:龙小豆4号T2的MDA含量极显著高于T1,但T3与T1和T2之间没有显著差异;天津红T5处理的MDA含量极显著高于T4和T6,而T6显著高于T4。第3天取样,方差分析结果表明:龙小豆4号T2的MDA含量显著高于T1,但T3与T1和T2之间没有显著差异;天津红T5处理的MDA含量极显著高于T4、显著高于T6,而T6和T4之间没有显著性差异。第4天和第5天取样,分别对龙小豆4号和天津红进行方差分析,结果表明各处理间差异均不显著。整体看外源ABA预喷施能够相对降低MDA含量,有利于小豆快速恢复正常生理活动,缓解低温胁迫。
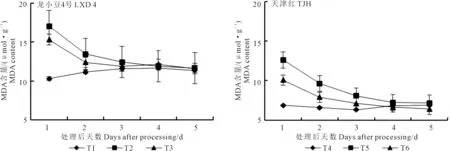
图2 外源ABA对低温胁迫下小豆幼苗叶片MDA含量的影响
2.2 外源ABA对低温胁迫下小豆幼苗叶片抗氧化酶系统的影响
2.2.1 对叶片SOD活性的影响 由图3可知,低温处理后小豆叶片SOD活性相应提高。整体看龙小豆4号的活性高于天津红,这与其耐冷性强有关。第1~5天取样,龙小豆4号的T3处理的SOD活性均高于T1和T2。第1天取样,T2较T1高6.67%,T3较T2提高9.06%;第2天取样活性达到最高,T3比T2和T1分别高出22.94%和18.93%;从第2天取样开始,T3活性降低,直到第5天取样,各处理SOD活性趋于接近。方差分析结果表明,第1天取样,T3显著高于T1,但T3与T2之间差异不显著;第2天取样,T3极显著高于T1和T2;第3天取样,T3显著高于T1,但T3与T2之间差异不显著;第4天取样,T3显著高于T1,显著高于T2,同时T2显著高于T1;第5天取样,各处理间SOD活性无显著性差异。各取样时期,天津红的SOD活性均为T6>T5>T4。第1天取样,T5较T4高18.48%,T6较T5高13.57%,方差分析可知T6极显著高于T4,显著高于T5;第2天取样,T6极显著高于T4和T5,T5极显著高于T4;第3天取样,T6和T5极显著高于T4,但T6与T5之间差异不显著;第4天取样,T6极显著高于T4和T5,T5极显著高于T4;第5天取样,T6显著高于T4和T5,T5和T4之间无显著性差异。
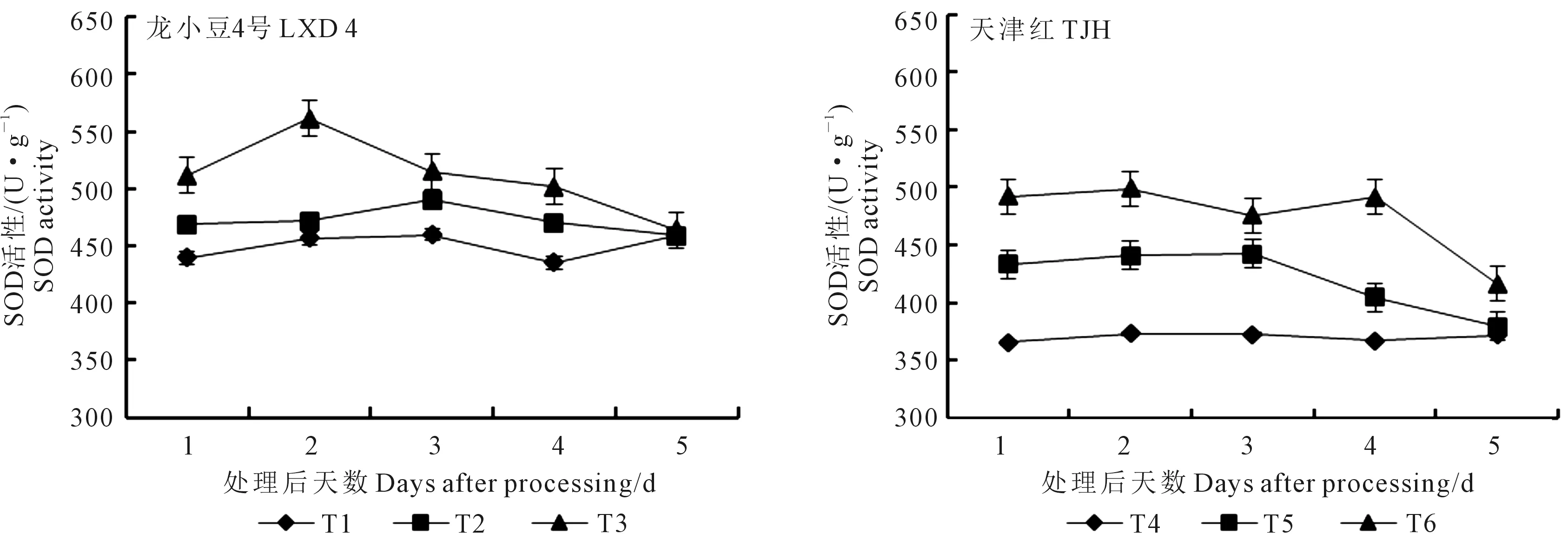
图3 外源ABA对低温胁迫下小豆幼苗叶片SOD活性的影响
2.2.2 对叶片POD活性的影响 从图4可以看出,幼苗期低温处理后小豆叶片POD活性大致呈下降趋势。龙小豆4号在取样第1天各处理的POD活性最高,其高低顺序是T3>T2>T1,其中T2较T1高45.53%,T3较T2提高8.26%,自第2天取样开始,POD活性趋于平稳。方差分析结果表明,第1天取样,T3和T2极显著高于T1,但T3与T2之间差异不显著;第2天取样,T3极显著高于T1,显著高于T2;第3天取样,T3显著高于T1,但T3与T2之间差异不显著;第4天取样,T3极显著高于T1,与T2之间差异不显著;第5天取样,处理间POD活性无显著性差异。喷施外源ABA能够明显影响天津红POD活性,各不同取样时间POD活性均为T6>T5>T4。第1天取样,T5较T4高102.44%,T6较T5提高28.51%。方差分析结果表明:第1天到第4天取样,T6均极显著高于T4和T5,同时T5也极显著高于T4;第5天取样,T6极显著高于T4和T5,但T5和T4之间无显著性差异。
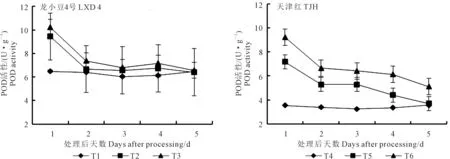
图4 外源ABA对低温胁迫下小豆幼苗叶片POD活性的影响
2.2.3 对叶片CAT活性的影响 由图5可知,幼苗期低温处理后,小豆叶片内CAT活性呈下降的变化趋势。经过方差分析可知龙小豆4号各取样时不同处理间的CAT活性没有显著性差异。天津红在不同取样时间均是T6处理CAT活性最高,方差分析结果表明,第1天取样,T6和T5均显著高于T4,但T6和T5之间差异不显著;第2天取样,T6极显著高于T4,但T6与T5之间差异不显著;第3天到第5天取样,各处理之间差异不显著。
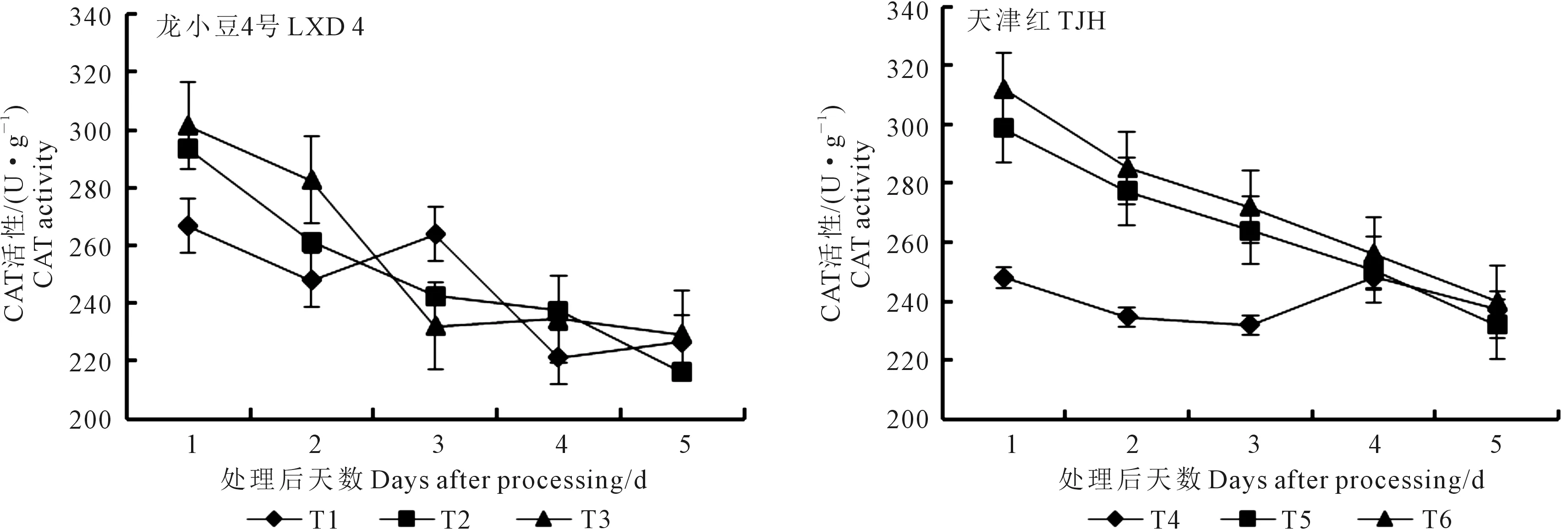
图5 外源ABA对低温胁迫下小豆幼苗叶片CAT活性的影响
2.3 外源ABA对低温胁迫下小豆幼苗叶片可溶性物质含量的影响
2.3.1 对叶片脯氨酸含量的影响 由图6可知,幼苗期低温处理后,小豆叶片内脯氨酸含量呈先升后降变化规律。第1天取样,T2较T1高33.12%,T3较T2提高9.13%;第3天取样,龙小豆4号脯氨酸含量T3最高,较T2和T1分别提高74.68%和36.00%,随后T3开始下降,第5天取样,与T1和T2趋平。对龙小豆4号各取样时间脯氨酸含量进行方差分析可知:第1天取样,T3极显著高于T1,但T3与T2之间差异不显著;第2天和第3天取样结果相同,均为T3极显著高于T1和T2,T2极显著高于T1;第4天取样,T3显著高于T1,但T3与T2之间差异不显著;第4天取样,T3极显著高于T1和T2;第5天取样,处理间脯氨酸含量无显著性差异。叶面喷施外源ABA对天津红叶片脯氨酸含量的调控效应更强,第1天取样,T5较T4高24.41%,T6较T5提高19.76%,第3天取样,天津红脯氨酸含量T6最高,较T4和T5分别提高54.72%和8.15%。方差分析可知取样第1天到第4天,T6均极显著高于T4,其中第1天和第4天,T6显著高于T5;第5天取样,处理间脯氨酸含量无显著性差异。
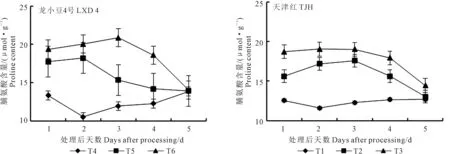
图6 外源ABA对低温胁迫下小豆幼苗叶片脯氨酸含量的影响
2.3.2 对叶片可溶性糖含量的影响 由图7可知,幼苗期低温处理后,不同品种小豆叶片可溶性糖含量变化趋势不同,龙小豆4号总体呈先升后降的变化趋势,而天津红的变化幅度不大。从整体来看,龙小豆4号的可溶性糖含量高于天津红,这也是其抗冷性强的又一生理因素。喷施外源ABA处理能明显提高可溶性糖含量,在所有取样时间内,T3均高于T1和T2,T6高于T4和T5。龙小豆4号第3天和第4天取样,各处理可溶性糖差异相对明显,方差分析结果表明T3均极显著高于T1,第3天取样T3极显著高于T2,其他取样时间内处理间无显著性差异。低温及喷施外源ABA对天津红的可溶性糖含量调控明显,第1天取样,T6极显著高于T4和T5,而T5极显著高于T4;第2天取样,T6和T5极显著高于T4,T6和T5之间没有显著性差异;第3天取样,T6和T5显著高于T4,但T6与T5之间差异不显著;第4天取样,T6极显著高于T4和T5,T5极显著高于T4;第5天取样,T6极显著高于T4和T5,T5显著高于T4。
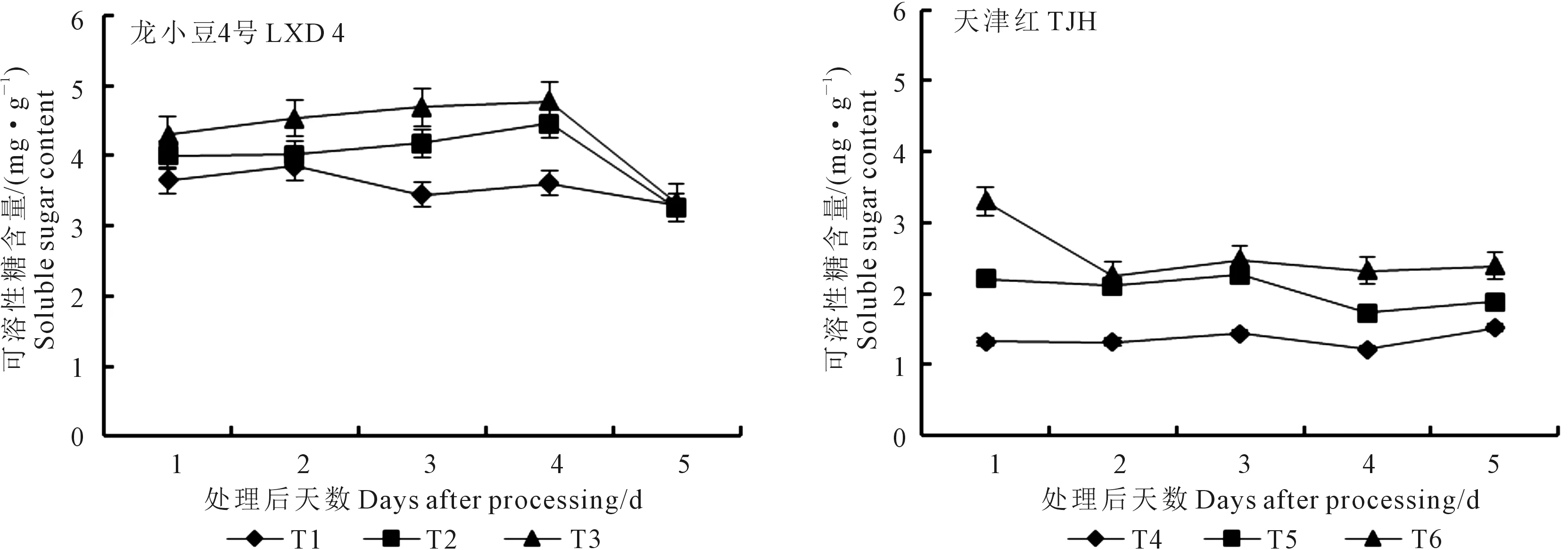
图7 外源ABA对低温胁迫下小豆幼苗叶片可溶性糖含量的影响
2.3.3 对叶片可溶性蛋白含量的影响 由图8可知,幼苗期低温处理后,小豆叶片可溶性蛋白质含量的变化没有明显的规律,但可以看出龙小豆4号高于天津红,这是品种间遗传差异所致。对龙小豆4号各取样时间的可溶性蛋白含量进行方差分析可知,第1天和第3天取样,处理间没有显著性差异;第2天取样,T3极显著高于T2;第4天取样,T3极显著高于T1,显著高于T2。此外,第5天取样时T3含量骤降,幅度比较异常,笔者认为这可能是取样的偶然误差所致。对天津红的可溶性蛋白含量进行方差分析,结果表明:第1天取样,T6极显著高于T4和T5,而T5极显著高于T4;第2天取样,T6和T4极显著高于T5,T6和T4之间没有显著性差异;第3天取样,处理间差异不显著;第4天取样,T6极显著高于T4,T5显著高于T4;第5天取样,T6和T5极显著高于T4,T6和T5之间差异不显著。
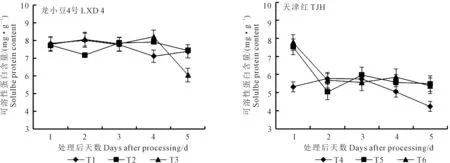
图8 外源ABA对低温胁迫下小豆幼苗叶片可溶性蛋白含量的影响
2.4 幼苗期低温胁迫下外源ABA对小豆产量的影响
由表2可知,幼苗期低温处理后,小豆产量因子发生变化。低温条件下,龙小豆4号的株荚数和荚粒数未发生显著性变化,但单株粒重和百粒重发生较大变化,与T1相比,T2的单株粒重和百粒重分别下降了0.73 g和0.45 g,下降幅度分别是为11.61%和2.58%,达到了显著差异水平。天津红的荚粒数和单株粒重未发生显著变化,T5的株荚数较T4下降了18.55%,差异达显著水平,T5的百粒重较T4下降了1.41 g,降幅为10.61%,差异达到显著水平。
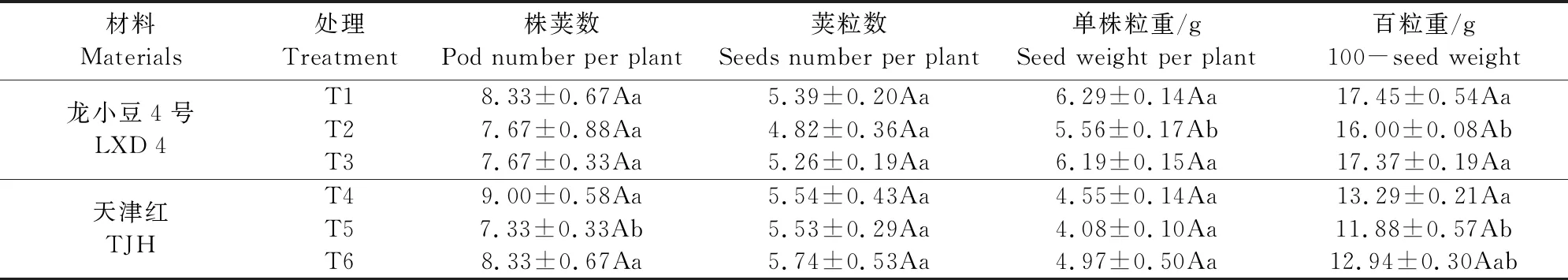
表2 外源ABA对低温胁迫下小豆产量因子的影响
低温条件下,喷施外源ABA可调节小豆产量因子,龙小豆4号的百粒重发生较大变化,与T2相比,T3的百粒重增加了1.37 g,增幅为8.56%,差异达到显著水平;喷施外源ABA使天津红的百粒重也有所提高,T6较T5增加了1.06 g,增幅为8.92%,但方差分析结果表明差异未达显著水平。
3 讨 论
低温对植物的形态结构发展、代谢途径、生长发育进程都具有较大影响,植物对低温胁迫的适应性和抵抗能力既受系统发育的遗传基因控制,又受个体发育过程中生理状态制约[14],植物遭受低温胁迫后,会开启一系列应激的自我防护机制,这些保护系统之间相互有机协调,以最大程度降低伤害。
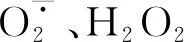
H2O2是植物体内一类重要的ROS物质,正常条件下H2O2的产生和清除过程基本保持一种精细的平衡状态,这样既保证了植物体内H2O2具有一定的生理功能,同时也将其对植物的伤害效应降到最低。如果打破H2O2产生和清除的这种平衡,出现H2O2的积累。由于它具有较高的氧化还原活性,所以能引起细胞内大分子氧化损伤,最终抑制植物体内多种生理生化反应,影响植物体内的调控和代谢[15]。MDA是细胞膜过氧化产物,其含量高低是质膜受损严重与否的重要指标[16],胁迫程度越强,MDA积累量越多。低温可导致植物体内H2O2和MDA含量增加,增加质膜透性,对细胞膜造成损伤。夏军等[17]研究得出不同低温胁迫均导致棉花种子内H2O2和MDA含量增加;张腾国等[18]也认为油菜受到低温胁迫后体内H2O2含量迅速增加。外源ABA具有减缓逆境条件下ROS类物质和MDA含量增加的生理功能。蒲高斌等[11]认为低温胁迫下外源ABA能有效降低西瓜体内MDA的积累,维持膜的完整性,增强植株的抗寒能力;阮英慧等[19]研究得出外源ABA能够显著降低干旱胁迫下作物体内ROS类物质的积累,并可显著提高抗坏血酸含量以清除H2O2,缓解低温胁迫。这可能与外源ABA具有提高保护酶活性的生理功能有关,因为当植物处于逆境时,细胞内自由基产生和清除的平衡系统受到破坏,植物体内存在清除自由基的多种途径,其中最主要的就是抗氧化酶系统,植物通过SOD、POD和CAT三者协同作用,使体内的氧自由基维持在较低水平,可以在一定程度上减缓或防御低温胁迫[20]。Zhang等[21]也得出ABA通过调控抗氧化酶活性,有效缓解冷害条件下黄瓜幼苗的氧化受损程度;黄凤莲等[22]得出ABA能够缓解低温胁迫下水稻幼苗SOD、POD的活性变化,这都与本文研究结果类似。低温处理后,植物自身保护机制开启,SOD和POD活性明显提高,以应对不良环境带来的胁迫,外源ABA能够进一步提高小豆叶片内的SOD和POD活性,增强对ROS的清除能力,保护细胞尽量不受伤害。但是本试验结果表明,不同小豆品种之间CAT活性变化不同,低温胁迫和外源ABA对龙小豆4号的CAT活性均没有显著影响,这可能与其遗传特性相关,其自身具有较高的可溶性物质,能够稳定渗透调节功能。
植物为了减缓由逆境胁迫造成的生理代谢不平衡,会大量积累一些小分子有机化合物,通过渗透调节来降低水势,以维持较高的渗透压,保证细胞的正常生理功能[23]。低温胁迫下可溶性糖和可溶性蛋白在植物体内会大量积累,可溶性糖通过某些糖代谢途径形成保护性物质,提高植物抵抗低温的能力[24]。脯氨酸通过参与细胞内的渗透调节起到了防冻剂或膜稳定剂的作用,对细胞起到保护作用。Xiang等[10]研究表明低温条件下外源ABA能提高水稻叶片内脯氨酸、可溶性糖和可溶性蛋白含量,增强水稻的抗冷性。蒲高斌等[11]得出低温胁迫下外源ABA能促进渗透保护物质脯氨酸和可溶性糖的增加,增强植株的抗寒性,表明这是外源ABA有效提高西瓜幼苗抗冷性、减轻低温对西瓜苗伤害的主要生理基础。本研究结果表明外源ABA能够有效提高小豆叶片可溶性糖的含量,对可溶性蛋白的影响较为微弱,但是对脯氨酸含量具有显著的提高作用,这可能与外源ABA提高了△-二氢吡咯-5-羧酸合成酶(P5C synthetase,P5CS)的合成有关。P5CS基因在胁迫条件下对植物中脯氨酸合成水平起着重要作用,转基因P5CS的烟草中产生了大量的P5CS酶蛋白,脯氨酸合成量比正常植株升高10倍。积累的脯氨酸通过参加细胞内的渗透调节,起到了防冻剂或膜稳定剂的作用,对细胞起到保护作用,进而提高了小豆的抗冷性。
相关报道表明外源ABA能够显著提高逆境胁迫下作物产量因子,促使作物产量有效提高。屈春媛等[25]研究得出,干旱胁迫下外源ABA显著提高了大豆单株粒数、百粒重以及产量;谢静静等[26]也认为外源ABA有效提高了干旱胁迫后小麦的穗粒数、千粒重和产量。本研究结果表明,低温导致小豆百粒重显著降低,并显著降低了天津红品种的单株荚数,进而对产量造成影响;相较于喷施清水,喷施外源ABA能够显著提高低温胁迫后小豆的百粒重,有效缓解低温对产量的影响。
4 结 论
幼苗期低温导致小豆叶片生理指标发生变化,低温引起龙小豆4号和天津红叶片内H2O2含量增加34.82%和27.10%(P<0.05)、引起MDA含量增加65.56%和83.79%(P<0.05),同时促进SOD和POD活性提高,两品种分别提高6.67%和18.48%、45.53%和102.44%。脯氨酸含量也明显增加,分别为33.12%和24.41%。通过保护酶活性和渗透调节物质的量变协同抵抗H2O2和MDA对细胞带来的伤害。外源ABA具有抵御低温、降低作物受损的作用,其能有效增强小豆叶片SOD和POD的活性,龙小豆4号和天津红分别提高9.06%和13.57%、8.26%和28.51%;外源ABA能增加脯氨酸含量,两品种分别增加9.13%和19.76%,同时可降低H2O2和MDA含量,龙小豆4号和天津红分别降低7.63%和8.36%、10.18%和20.27%。外源ABA能提高小豆对低温胁迫的抗性,维持正常生理活动。
幼苗期低温导致产量因子发生变化,低温导致小豆百粒重显著降低,龙小豆4号和天津红分别降低2.58%和10.61%,对产量造成影响。低温胁迫后,与喷施清水相比较,外源ABA能够提高小豆的百粒重,龙小豆4号和天津红分别提高8.56%和8.92%,有效缓解低温对产量的影响。本试验得出外源ABA能够缓解低温对小豆造成的伤害,对低温条件下小豆保产稳产起到实际作用,为进一步研究小豆幼苗抵御低温伤害提供理论基础。

