耐旱根瘤菌对干旱胁迫下拉巴豆植株生长的影响
张淑卿,臧丹丹,李剑峰,郭金梅
(1.贵州师范学院地理与资源学院, 贵州 贵阳 550018;2.贵州师范学院喀斯特生境土壤与环境生物修复研究所, 贵州 贵阳 550018)
我国西南岩溶片区石漠化分布广、程度深,是生态治理的重点和难点地区[1-2]。贵州岩溶石漠化地区生态系统常以石生和旱生为主[3]。土壤干旱缺水会影响植株根毛的生长从而降低根瘤菌对其侵染的机会,还会使根瘤菌的生长受到限制,难以与豆科植物共生结瘤。拉巴豆(DolichoslablabL.)为豆科蝶形花亚科菜豆族扁豆属,根深抗旱,可以适应典型的石灰性和酸性黄壤条件,在裸露于石漠表面的风化石砾中也能较好生长[4]。拉巴豆品质优良,具有多种经济价值,可以代替控制紫茎泽兰并且其种植当年盖度可达到93%[5],具有良好的品质和较强的适应性和抗逆性,目前已经作为优质豆科牧草在重庆、广西等地区进行广泛种植[4,6-8]。筛选并利用促生能力及抗旱能力较强的拉巴豆根瘤菌株可提高干旱条件下豆科植物结瘤固氮的能力,对石漠干旱地区土壤养分恢复具有重要意义。杨培志等[9]发现接种根瘤菌可有效提高紫花苜蓿的耐旱能力。张慧敏等[10]发现根瘤菌与紫花苜蓿的共生固氮体系可提高紫花苜蓿生物量、根和叶中酶的活性以及营养物质含量,并可增强紫花苜蓿耐寒、耐旱能力。张攀等[11]发现干旱胁迫下接种根瘤菌能显著提高苜蓿植株的渗透调节能力及活性氧防御能力。段如雁等[12]发现接种根瘤菌可显著降低中度干旱胁迫对花榈木幼苗叶片质膜相对透性的影响,同时提高脯氨酸和可溶性糖平均含量以及SOD活性。沙桦欣等[13]发现在干旱胁迫条件下接种根瘤菌可显著提高台湾相思(AcaciaconfusaMerr.)幼苗的耐旱能力。韩玉竹[4]研究发现接种根瘤菌能提高拉巴豆叶片硝酸还原酶活性、叶绿素含量和根系活力,可改善拉巴豆氮、磷营养,提高净光合速率,促进生物量的积累。目前,国内外对于耐旱豆科植物的研究主要集中于紫花苜蓿、大豆等方面,而关于同属豆科的拉巴豆及其根瘤菌的耐旱性研究尚且鲜见。
本研究以聚乙二醇(PEG 6000)模拟干旱胁迫筛选出耐旱能力较强的拉巴豆根瘤菌作为供试菌株,采用试验室盆栽拉巴豆的方法进行控制水分胁迫试验,比较拉巴豆植株生物量、最大光化学量子产量(Fv/Fm)、叶片中可溶性蛋白含量及丙二醛含量,筛选出干旱条件下促生能力强的优良拉巴豆根瘤菌耐旱菌株,为石漠干旱生境拉巴豆植株专用根瘤菌菌剂的研发提供菌种材料。
1 材料与方法
1.1 供试材料
供试拉巴豆种子:润高拉巴豆(DolichoslablabL. Rongai)于2017年3月购自荷兰百绿集团(Barenbrug),产地为澳大利亚,种子净度97%,发芽率80.5%。
供试菌株及其来源:采集栽培于重度石漠退化生境中生长的拉巴豆植株,取新鲜饱满的粉色根瘤0.5 g,参照苗阳阳等[14]的方法以有效碘含量为0.45%~0.55%的碘伏溶液浸泡3 min进行表面灭菌,无菌水清洗4~6次,直至清洗液无色无泡沫为止。加5 mL无菌水在超净工作台内以无菌研钵研磨,取研磨液1 mL以无菌水稀释1000倍。取稀释菌液0.2 mL在含35%聚乙二醇(PEG 6000)[15]的YMA固体平板上均匀涂抹,共涂抹5份平板后置于生化培养箱内28℃无光照培养,2 d后在各平板上选取菌落形态与根瘤菌一致、且单菌落直径最高的10株菌为待选菌株,将待选菌株划线纯化5~6次后,培养斜面送至保定迈禾斯生物科技有限公司进行菌株16SrDNA测序鉴定。经鉴定,有3株菌为放射型根瘤菌,将其命名为RhizobiumradiobacterY-1(Y-1)、Rhizobiumradiobacter4-4(4-4)、Rhizobiumradiobacter37-1(37-1),作为本试验的供试菌株。
培养基:根瘤菌的液体培养使用YEM培养基,含K2HPO4·3H2O 0.5 g·L-1,MgSO4·7H2O 0.2 g·L-1,NaCl 0.1 g·L-1,甘露醇10 g·L-1,酵母粉1 g·L-1。
利用YMA固体培养基进行菌种的保存、活化及培养,以YEM培养基添加15 g· L-1的琼脂配制。以上培养基以1 mol·L-1的NaOH溶液或1 mol·L-1HCl溶液调节培养基pH值为7.0±0.1。培养基121℃湿热灭菌26 min。
1.2 试验设计及方法
1.2.1 拉巴豆耐旱根瘤菌菌液的制备 将4℃保存的拉巴豆耐旱根瘤菌R.radiobacterY-1(Y-1)、R.radiobacter4-4(4-4)、R.radiobacter37-1(37-1)活化后接入100 mL YEM液体培养基中,在28℃、120 r·min-1条件下振荡培养2~3 d,用液体YEM培养基调至OD600nm为统一值,使菌体浓度为1×109CFU·mL-1[15],转移至50 mL无菌离心管中,8 000 r·min-1离心10 min,弃去上清液,在沉淀中加入等量无菌水,充分打散后制成菌悬液待用[14]。
1.2.2 拉巴豆幼苗的培养及接种 取健康饱满的润高拉巴豆种子,置于50 mL无菌三角瓶中,用有效碘含量为5%的碘伏浸泡5 min,无菌水冲洗6次。冲洗液涂布于YMA固体培养基中以检测种子表面灭菌是否彻底,表面灭菌种子放入铺有双层无菌滤纸的无菌培养皿中,加入适量无菌水,置于28℃条件下培养。以上操作在超净工作台内进行。
试验以石英砂混合石漠岩屑模拟重度石漠退化生境进行盆栽,采用0.5~1 mm粒径的石英砂和采集自贵州省乌当区东风镇重度化山地裸岩间隙、直径在3~5 mm的岩屑碎石。将岩屑及石英砂分别以121℃高压灭菌3 h后,烘箱105℃烘干5 h。冷却后装入经75%乙醇表面擦拭消毒、高度为20 cm的塑料盆内。盆底部装岩屑400 g,上覆石英砂200 g。挑取胚根长约2 mm左右的发芽种子,每盆播种3粒种子于砂表后再覆石英砂100 g。经实际测定该盆栽土壤田间持水量(θf)为20.28%,通过每天称重盆栽并定量补充无菌水来控制相对含水量到相应胁迫强度,设置以下4个基质水分梯度处理[16-17]:(1)正常水分,75%θf;(2)轻度干旱胁迫,60%θf;(3)中度干旱胁迫,45%θf;重度干旱胁迫,30%θf。
待幼苗长出第一片真叶时进行菌液接种。定苗3株·盆-1,将制备好的根瘤菌菌悬液直接浇灌接种于盆栽中心,2 mL·盆-1,以不接种为对照(CK),3株供试菌株在各水分梯度处理下设3次重复。每天傍晚采用整体称量法[18]控制基质含水量,根据基质水分状况及处理要求及时补充水分,使各处理基质维持设定的相对含水量。30 d后收获幼苗。收获时,将拉巴豆幼苗和基质从盆中整体取出,用水冲洗整株,在水中将拉巴豆幼苗根系分开,尽量保持根的完整性,用滤纸吸干植株表面水分。
1.3 测定指标
1.3.1 株高的测定 在播种后第30天对控制基质水分处理拉巴豆植株株高进行测定。
1.3.2 叶面积测定 参照宋英博等[19]、于守超等[20]植物叶面积测定的方法,利用打印机扫描第二片真叶和参照物(1 cm2或4 cm2黑色硬纸片),用Photoshop 7.0测定参照物和第二片真叶的像素点。用Excel 2003计算出第二片真叶的叶面积。
1.3.3 叶片PSⅡ的最大光化学量子产量的测定 用MINI-PAM-II型便携式调制荧光分析仪定期对拉巴豆叶片进行叶绿素荧光动力学参数测定。测定前将植株暗适应15~30 min,测定F0(初始荧光)、Fm(最大荧光)。通过计算获得Fv=Fm-F0及PSⅡ(光系统Ⅱ)最大光化学量子产量(Fv/Fm)。
1.3.4 可溶性蛋白含量的测定 参照Bradford法[21],配置考马斯亮蓝G-250溶液:称0.2 g考马斯亮蓝G-250溶于100 mL 95%乙醇中,加入85%磷酸200 mL,用蒸馏水将其定容至2 000 mL,保存备用。取1 mL蛋白标液加入5 mL考马斯亮蓝G-250混匀,室温下放置10 min后在595 nm下比色。以牛血清蛋白作为标准蛋白,配置1 000 μg·mL-1牛血清蛋白溶液建立标准曲线(图1)。
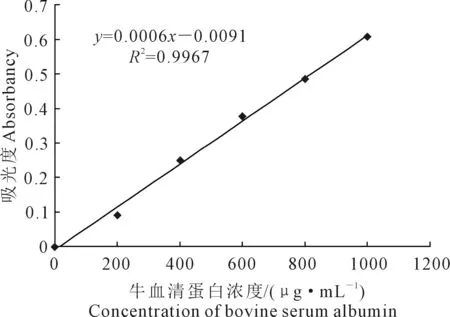
图1 可溶性蛋白标线
称取植物新鲜叶片0.2 g放入研钵中加4 mL蒸馏水研磨充分后转移至5 mL离心管中,8 000 r·min-1离心10 min;取0.1 mL溶液于试管中,加入5 mL考马斯亮蓝G-250混匀,室温下放置10 min后在595 nm下比色(每个样品3次重复)。
1.3.5 丙二醛含量测定 参照硫代巴比妥酸法[22]测定出苗30 d后拉巴豆叶片的丙二醛(MDA)含量。称取0.3 g新鲜叶片,加10%的三氯乙酸(TCA)研磨提取过滤,取上清液再加0.6% 的硫代巴比妥酸(TBA),沸水浴后在波长532 nm、600 nm及450 nm下测定吸光度值。通过公式计算叶片中MDA含量。
Cm=6.45(A532﹣A600)-0.56A450
式中,Cm为MDA的浓度(μmol·L-1);A450、A532、A600分别代表450 nm、532 nm和600 nm波长下的吸光度值。
MDA含量(μmol·g-1)=Cm×提取液体积(mL)/植物组织鲜重(g)
1.3.6 可溶性糖含量测定 参照蒽酮比色法[23]测定可溶性糖含量。
1.4 数据处理
采用SPSS 19.0进行数据统计和分析,Excel 2003进行数据整理及作图。采用Duncan法进行各处理的多重比较。
2 结果与分析
2.1 干旱胁迫下接种耐旱根瘤菌对拉巴豆植株生长量的影响
植物处于干旱胁迫时生长往往受到抑制[24]。正常水分条件下,接种耐旱根瘤菌菌液后拉巴豆幼苗生长量均高于对照组,有显著的促进生长作用。随着干旱胁迫程度的增加,各菌液处理下拉巴豆幼苗植株地上、地下生长量表现不同(见表1、表2)。由表1可见,在不同程度干旱处理下接种Y-1菌液能显著促进株高及叶片的生长,分别高出对照28.69%~56.34%,58.12%~73.17%(P<0.05);在中度及重度干旱胁迫下,37-1菌液处理的幼苗株高和叶面积分别高出对照76.17%~118.58%,77.16%~100.51%,差异显著(P<0.05),且促进作用大于Y-1菌液处理。

表1 干旱胁迫下耐旱根瘤菌对拉巴豆株高和叶面积的影响
由表2可见,接种拉巴豆耐旱根瘤菌菌液可促进拉巴豆幼苗地下部分生长。轻度干旱胁迫时,植株产生的应激反应促进了根系的生长,根长长于正常水分处理。随着干旱程度的增加,植株地下生物量逐渐减小。但在同一干旱胁迫条件下,接种Y-1及37-1菌液处理,拉巴豆幼苗的根长、根鲜重、根体积均显著高于对照(P<0.05)。由此可见,耐旱根瘤菌Y-1及37-1可显著促进干旱胁迫条件下拉巴豆植株的生长。
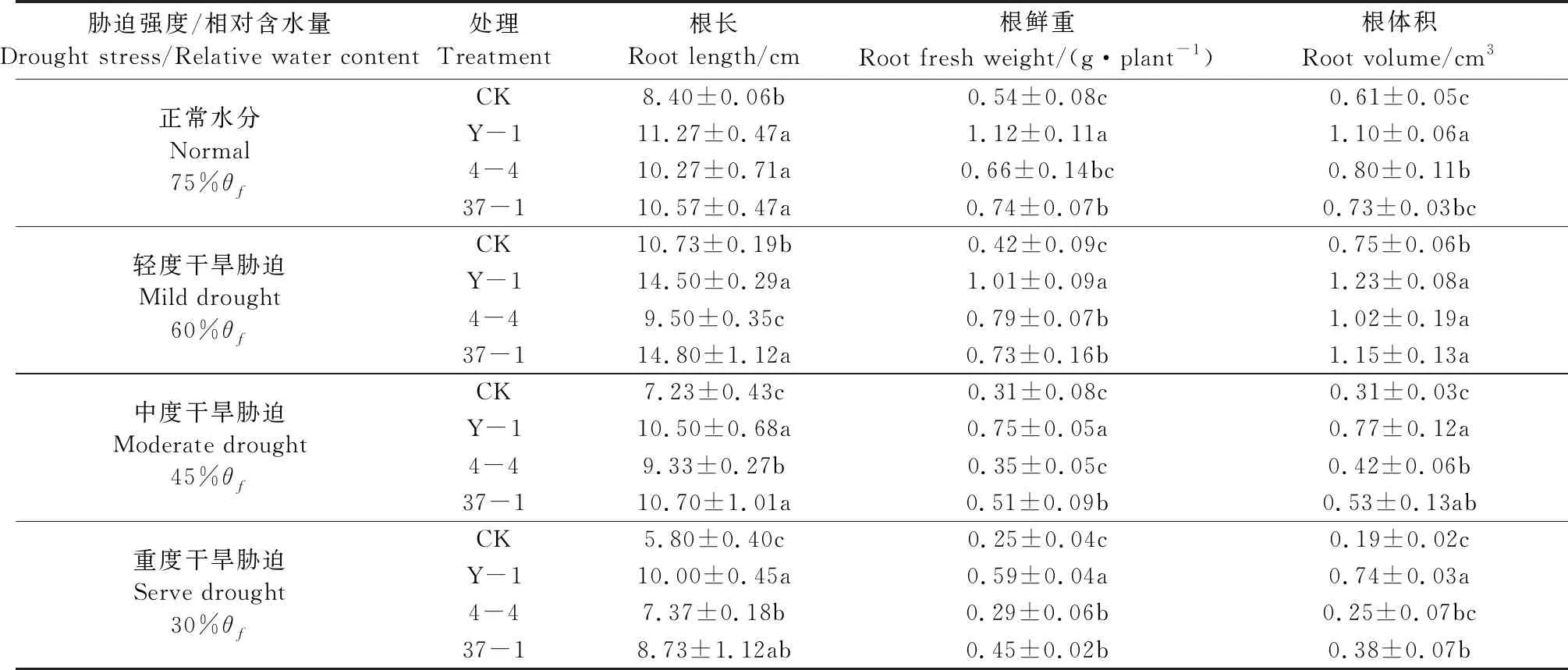
表2 干旱胁迫下耐旱根瘤菌对拉巴豆植株地下生长量的影响
2.2 干旱胁迫下接种耐旱根瘤菌对拉巴豆光合效能的影响
如表3所示,拉巴豆叶片的光能转化效率随着处理时间及干旱胁迫程度的增加而降低,接种耐旱根瘤菌则有助于延缓这一趋势。处理30 d时,轻度至重度胁迫下Y-1菌液处理叶片Fv/Fm高出对照20.65%~42.09%(P<0.05);4-4菌液处理的Fv/Fm值在重度干旱胁迫下高于对照19.03%(P<0.05);37-1菌液处理的Fv/Fm值在轻度和重度干旱胁迫下显著高于对照;不论各处理与对照之间是否存在差异,其平均值均高于对照,说明接种拉巴豆耐旱根瘤菌能提高干旱条件下叶片的光合作用效率,其中菌株Y-1和37-1的表现效果更为明显。

表3 干旱胁迫下耐旱根瘤菌对拉巴豆叶片光能转换效率的影响
2.3 干旱胁迫下接种耐旱根瘤菌对拉巴豆植株叶片丙二醛含量、可溶性糖及可溶性蛋白的影响
丙二醛(MDA)是植物在受到伤害时,细胞膜发生膜脂过氧化作用而形成的最终分解产物,MDA 含量反映着植物细胞遭受逆境伤害的程度[25-26]。由图2可知,拉巴豆叶片中MDA含量随着干旱胁迫程度的不断增加逐渐升高。随着干旱程度的加重,接种Y-1菌液的幼苗叶片中MDA含量与对照组相比分别减少4.50%、-2.48%、16.65%、3.68%,接种37-1菌株的幼苗叶片MDA含量与对照组相比分别减少5.84%、43.75%、30.27%、6.70%,接种4-4菌液的幼苗叶片MDA含量与对照组相比分别增加4.48%、20.4%、-12.17%、7.99%,各处理均与对照组间存在显著差异(P<0.05)。接种37-1菌液在各处理下均能缓解干旱胁迫的影响;接种Y-1菌液的拉巴豆幼苗除在轻度干旱时MDA含量高于对照外,中度、重度干旱胁迫处理均达到缓解干旱胁迫效果;接种4-4菌液处理只有在中度干旱时叶片MDA含量低于对照。由此可见,拉巴豆耐旱根瘤菌Y-1和37-1可缓解干旱对植株的伤害。
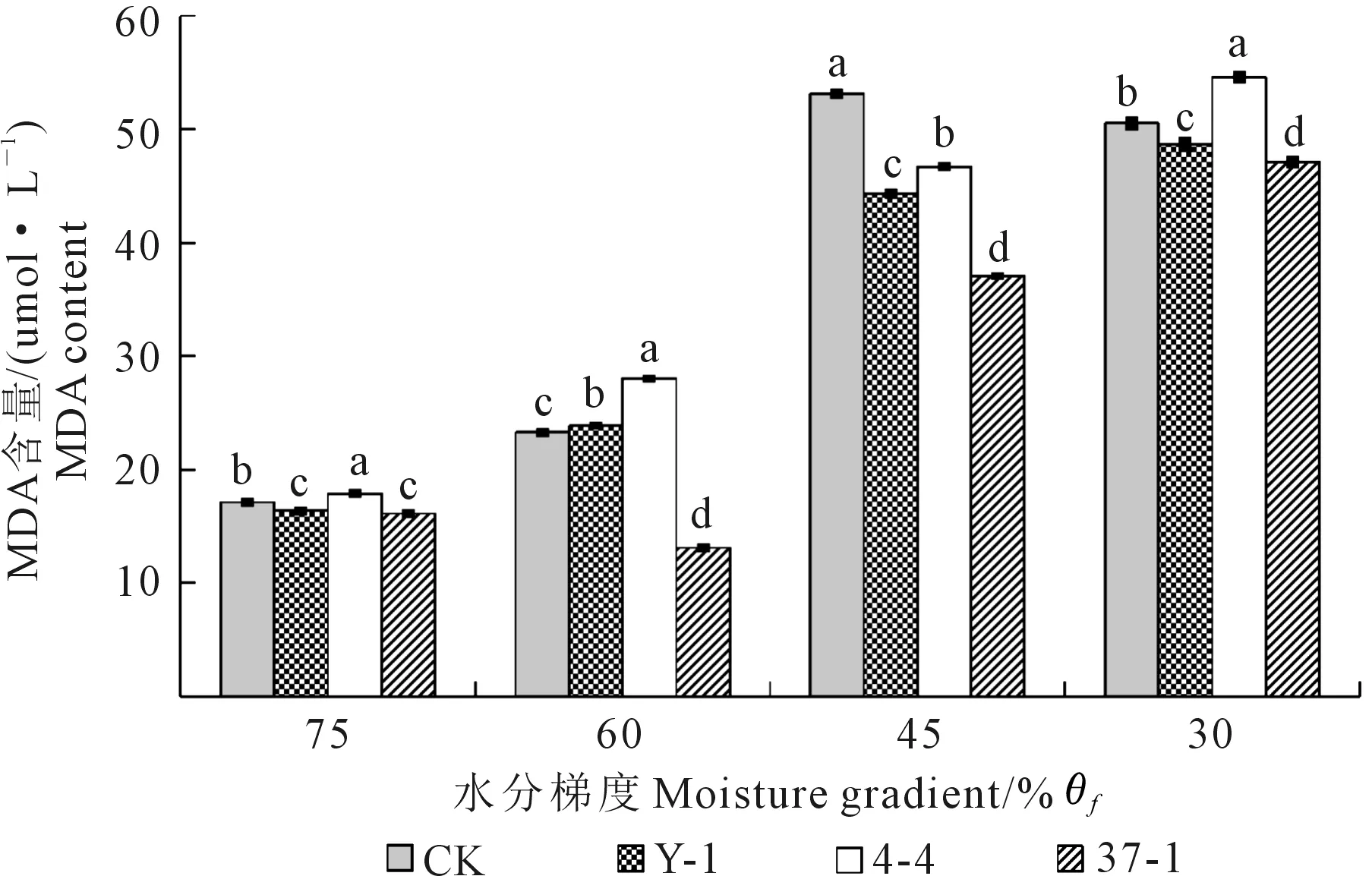
注:不同小写字母表示相同水分梯度下不同菌株处理间差异显著(P<0.05),下同。Note:The different lowercase letters means significant difference at P<0.05. The same below.
可溶性糖是植物体内重要的渗透调节物质。由图3可见,菌液处理下的拉巴豆叶片可溶性糖含量随着干旱胁迫程度的增加不断升高,这与干旱胁迫下拉巴豆叶片丙二醛含量变化趋势一致。重度干旱胁迫下,4-4及Y-1菌液处理的幼苗叶片可溶性糖含量分别比对照组高出8.1%、3.53%,差异显著(P<0.05)。

图3 干旱胁迫下拉巴豆叶片可溶性糖含量的变化
植物体内可溶性蛋白含量的增加可提高细胞的保水能力[27]。如图4所示,随着干旱胁迫程度的增加,植株叶片可溶性蛋白的含量普遍呈先增后减的趋势。在正常水分和轻度干旱胁迫时,37-1菌液处理下的幼苗叶片可溶性蛋白含量最高,比对照组高出70.32%、144.14%,差异显著(P<0.05)。在中度和重度干旱胁迫时,Y-1菌液处理的幼苗叶片可溶性蛋白含量最高,比对照组高出27.43%、108.57%,差异显著(P<0.05),且在干旱胁迫程度最大时达到最大值,高出其它处理56.26%~176.85%,差异显著(P<0.05);其次为37-1,其幼苗叶片可溶性蛋白含量比对照组提高11.14%、33.47%。接种4-4菌液的处理在3个干旱处理中,幼苗叶片中可溶性蛋白含量均低于对照组。由此可见,当拉巴豆幼苗遭到干旱胁迫时,耐旱根瘤菌株37-1有助于植株抵抗轻度干旱,Y-1有助于其抵抗中度甚至重度干旱。

图4 干旱胁迫下拉巴豆叶片可溶性蛋白含量的变化
3 讨论与结论
干旱胁迫是一种非生物胁迫,可抑制作物的生长并降低作物产量[11]。干旱条件下,植物首先会脱水,其次其生理生化过程受到影响,但在整个干旱胁迫过程中,植物能逐渐适应逆境环境并在生理和代谢方面产生积极的响应[28]。根瘤菌可与豆科作物共生固氮提高作物产量,根瘤菌还能与豆科作物协同抗逆[29-30]。有研究表明,接种根瘤菌能有效减少膜脂过氧化物MDA含量的积累,显著提高花榈木幼苗的抗旱能力[12],且接种根瘤菌后花榈木幼苗 PSⅡ反应中心内的光能转化效率和 PSⅡ的潜在活性提高,对干旱胁迫有较强的调节适应能力[12]。张攀等[11]研究发现,接种根瘤菌能降低紫花苜蓿根、茎、叶中MDA含量,提高根、茎、叶中可溶性糖含量。本研究中,拉巴豆幼苗植株的生长量随着干旱程度的增加均有不同程度下降,但在同一干旱胁迫条件下,接种Y-1和37-1菌株能显著促进植株生长,株高、根长、根鲜重、根体积均显著高于对照(P<0.05),说明耐旱根瘤菌对拉巴豆植株在干旱胁迫下的生物量积累有一定的促进作用。干旱胁迫15 d时,各菌液接种处理与对照相比,叶片光能转化效率无显著差异,但随着胁迫时间的增加,同一胁迫程度下Y-1和37-1菌液处理的植株叶片光能转化效率均显著高于对照(P<0.05),且随着干旱程度的增加,叶片的光能转化效率也会逐渐增加,说明植株及根瘤菌对干旱胁迫都有一定的适应过程,完全适应逆境条件后,根瘤菌会促进植株叶片对有机物的积累。这与段如雁等[12]的研究结果一致,即根瘤菌对干旱胁迫有一定的调节适应能力,接种根瘤菌会提高植物的光能转化效率。
植物体内可溶性糖、可溶性蛋白能降低细胞渗透势,保护细胞膜结构,在干旱胁迫下能提高植物抗逆能力,是评价植物抗旱性的重要生化指标[27]。本研究中,随着干旱胁迫程度的增加,37-1和4-4菌液处理下植株叶片可溶性蛋白含量呈先增后减的趋势,而Y-1菌液处理下幼苗叶片可溶性蛋白的含量随着干旱胁迫程度增加而增大,在重度干旱胁迫下达到最大值,说明在干旱胁迫条件下,Y-1菌株处理可使拉巴豆植株的抗逆能力增强。双因素方差分析发现:干旱胁迫与根瘤菌的交互作用对叶片可溶性糖及可溶性蛋白含量均有极显著的影响(P<0.001)。
植物的耐旱能力还随丙二醛含量的降低而增加[12]。本研究中,随着干旱胁迫程度的增加,拉巴豆叶片中MDA含量升高,但在同一干旱胁迫尤其是在中度和重度干旱胁迫条件下,Y-1和37-1菌液处理的拉巴豆幼苗叶片MDA含量均显著低于对照(P<0.05),说明这两株根瘤菌菌株能通过有效抑制幼苗的脂膜过氧化作用而降低这一作用的最终产物对幼苗的毒害,这与段如雁等[12]和霍平慧[31]的研究结果一致。而洪文君等[32]的研究表明当土壤水分达到重度干旱胁迫时,接种丛枝菌根处理组的土沉香幼苗MDA含量显著高于CK组,这可能是因为接种丛枝菌根可增大植株根系的表面积,使植株根系增加吸水通道,因此在中度干旱胁迫下MDA含量低于对照,但在重度干旱条件下,根系吸水通道的增加意味着根系会快速散失水分,故MDA含量增加。而本研究涉及的菌株为耐旱根瘤菌菌株,不会增加根系吸水通道,故在重度干旱胁迫下仍能使植株保持较好的抗逆能力。双因素方差分析也得出,干旱胁迫与根瘤菌的交互作用对叶片MDA存在极显著影响(P<0.001)。
研究表明,在逆境条件下分离到的根瘤菌菌株本身就具有较强的抗逆性,接种这种分离自逆境的根瘤菌菌株可提高植物本身的抗逆能力[12-13]。本研究的3株供试菌株来自于经35%聚乙二醇(PEG 6000)的筛选,菌株本身就有较好的耐旱性,故在干旱胁迫下能显著提高植株的耐旱能力,但4-4菌株在该方面的能力明显弱于Y-1和37-1菌株。
因此,接种耐旱根瘤菌Y-1和37-1的菌液,可促进拉巴豆植株株高、叶片、根系的生长,可增加根系鲜重、体积,增加叶片光能转化效率及可溶性蛋白含量,降低叶片MDA含量,在促进拉巴豆幼苗生长的同时能减缓干旱胁迫对幼苗的危害程度,是耐旱性能较好的菌株。

