接种根瘤菌对高效固氮植物合欢实生苗耐镉性的影响
曾电源,张 芳,上官凌飞 ,周玉明,王永江,王彦杰,徐迎春*
(1.浙江伟达园林工程有限公司,浙江 杭州310051;2.南京农业大学园艺学院/农业农村部景观农业重点实验室,江苏 南京210095;3.安徽芜湖东源新农村开发股份有限公司博士后工作站,安徽 南陵241300)
目前土壤重金属污染在世界范围内十分普遍。镉(Cd)因移动性大、毒性强、污染面积大被称为“五毒(Cd、Hg、Pb、Cr、As)”之首[1]。因此,亟待对镉污染的土壤进行修复。人工修复方法有物理修复、化学修复和生物修复。其中生物修复(包括植物和微生物)具有成本低、对环境影响小、最大限度降低污染物浓度、便于操作等优点。但实践证明,单纯植物或者微生物修复均存在一些不足之处。而近年来兴起的微生物-植物联合修复技术则是利用微生物-植物的共生关系,提高重金属污染土壤的修复效率,展现出良好的应用前景,尤其是根瘤菌-豆科植物共生体系在重金属污染土壤修复中占据了重要地位[2]。
在重金属污染地,重金属毒性和氮素不足是植物生长主要限制因子。根瘤菌-豆科植物共生体系是已知固氮能力最强的生物固氮体系之一,把豆科植物作为重金属污染地的先锋植物,利用根瘤菌-豆科植物共生体的固氮作用来加速污染地氮素积累,进而促进污染地的营养元素循环、积累和重金属污染地植被恢复[3];根瘤菌在促进植物生长的同时,还可通过长期的进化,有效适应环境的改变和有害物质的存在,表现出抗重金属的能力。目前,已筛选出多种重金属抗性根瘤菌[4]。同时根瘤菌还可刺激其他降解菌的生存和行动能力,从而降低污染物的浓度[5]。因此,利用根瘤菌-高效固氮植物进行重金属污染土壤的改良是一个全新的思路,具有重要的现实意义。
园林植物不进入人的食物链,不存在食用安全的问题。因此,选择具有经济价值的豆科园林植物,利用其根瘤菌-植物共生体系,用于土壤重金属污染治理,还可获得较大的经济效益,具有广阔的发展前景。但目前关于高效固氮园林植物与根瘤菌共生对Cd 耐性的研究较少,限制了其在生态修复上的应用。
豆科乔木植物合欢(Albizia julibrissin Durazz)与根瘤菌共生,具有较强的固氮作用。合欢具有较大的经济价值、观赏价值和生态价值。在园林上适宜用作庭荫树、行道树;其树皮有安神解郁、活血止痛、驱虫等功效;花可解郁宁心、开胃利气;其嫩叶富含维生素C,为佐餐之佳品;其木材可作家具、建筑等[6]。
Sm1021 根瘤菌(Sinorhizobium meliloti 中华根瘤菌1021)是目前普遍使用的一类内生根瘤菌,可用于豆科植物和非豆科植物的接种,已被证明具有提高植物抗逆性的作用。但其能否提高合欢对Cd的耐性尚缺乏研究。
为此,本研究以合欢实生苗为试材,设置接种Sm1021 根瘤菌与不接种组,并进行不同浓度CdCl2处理,通过研究其对合欢幼苗生长发育和生理生化特性的影响,以验证根瘤菌能否提高合欢对Cd 的耐性,以及根瘤菌缓解Cd 毒害的作用范围,为外源接种根瘤菌提高合欢对镉污染土壤的修复能力提供科学依据。
1 材料与方法
1.1 材料
将合欢种子首先用0.1%高锰酸钾液浸泡2 h进行消毒,然后用100℃的开水进行烫种,不断搅拌5 min,再加入适量冷水,使水温达到40℃,浸泡一昼夜捞出,放入培养箱中黑暗条件下催芽,温度白天30℃(8 h),夜晚20℃(16 h)。每天翻动1~2 次,适量加水,保持原有湿度。合欢种子催芽后播入50 孔的穴盘内(穴孔直径6 cm,深12 cm),基质采用泥炭:珍珠岩=3:1。
GFP 荧光蛋白标记的Sm1021 根瘤菌菌液由中国科学院植物研究所沈世华研究员赠送,为内生菌类型。
1.2 试验处理
1.2.1 Sm1021 根瘤菌的培养与接种
①Sm1021 根瘤菌的培养方法(参照中国科学院植物所沈世华实验室的方法)
培养液的成分:磷酸缓冲液(PBS)(NaCl 8 g、KCl 0.2 g、NaH2PO41.44 g、KH2PO40.24 g,调pH 至7.4,高压灭菌);四环素(Tc)(取100 mg,溶于10 mL无菌水中,过滤灭菌,用1.5 mL 离心管装1 mL,4℃保存);链霉素(Str)(取500 mg,溶于10 mL 无菌水中,过滤灭菌,用1.5 mL 离心管装1 mL,4℃保存);TY 培养基(1L)(蛋白胨5.0 g,酵母提取物3.0 g,CaCl2·2H2O 0.88 g,pH=7.4,高压灭菌)。
培养方法:取100 mL 液体TY 培养基装入300 mL三角瓶中,再分别加入下列贮备物:Sm1021-20℃保存的菌液100 μL;Tc(10 mg·mL-1)100 μL;Str(50 mg·mL-1)100 μL.置于28℃摇床、转速为180×g,黑暗条件培养48 h,至OD600=0.8 时止。
菌体收集与洗涤:将培养菌液转入100 mL 离心管,在室温条件、4000×g 离心5 min,去上清;用PBS 重悬菌体,同样条件离心,去上清;重复洗涤2次,再用无菌水将菌体稀释至108 cell·mL-1备用。
②接种根瘤菌
每株幼苗接种1 mL Sm1021 根瘤菌活菌菌液,用移液器小心注入到幼苗根际约1 cm 深土壤表面。
③Sm1021 根瘤菌的检测
接种后2 周,取4 株接种的合欢幼苗,在南京农业大学园艺学院中心实验室,使用体式荧光显微镜(M165FC,Leica,德国)观察合欢幼苗根部及叶片等部位的Sm1021 根瘤菌所标记的GFP 蛋白的定位情况,分析根瘤菌是否接种成功。将合欢幼苗的根尖切成5 mm 左右的小段;将叶片的下表皮撕下来,分别放于荧光显微镜下观察,并拍照。
1.2.2 Cd 处理
待确定接种组接种成功后,将合欢幼苗分为7组(如表1所示):不接种根瘤菌,不进行Cd 处理,作为对照,编号为CK;接种根瘤菌,不进行Cd 处理,编号为CK*;接种根瘤菌,同时分别设置5、10、15、25 mg·L-14 个不同浓度的CdCl2处理,编号分别为5 Cd*、10 Cd*、15 Cd*、25 Cd*;不接种根瘤菌,只进行25 mg·L-1CdCl2处理,编号为25 Cd。

表1 合欢实生苗试验处理及其编号
每个处理15 株,分为3 组,每组5 株,视为重复3 次。Cd 处理组每3 天浇1 次设定浓度的CdCl2溶液,共重复浇灌5 次。待植株出现Cd 中毒症状后,采集叶片或根系鲜样用于测定生理生化指标。
1.3 测定内容与方法
测定各处理合欢叶片的相对电导率、叶绿素含量、可溶性蛋白质含量、丙二醛(MDA)含量、SOD 活性。
相对电导率的测定参考 《植物生理学实验指导》[7]的实验方法来测定;叶绿素含量参考《植物生理学实验指导》[7]的方法,采用95%y 乙醇提取,分光光度法测定;可溶性蛋白质含量的测定参考《植物生理学实验教程》[8]的方法,采用紫外吸收法测定;丙二醛(MDA)含量的测定参考《植物生理学实验》[9]的方法,采用TBA 法测定;SOD 活性测定参考《植物生理生化实验原理和技术》[10]的方法,采用NBT 法测定。
1.4 数据分析方法
采用Microsoft Excel 2017 进行图表绘制;采用SPSS 26.0 对试验数据进行单因素方差分析(oneway ANOVA),采用Duncan's 新复极差法进行差异显著性分析,其中显著性水平为p<0.05,柱形图标注的不同小写字母表示其在0.05 水平上差异显著。
2 结果与分析
2.1 接种根瘤菌对镉胁迫下合欢幼苗生长发育的影响
从图1可以看出,成功接种根瘤菌的对照组(CK)的合欢植株(图1B)明显比未接种根瘤菌的对照组植株(CK*)(图1A)生长状态好,表现为叶片数增加、株高增加,根系发达,尤其是侧根数增加、根茎加粗。Cd 胁迫处理合欢(图1C)的根系生长受到抑制,侧根数明显减少,叶片变小,叶片数减少;而Cd 胁迫处理接种根瘤菌后合欢(图1D)的根系明显较未接种组发达,虽然仍较对照组根系差,但仍有部分侧根存活,且株高生长仍能维持较好的水平,叶片数也较未接种组高。说明接种Sm1021 根瘤菌后可使合欢在镉胁迫下维持较正常的生长,缓解镉的伤害。

图1 接种Sm1021 根瘤菌对镉胁迫下合欢幼苗生长发育的影响
2.2 接种根瘤菌对镉胁迫下合欢叶片和根系相对电导率的影响
如图2所示,接种根瘤菌的对照CK* 合欢幼苗叶片的相对电导率比未接种的对照组显著降低,说明根瘤菌与合欢共生有利于保护合欢的细胞电解质外渗。接种根瘤菌后,低浓度(5 mg·L-1)Cd 胁迫下合欢叶片相对电导率与CK 并未显著升高,说明根瘤菌可显著改善合欢对低浓度Cd 的耐性;随着Cd 浓度升高,叶片相对电导率也随之升高,至15 mg·L-1Cd 处理时达到最高点,即使Cd 浓度继续升高至25 mg·L-1,叶片的相对电导率也不再升高。高浓度(25 mg·L-1)Cd 处理下,接种根瘤菌后叶片的相对电导率较同浓度Cd 处理未接种根瘤菌组并未显著降低,说明根瘤菌对高浓度Cd 胁迫下合欢叶片的细胞膜保护作用有限。

图2 接种根瘤菌对合欢在Cd 胁迫下叶片相对电导率的影响
从图3可以看出,CK*根系的相对电导率与CK无显著差异,说明接种根瘤菌对于根系相对电导率无显著影响。接种根瘤菌后,各处理浓度Cd 胁迫均导致根系的相对电导率显著升高;且随着Cd 浓度升高而随之升高,至15 mg·L-1Cd 处理时达到最高点,即使Cd 浓度继续升高(25 mg·L-1),根系的相对电导率不再升高。高浓度Cd 处理下,接种根瘤菌后根系的相对电导率较同浓度Cd 处理未接种根瘤菌组并未显著降低,说明根瘤菌对高浓度Cd 胁迫下合欢根系细胞膜的保护作用有限。
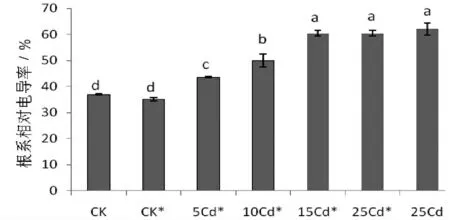
图3 接种根瘤菌对合欢在Cd 胁迫下根系相对电导率的影响
2.3 接种根瘤菌对镉胁迫下合欢叶片MDA 含量的影响
由图4可以看出,CK* 组叶片的MDA 含量比CK 组显著降低,说明接种根瘤菌可保护膜系统的过氧化。接种根瘤菌后,低浓度(5 mg·L-1)Cd 胁迫不会导致MDA 含量升高;但随着Cd 处理浓度升高,叶片MDA 含量仍然逐渐升高。与未接种根瘤菌的高浓度(25mg·L-1)Cd2+处理相比,接种根瘤菌的合欢MDA 含量并无显著降低,说明根瘤菌在高浓度下难以发挥对细胞膜的保护作用。

图4 接种根瘤菌对合欢在Cd 胁迫下叶片MDA 含量的影响
2.4 接种根瘤菌对镉胁迫下合欢叶绿素含量的影响
如图5所示,接种根瘤菌的对照组(CK*)合欢幼苗的叶绿素含量比未接种的对照组(CK)显著升高,说明根瘤菌可促进叶绿素的合成。

图5 接种根瘤菌对合欢在Cd 胁迫下叶绿素含量的影响
5-15 mg·L-1Cd 处理下,合欢的叶绿素含量与CK 相比,并未显著降低,说明根瘤菌可保护叶绿素不受Cd 毒害,直到高浓度(25 mg·L-1)Cd 处理下,叶绿素含量才显著下降。接种根瘤菌的植株在高浓度Cd 处理下叶绿素含量与未接种组并无显著差异,说明在高浓度Cd 胁迫下,根瘤菌无法发挥缓解叶绿素受Cd 毒害的作用。
2.5 接种根瘤菌对镉胁迫下合欢可溶性蛋白质含量的影响
从图6可看出,接种根瘤菌的对照组(CK*)合欢叶片可溶性蛋白质含量比未接种的对照组(CK)高,说明根瘤菌共生对提高可溶性蛋白质含量有一定的积极作用。

图6 接种根瘤菌对合欢在Cd 胁迫下叶片可溶性蛋白质含量的影响
各浓度Cd 处理均导致接种根瘤菌的合欢叶片可溶性蛋白质含量显著下降,且随着Cd 浓度的升高而逐次降低。但在高浓度(25mg·L-1)Cd 胁迫下,接种根瘤菌的植株蛋白质含量较未接种组显著升高,说明根瘤菌共生可显著缓解合欢受Cd 毒害导致的可溶性蛋白质含量下降。
2.6 接种根瘤菌对镉胁迫下合欢叶片SOD 活性的影响
如图7所示,接种根瘤菌的对照组(CK*)叶片的SOD 活性比未接种对照组的显著降低,说明根瘤菌可增强合欢幼苗清除氧离子自由基的能力。接种根瘤菌后,较低浓度(5-15 mg·L-1)的Cd2+处理导致合欢叶片SOD 活性显著上升,且呈现出随Cd 浓度升高而升高的趋势。说明根瘤菌可以激发合欢的抗氧化酶系统缓解Cd 胁迫导致的氧化伤害。

图7 接种根瘤菌对合欢在Cd 胁迫下叶片SOD 活性的影响
高浓度(25 mg·L-1)Cd2+处理导致叶片SOD 活性较对照显著降低,但接种根瘤菌可使SOD 活性有一定程度的恢复,但仍然无法恢复到对照水平。说明根瘤菌只能在一定程度上抵御Cd 胁迫;其清除氧离子自由基的能力有限,超过此浓度(15 mg·L-1)后,Cd 胁迫对膜的伤害程度超过了保护酶的防御能力,合欢体内的SOD 活性下降。
3 讨论
已知根瘤菌与豆科植物共生,可显著促进植物生长。本研究也证实了这一点。接种根瘤菌后,豆科植物合欢的实生苗根系较未接种组发达,叶片数、株高均增加。而且接种根瘤菌的对照组(CK*)合欢叶片的相对电导率、MDA 含量、SOD 酶活性较未接种组对照(CK)显著降低,叶绿素、可溶性蛋白质含量显著升高,进一步证明,接种根瘤菌增强了合欢幼苗的生理代谢活动,提高了抗性。本研究还考察了接种根瘤菌后,合欢幼苗在不同浓度Cd 胁迫下的生理反应。
Cd 对植物细胞的影响往往最先作用于细胞膜,使得细胞膜结构和功能受到破坏,导致细胞内电解质外渗[11]。因此,植株的膜透性(相对电导率)在一定程度上能够反映出Cd 对植株的伤害情况。本文结果表明,低浓度(5 mg·L-1)Cd 胁迫下,接种根瘤菌组叶片的相对电导率与对照(CK)无显著差异,说明合欢叶片可抵御低浓度Cd 胁迫对细胞膜的伤害;但该浓度Cd 胁迫下,根系的相对电导率却显著降低。说明合欢的根系比叶片对Cd 胁迫的响应更敏感。
植株体内MDA 含量作为膜系统受伤害程度的重要指标之一,其含量的多少也能反映出Cd 对植株的伤害情况。本研究表明,低浓度(5 mg·L-1)Cd胁迫下,接种根瘤菌组叶片的MDA 含量与CK 比,并未上升,说明根瘤菌共生有助于合欢抵御低浓度的Cd 胁迫,不使其膜系统受到过氧化伤害。
叶绿素含量的变化既可反映植物叶片光合能力的强弱,也可表征逆境胁迫下植物组织、器官的衰老状况[12]。本研究表明,5-10 mg·L-1Cd 胁迫下,接种根瘤菌组叶绿素含量与CK 比,并未降低,说明接种根瘤菌后,合欢可以忍受5-10 mg·L-1Cd 胁迫,保护叶绿素不受Cd 毒害而发生降解。
接种根瘤菌后,合欢叶片的SOD 活性在5-15 mg·L-1Cd 胁迫下均比CK 显著升高,说明合欢的保护酶系统发挥了重要的清除氧离子自由基的作用。
逆境胁迫下,植物体能够通过代谢调控积累一些小分子有机物质进行渗透调节,缓解渗透胁迫[13],可溶性蛋白质含量的高低在一程度上能够反映植物对逆境胁迫的耐性。Hong 等[14]的研究表明,Cd胁迫诱导可溶性蛋白质含量增加,可能是植物抵抗Cd 毒害的一种解毒机制。Du 等[15]的研究表明,Cd胁迫使小麦幼苗中可溶性蛋白质含量下降。尹国丽[1]的研究也表明,随Cd 胁迫浓度的增大,可溶性蛋白质含量减少。本试验的结果与Du 及尹国丽等人的研究结果相同,可溶性蛋白质含量随Cd 胁迫浓度的增大而下降,可能是因为Cd 胁迫处理时间较长,使得Cd 在合欢幼苗体内过量积累,导致蛋白质变性,造成可溶性蛋白质含量下降,蛋白水解酶的活性也因此受到抑制。但接种根瘤菌的合欢幼苗体内的可溶性蛋白质含量较未接种根瘤菌的合欢幼苗高,说明根瘤菌能诱导可溶性蛋白质含量增加,是一种根瘤菌协助合欢幼苗抵抗Cd 毒害的解毒机制。
总体来看,接种根瘤菌的合欢幼苗的生理反应均呈现出对较低浓度的Cd 胁迫有较好的耐性,能忍耐的最大Cd 胁迫浓度为15 mg·L-1,但在高浓度(25 mg·L-1)Cd 胁迫下并未表现出显著的缓解Cd毒害的效果。
因此,可以说明,合欢作为高效固氮植物,与根瘤菌建立共生体系,可以忍受一定浓度的Cd 胁迫,可将其应用于Cd 污染土壤的生物修复,具有良好的应用前景。

