非单纯大隐静脉功能不全的原发性下肢静脉曲张患者射频闭合联合硬化治疗术
冯琦琛,李 选,王昌明,盖 铄
(北京大学第三医院介入血管外科,北京 100083)
超声引导下腔内射频闭合联合曲张静脉局部剥脱、硬化治疗术在我中心已被广泛应用于原发性下肢静脉曲张的治疗中[1]。随着病例数量的积累,我们发现除因单纯大隐静脉瓣膜功能不全引起的原发性下肢静脉曲张外,有一些患者的下肢静脉曲张是由其他静脉返流或大隐静脉返流合并其他静脉返流造成的。现对我中心2018 年5 月—2019 年5 月非单纯大隐静脉功能不全的原发性下肢静脉曲张的特点及治疗体会做相关总结。
1 资料与方法
1.1 一般资料
2018 年5 月—2019 年5 月接受超声引导下射频闭合联合曲张静脉局部剥脱、硬化治疗术的非单纯大隐静脉功能不全的原发性下肢静脉曲张患者共61 例、63 条肢体,其中男42 例,女19 例,年龄23~78 岁,平均(55.9±13.2)岁。所有患者术前均行下肢静脉超声检查,明确为原发性下肢静脉曲张,同时除外下肢静脉血栓形成。统计其返流静脉种类、直径及CEAP 分级。所有患者均无严重器质性心脑血管疾病,无心脏起搏器植入患者及恶性肿瘤晚期患者。
1.2 方法
1.2.1 术前准备
所有患者术前均由同一手术团队医生行下肢静脉彩色多普勒超声检查。除外下肢静脉血栓形成。自小腿根据曲张静脉区域寻找返流来源。常规检查大隐静脉、小隐静脉及小腿常见穿支部位,如曲张静脉返流不是来源于上述血管,则通过超声追踪曲张静脉寻找返流来源。观察上述血管血流通畅情况、血流方向、血流速度及返流频谱。乏氏法(Valsalva 试验)引出隐股静脉交界处大隐静脉返流情况。腓肠肌挤压试验引出小隐静脉腘静脉交界处返流情况。如发现穿支静脉,通过腓肠肌挤压试验明确穿支静脉是否为返流穿支。副隐静脉近端返流情况通过Valsalva 试验引出。均以返流时间大于500 ms 为有临床意义。标注造成血流动力异常的血管部位以备进一步处理。
1.2.2 手术方法
患者平卧位或俯卧位,常规消毒、铺巾。超声探头及连接线套无菌包套,术中应用无菌耦合剂。
存在大隐静脉瓣膜功能不全的患者,实施常规超声引导下大隐静脉腔内射频闭合术(图1)[1]。存在小隐静脉瓣膜功能不全的患者,实施常规超声引导下小隐静脉腔内射频闭合术(图2)[1]。存在前副隐静脉瓣膜功能不全的患者超声引导下腔内射频闭合术的方法:超声定位前隐静脉,穿刺方法同大隐静脉射频闭合术。置入导管后,导管尖端需置于距前副隐静脉股静脉交汇处远端2 cm 处。如患者前副隐静脉开口位于大隐静脉近端,导管尖端则需置于隐股静脉交汇处远端2 cm 处。固定导管。导管置入过程中如发现血管迂曲,可以用导丝引导将导管跟进到工作区域。肿麻醉及射频治疗过程同大隐静脉射频闭合术。
如同一肢体大隐静脉与前副隐静脉同时存在瓣膜功能不全,大隐静脉、前副隐静脉同时置入鞘管,分别标记好导管工作位置后再行肿胀麻醉液注射。
对于存在穿支静脉返流、同时穿支静脉仅与近端隐静脉主干联通的肢体,于皮肤标记返流穿支静脉所在隐静脉主干的位置,局部重复射频治疗一次。对于穿支静脉不与隐静脉主干联通的肢体,行超声引导下射频穿刺针穿支静脉闭合术(图3)。在超声定位下,保持超声探头长轴与穿支静脉纵轴在同一平面,于穿支静脉皮下端相应位置局麻,局部1~2 mm小切口。超声引导下射频闭合针穿刺进入穿支静脉,头端超过深筋膜水平,不进入深静脉,拔出针芯。超声证实工作端位置,同时确认主机显示阻抗稳定于200~400 欧姆。沿穿支静脉周围行1%利多卡因局部麻醉。局部组织加压,同时开始射频治疗。每次射频治疗时间为1 min,同一血管平面选择3~4 个治疗点,每完成一个血管平面的射频治疗,射频针后退0.5 cm 继续重复上述步骤。直至射频针工作端到达浅筋膜水平。拔出射频针,局部加压包扎。
主干静脉经射频处理完毕后,穿刺皮下浅静脉曲张处,超声监测下注入泡沫硬化剂。局部术前标记静脉曲张明显位置行局麻下点状剥脱。术后沿硬化剂注射血管加压覆盖,切口敷料覆盖。
术后即刻穿医用循序减压弹力袜。嘱患者持续弹力袜加压,48 h 后可于卧床休息时脱掉弹力袜。
1.2.3 手术器材
B 超:LOGIQ Book XP GE;射频导管:Closure-Fast Endovenous Radiofrequency Ablation Catheter COVIDIEN,ClosureRFS Endovenous Radiofrequency Stylet;射频主机:COVIDIEN。肿胀麻醉液:2%利多卡因20 mL+生理盐水500 mL+碳酸氢钠2.5 mL+盐酸肾上腺素0.5 mg。硬化剂:1%聚多卡醇(安束喜)按1∶4 液-气比制作成泡沫硬化剂。
1.2.4 随访
嘱患者术后3 月完成首次随访,随访时超声复查原返流静脉,同时重新评估静脉曲张分级。
2 结果
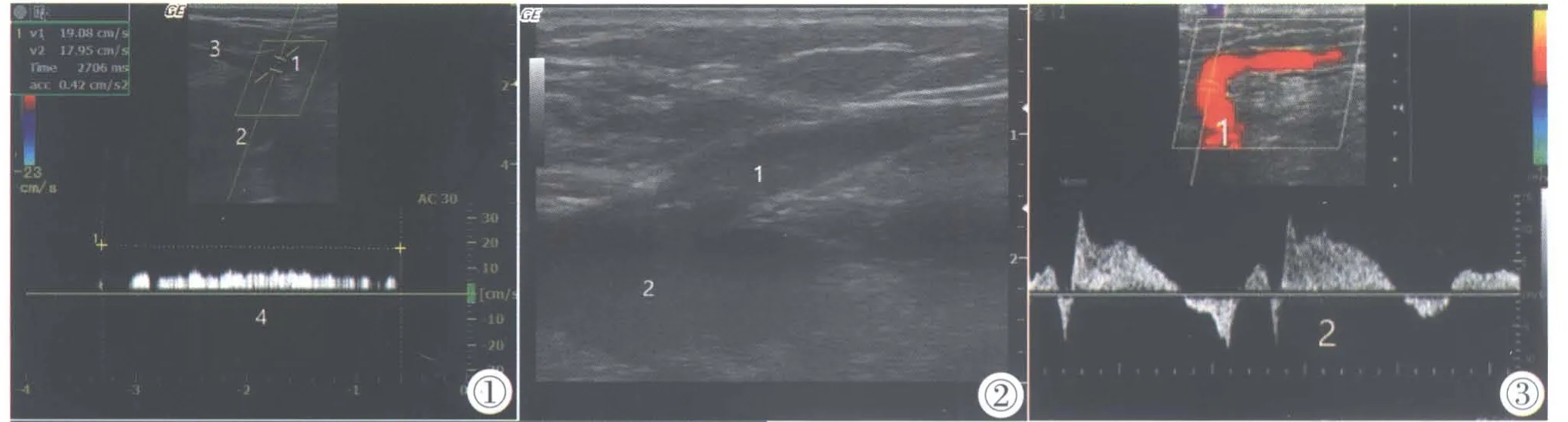
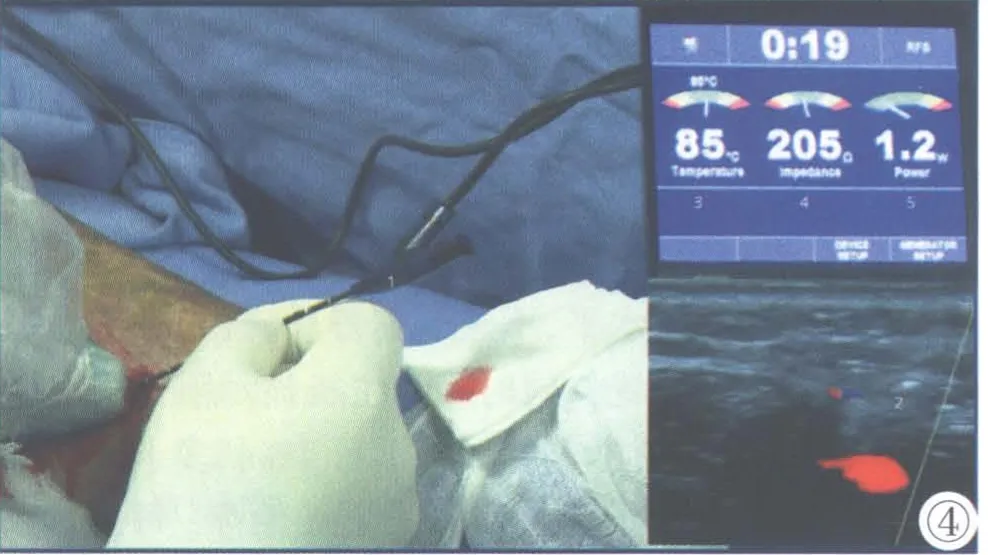
图1 隐股静脉交汇处返流。1:大隐静脉;2:股静脉;3:腹壁浅静脉。图2 小隐静脉腘静脉交汇处。1:小隐静脉;2:腘静脉。图3 病理性穿支返流。1:穿支静脉;2:返流时间大于500 ms。图4 穿刺针射频闭合穿支静脉。1:射频治疗针;2:超声下针尖位置;3:工作温度;4:阻抗;5:能量。Figure 1.The reflux in the saphenous-femoral vein junction.1:Great saphenous vein; 2:Femoral vein; 3.Superficial epigastric vein.Figure 2.Small saphenous-popliteal vein junction.1:Small saphenous vein; 2:Popliteal vein.Figure 3.The reflux in the perforator vein.1:The perforator vein; 2:The reflux time>500 ms.Figure 4.Perforator vein was treated with radiofrequency by ClosureRFS Endovenous Radiofrequency Stylet.1:ClosureRFS Endovenous Radiofrequency Stylet; 2:The image of the device tip; 3.Work temperature; 4.Work impedance; 5.Work power.
本组非单纯大隐静脉瓣膜功能不全造成下肢静脉曲张的类型有如下10 种情况:大隐静脉+穿支静脉返流患者23 例、24 条肢体;小隐静脉返流患者11例、12 条肢体;单纯穿支静脉返流患者10 例、10 条肢体;大隐静脉+小隐静脉返流患者8 例、8 条肢体;大隐静脉+小隐静脉+穿支静脉返流患者3 例、3 条肢体;大隐静脉+前副隐静脉返流患者2 例、2 条肢体;小隐静脉+穿支静脉返流患者1 例、1 条肢体;前副隐静脉返流患者1 例、1 条肢体;前副隐静脉+穿支静脉返流患者1 例、1 条肢体;其他静脉返流患者1 例、1 条肢体。按CEAP 分级:非单纯大隐静脉瓣膜功能不全患者中,C2~C3级29 条肢体,C4级23 条肢体,C5级9 条肢体,C6级2 条肢体。
非单纯大隐静脉瓣膜功能不全肢体发生重度下肢静脉曲张(C4~C6级)的比例为54.0%(34/63)。
非单纯大隐静脉瓣膜功能不全患者参与病理性返流的“罪犯”血管直径分别为小隐静脉4.1~7.0 mm,平均(5.3±0.9) mm;前副隐静脉5.0~8.0 mm,平均(6.1±1.3)mm;穿支静脉3.4~5.6mm,平均(4.1±0.6)mm。
存在病理性穿支静脉肢体共39 条,穿支静脉位于膝关节下方4 条(Boyd 组),位于小腿中段23 条,位于小腿下段6 条 (Cockett 组),位于大腿6 条(Hunter 组)。其中与胫后静脉交通31 条,与胫前静脉交通2 条。Hunter 穿支静脉均连接大隐静脉主干与股浅静脉。
存在病理性穿支静脉的39 条肢体中重度静脉曲张(C4~C6级)肢体27 条(27/39,69.2%)。病理性穿支静脉位于小腿的患者中重度静脉曲张的比例为81.8%(27/33)。无病理性穿支静脉肢体7 条(7/24,29.2%)。
手术成功率:所有63 条肢体手术均成功(手术成功标准:1:术后即刻超声证实经射频闭合的返流静脉无血流通过;2:硬化剂已填充曲张表浅静脉;3:顺利剥除小腿曲张静脉),其中13 条肢体射频治疗后表浅曲张静脉仅行硬化治疗。手术成功率100%。
手术并发症:61 例患者术中出现并发症1 例,术后出现并发症2 例。术中1 例并发症为一过性窦性心动过速伴血压升高。术后2 例并发症均为静脉剥脱切口术后活动性出血,均于术后1 h 内出现。
61 例患者中随访44 例、44 条肢体,随访率72.1%。随访结果:术后3 月复查,根据CEAP 分级,术后以C0级为治愈,以临床分级降低为好转,治愈及好转者均为有效。复查时先以B 超探查射频闭合的返流静脉有无血流通过,结果所有肢体隐静脉主干均闭塞(大/小隐静脉主干、前副隐静脉主干仍存在,但不可压缩,未见血流)。随访的44 条肢体中存在病理性穿支静脉肢体32 条,其中3 条原发病理性穿支静脉内可见血流,但腓肠肌挤压试验未见病理性返流引出。44 条肢体术后分级C0级15 条,临床分级降级的肢体24 条,有效率88.6%。C4级患肢中随访19 条,其中5 条肢体仍残留色素沉着,虽较前好转,但认为分级没有改变。C5及C6级患肢共随访9 条,患肢溃疡均完全愈合。
3 讨论
由于射频闭合技术治疗原发性下肢静脉曲张对超声的依赖,使得手术医生对下肢静脉曲张患者血流动力学的认识越来越接近真实情况。以往对原发性下肢静脉曲张患者仅关注与大隐静脉相关的静脉瓣膜功能[2-4]。在原发性下肢静脉曲张患者中,通过射频治疗前的超声检查,越来越多的非单纯大隐静脉瓣膜功能不全造成的下肢静脉曲张被发现。其中常见的“罪犯”血管有小隐静脉、前副隐静脉和各个部位的穿支静脉。这些返流静脉或单独或共同参与下肢静脉曲张的形成。因此,在术前诊断过程中需要全面掌握下肢浅静脉血流动力学情况,通过合理的治疗手段完全阻断浅静脉返流。
本组病例中,存在穿支静脉返流的病例所占比例最高(62.3%,38/61)。王深明等[5]报道97.5%的下肢静脉功能不全患者小腿部位溃疡与穿支静脉返流相关。本组病例中存在病理性穿支静脉的39 条肢体中重度静脉曲张(C4~C6级)肢体27 条,占69.2%。病理性穿支静脉位于小腿的患者中重度静脉曲张的比例为81.8%。因此对于存在重度下肢静脉曲张的患者,超声检查时更应注意病理性穿支静脉存在的可能。文献报道穿支静脉的内径大小对其功能有预测价值[6]。本组病例中病理性穿支静脉直径为3.4~5.6 mm,平均(4.1±0.6)mm,与文献报道类似[7]。根据穿支静脉解剖区域的不同,将下肢穿支静脉分为4 组:大腿组穿支静脉命名为Hunter 组,位于膝关节上方和下方的穿支静脉分别命名为Dodd 组和Boyd 组,小腿组穿支静脉命名为Cockett 组。Cockett 组多数穿支静脉位于小腿肌肉泵的下方,受到较大的压力,因此是静脉性溃疡的好发部位。本组病例中Cockett 组穿支静脉发生病理性改变的比例最高(74.4%,29/39),Hunter 组占15.4%(6/39),Boyd 组占10.3%(4/39)。病理性穿支静脉与胫后静脉交通的最多,占79.5%,考虑与所在位置肌肉较发达、为小腿肌肉泵的主要组成部分有关。
小隐静脉瓣膜功能不全虽然在所有下肢静脉曲张患者中所占比例较低[8],但在非单纯大隐静脉功能不全的原发性下肢静脉曲张患者中占较高比例。本组病例中合并小隐静脉瓣膜功能不全的患者占37.7%(23/61)。小隐静脉瓣膜功能不全常与大隐静脉瓣膜功能不全有类似症状。如小隐静脉主干严重扩张时可通过视诊发现,但确诊仍需依靠超声多普勒测量血流动力学。由于大多数小隐静脉回流至腘静脉,Valsalva 试验的敏感性较大隐静脉低,因此常用腓肠肌挤压试验观测小隐静脉瓣膜功能情况。存在瓣膜功能不全的小隐静脉的直径,本研究测量结果为4.1~7.0 mm,平均(5.3±0.9)mm,与文献报道相似[9]。
前副隐静脉作为大隐静脉近端常见的5 个属支之一,在以传统大隐静脉高位结扎联合剥脱治疗静脉曲张的背景下,较少单独对其进行影像学检查。因此国内关于前副隐静脉瓣膜功能不全参与或引起下肢静脉曲张的文献较少。近年来随着腔内技术的普及,国外对此有较多研究[10-12],并指出前副隐静脉瓣膜功能不全在下肢静脉曲张患者中与大隐静脉瓣膜功能不全具有相同的严重程度[11]。本组病例中,存在前副隐静脉瓣膜功能不全的患者虽然仅有4 例,但仍提示我们其对下肢静脉曲张的影响不可忽视。
本组中有1 例为腘窝位置1 根浅静脉与腘静脉直接相通、返流时间大于500 ms,致小腿内侧及后侧皮下浅静脉明显曲张。此患者在术前门诊评估时曾被误认为是小隐静脉瓣膜功能不全,通过术前超声自静脉团块最明显处追踪其走向最终明确。该患者大隐静脉、小隐静脉及副隐静脉均未见明显返流,此返流静脉不在常见穿支静脉位置。
本组病例中,上述各种非大隐静脉瓣膜功能不全的情况单独或同时出现,亦有同时合并大隐静脉瓣膜功能不全的患者。此类患者引起返流的静脉多,穿支静脉返流对局部静脉高压的影响更直接,造成重度静脉曲张(C4~C6级)更为常见。因此,对于重度原发性下肢静脉曲张(C4~C6级)的患者,术前超声检查时应注意不要遗漏“罪犯”血管。
超声引导下射频治疗闭合大隐静脉及小隐静脉主干已经成为原发性下肢静脉曲张的规范治疗手段,并获得了确切的疗效[1]。病理性穿支静脉有多种治疗方式[13-15]。开放手术和内镜方法创伤较大,且需要椎管内或全身麻醉。超声引导下射频治疗可以在局麻下完成,且射频治疗仪除通过超声监视定位外,还可以通过实时阻抗反馈提示射频工作端位置。非工作状态下,阻抗为200~400 欧姆时,提示工作端位于目标穿支静脉内;阻抗>400 欧姆时,提示工作端可能位于组织内;阻抗<200 欧姆时,提示工作端可能位置过深,位于深静脉腔内。此信息与超声影像结合,增加了穿支静脉射频治疗的安全性。
局部剥脱和泡沫硬化剂注射是治疗表浅曲张静脉的常用方式[1,15]。重度下肢静脉曲张患者的皮肤存在营养不良、溃疡或感染情况。对于保证皮肤完整性,泡沫硬化剂的使用更为安全。在患肢皮肤状态不佳的情况下,超声引导下表浅静脉精准穿刺泡沫硬化剂注射可以更好的减少皮肤损伤、更精准的监测硬化剂弥散范围,以指导后续加压治疗,提高疗效。
63 例患者术中出现并发症1 例,为一过性窦性心律过速伴血压升高。此患者在行大隐静脉射频治疗时,注射肿胀麻醉液过程中超声监测到注入的麻醉液随血管腔内血液回流,未进入隐静脉间隙,遂立即停止注射。约10 s 左右,患者的心率增至105 次/min,收缩压增高至160 mmHg(1 mmHg≈0.133 kPa)(术前基础血压正常),同时出现心悸症状。考虑与含有肾上腺素的麻醉药物注入血管有关。停止注射后1 min 内患者心率恢复正常。因此,肿胀麻醉实施过程中严密监测至关重要。2 例术后并发症均为局部静脉剥脱切口术后活动性出血,均与局部皮肤营养状态差、皮肤增厚变硬有关。局部加压后出血停止。为避免类似情况发生,建议对于皮肤状态不佳的患者尽量减少局部剥脱,以硬化治疗为主。
本组患者近期随访率为72.1%。以静脉曲张临床分级为基础,随访患者的有效率为88.6%。应用此方法实施的超声引导下射频治疗技术均能成功使大隐静脉、小隐静脉及前副隐静脉主干闭塞,患者自觉症状均有改善。病理性穿支静脉射频治疗患者中有3例穿支静脉未完全闭合,但返流消失,可能是因为穿支静脉热损伤后局部挛缩或闭塞后再通,导致管径减小,限制了返流。这种情况还需进一步密切随访,观察穿支静脉远期返流及局部症状、体征的远期变化。
综上,射频闭合联合硬化治疗术是一种微创、安全、有效的治疗非单纯大隐静脉瓣膜功能不全的原发性下肢静脉曲张的方法,其近期疗效满意,远期疗效有待进一步随访。

