N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸调节α-微管蛋白乙酰转移酶1抑制矽肺纤维化
张巧丹 牛思宇 李耕旭 陈建星 汤庆南 徐洪 杨方耿玉聪 李世峰
华北理工大学1医学实验研究中心,2基础医学院(河北唐山063210)
矽肺是危害最严重也是我国发病率最高的职业病,其主要病理特征是矽结节的形成及肺间质纤维化。越来越多研究揭示了活性四肽N-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸(N-acetylseryl-aspartyl-lysyl-proline,Ac-SDKP)的抗器官纤维化作用,本课题组围绕Ac-SDKP 拮抗矽肺纤维化也做了较多工作。课题组近期研究发现,随着大鼠矽肺纤维化的进展,乙酰化微管蛋白α(acetylated tubulin α,Ac-Tub α)的表达水平逐渐降低。Ac-SDKP 通过稳定Ac-Tub α 的表达,抑制肌成纤维细胞分化及胶原沉积,发挥抑制矽肺纤维化的作用[1]。然而具体机制尚未阐明。α-微管蛋白的第40 位的赖氨酸残基是乙酰化的重要位点[2],在进化上较为保守。有研究表明,α-微管蛋白乙酰转移酶1(α-tubulin acetyltransferase 1,α-TAT1)是哺乳动物和线虫体内主要的、也可能是唯一的乙酰转移酶[3],动态调节α-微管蛋白的翻译后修饰,影响微管骨架的稳定[4-6]。本研究拟通过构建矽肺纤维化动物模型及转化生长因子(transforming growth factor-β1,TGF-β1)诱导的肌成纤维细胞转化模型,观察Ac-SDKP 能否通过调节α-TAT1 的表达,稳定微管蛋白的乙酰化水平,以进一步揭示Ac-SDKP 抑制矽肺纤维化的作用机制。
1 材料与方法
1.1 实验动物 SPF 级健康雄性成年Wistar 大鼠18 只,体质量(180±10)g,购于北京维通利华动物技术有限公司,动物许可证号:SLXK 京20090008。本研究已得到华北理工大学动物伦理委员会批准并保证整个研究过程符合伦理学要求,伦理批准文号:华北理工医伦[2013]第038 号。
1.2 材料、主要试剂 二氧化硅粉尘(美国Sigama公司),Ac-SDKP(H-1156)(瑞士Bachem AG 公司),TGF-β1(100-21)(美国peprotech 公司),Ⅰ型胶原(collagen typeⅠ,ColⅠ)兔抗(ab34710)(美国Abcam公司),α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)鼠抗(ab7871)(美国Abcam 公司),Ac-Tub α鼠抗(sc-23950)(美国Santa Cruz 公司),α-TAT1 兔抗(Qc13106)(北京奥维亚生物科技有限公司),甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)兔抗(sc-25778)(美国Santa Cruz 公司),羊抗鼠二抗、羊抗兔二抗(武汉博士德生物有限公司),α-TAT1 过表达质粒(广州锐博生物有限公司),α-TAT1 沉默质粒(广州锐博生物有限公司),脂质体2000 转染试剂(lipofectamine 2000,Lipo2000)(赛默飞世尔科技公司),DAB 显色试剂盒(ZLI-9032)(北京中衫金桥)。
1.3 模型制备 采用HOPE-MED8050 动式染尘控制系统构建矽肺模型[7],18 只大鼠随机分为3 组:对照组(腹腔内埋入含2 mL 生理盐水的微量缓释胶囊,至24 周处理)、矽肺模型组(腹腔内埋入含2 mL 生理盐水的微量缓释胶囊,动式染尘每天3 小时,至24 周处理)、Ac-SDKP 处理组(腹腔内埋入含2 mL 生理盐水的微量缓释胶囊,动式染尘3 h/d,染尘至12 周后将胶囊更换为含Ac-SDKP 的微量缓释胶囊,至24 周处理)。
1.4 细胞培养 在5%CO2、37 ℃条件下培养原代肺成纤维细胞,所得第2 代细胞用于实验。采用脂质体方法转染成纤维细胞,待培养瓶中的细胞融合至80%~90%左右即可用α-TAT1 过表达质粒(α-TAT1-cpDNA)、α-TAT1 沉默表达质粒(α-TAT1-siRNA)或空载质粒体进行转染,所得转染细胞用于实验。实验分组如下:(1)α-TAT1 过表达质粒载体构建:空白对照组:空白培养基培养;转染试剂对照组:空白培养基+Lipo2000;空载质粒对照组:空白培养基+Lipo2000+空载质粒体;α-TAT1 过表达质粒组:空白培养基+Lipo2000+α-TAT1 过表达质粒体。(2)α-TAT1 基因沉默质粒载体构建:阴性对照siRNA 组:空白培养基+Lipo2000+阴性对照siRNA;α-TAT1-siRNA#1组:空白培养基+Lipo2000+α-TAT1-siRNA#1;α-TAT1-siRNA#2 组:空白培养基+Lipo 2000+α-TAT1-siRNA#2;α-TAT1-siRNA#3组:空白培养基+Lipo2000+α-TAT1-siRNA#3。(3)α-TAT1 沉默与过表达实验分组:对照组:空白培养基;TGF-β1 诱导组:以含TGF-β1(5 ng/mL)的培养基诱导48 h;Ac-SDKP 预处理组:Ac-SDKP(10-8mol/L)预处理1 h后,再给予TGF-β1(5 ng/mL)诱导48 h;α-TAT1 沉默组:α-TAT1-siRNA 转染6 h,再以完全培养基培养24 h 后,以Ac-SDKP 预处理1 h 后再给予TGF-β1 诱导24 h;α-TAT1 过表达组:α-TAT1-cpDNA 转染6 h,再以完全培养基培养24 h 后,以Ac-SDKP 预处理1 h 后再给予TGF-β1 诱导24 h。
1.5 免疫组织化学染色 免疫组织化学染色法检测大鼠肺组织中α-TAT1 的表达。石蜡切片常规脱蜡至水,高压修复,内源性过氧化物酶阻断剂封闭,滴加一抗(α-TAT1 抗体浓度为1:200)4 ℃孵育过夜,滴加二抗37 ℃孵育2 h,DAB 显色,苏木素复染,分化返蓝,梯度酒精脱水,中性树胶封片。采用显微镜进行图像采集。
1.6 免疫印迹 提取肺组织蛋白或提取肺成纤维细胞蛋白,采用BCA 法测定蛋白浓度,据测定的蛋白浓度,用细胞裂解液和5×上样缓冲液配置蛋白,电泳及电转。一抗孵育(其中抗体浓度为Col I(1∶1 000)、α-SMA(1∶800)Ac-Tub α(1∶800)、α-TAT1(1∶800),在4 ℃冰箱内孵育过夜,次日滴加二抗(抗鼠/抗兔)在37 ℃孵育箱内孵育30 min,而后ECL 发光显色仪器显影,保存对应的图像并用Image-proplus 分析其灰度值。
1.7 统计学方法 应用SPSS 20.0 统计软件进行统计学处理。进行完全随机设计的单因素方差分析,方差齐采取LSD 检验,不齐采取Tamhane′s 检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 Ac-SDKP 通过调节α-TAT1 抑制大鼠矽肺纤维化的作用 免疫组织化学染色结果所示(图1):对照组肺泡壁较薄、结构清晰完整,未见炎症细胞渗出,α-TAT1 可强阳性表达于成纤维细胞、Ⅱ型肺泡上皮细胞及支气管纤毛等处;模型组肺泡壁增厚、结构紊乱,可见明显的矽肺大结节及典型的间质纤维化区域,α-TAT1 在矽结节处表达缺失;Ac-SDKP 处理组的病变程度较矽肺模型组减轻,肺泡壁结构相对正常,α-TAT1 表达增多。
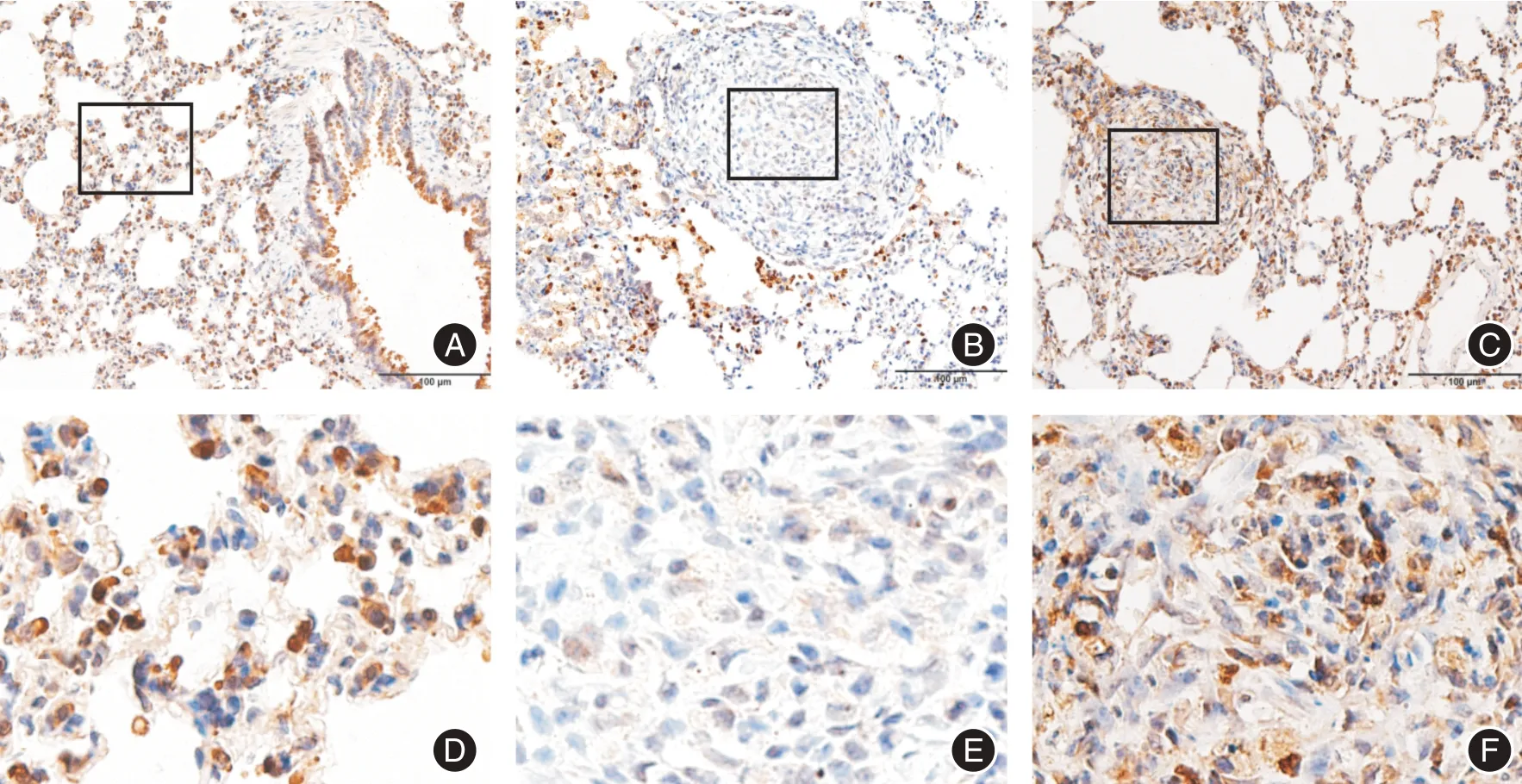
图1 α-TAT1 在矽肺大鼠肺组织中的表达(免疫组织化学染色)Fig.1 Expression of α-TAT1 in lung tissues of silicosis rats(immunohistochemical staining)
Western blot 结果显示(图2、表1):与对照组比较,矽肺模型组的Col I、α-SMA 表达上调至对照组的3.38 倍(P=0.034)、1.70 倍(P<0.001);Ac-Tub α和α-TAT1表达下调至对照组的31.58%(P<0.001)和45.83%(P<0.001),差异均有统计学意义。与矽肺模型组相比较,Ac-SDKP 处理组的Col I、α-SMA表达下调至矽肺模型组的44.44%(P=0.095)、52.94%(P<0.001);Ac-Tub α、α-TAT1 表达上调至矽肺模型组的2.00 倍(P= 0.041)和1.45 倍(P=0.020),除Col I 外差异均有统计学意义。
2.2 Ac-SDKP 通过调节α-TAT1 抑制肌成纤维细胞转化的作用 Western blot 结果显示(图3、表2),构建α-TAT1 过表达质粒载体,空白对照组、转染试剂对照组和空载质粒对照组之间,α-TAT1 的表达水平差异无统计学意义,而α-TAT1 过表达质粒组中α-TAT1 表达与空载质粒对照组相比明显上调,其表达量为空载质粒对照组的2.59 倍(P<0.001),差异有统计学意义。构建α-TAT1 沉默表达质粒载体,与阴性对照siRNA 组相比,在各转染组中α-TAT1-siRNA#2 组的α-TAT1 蛋白表达下调较为显著,下调至阴性对照siRNA 组的39.75%(P=0.004),差异有统计学意义。
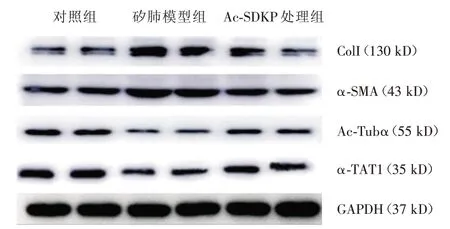
图2 Ac-SDKP 对矽肺大鼠肺组织中Col I、α-SMA、Ac-Tub α、α-TAT1 蛋白表达的调节(免疫印迹法)Fig.2 The expression of Col I, α-SMA,Ac-Tub α,α-TAT1 regulated by Ac-SDKP in lung from silicotic rats(western blot)
表1 肺组织中Col I、α-SMA、Ac-Tub α、α-TAT1 蛋白表达(n=4)Tab.1 The expression of Col I,α-SMA,Ac-Tub α,α-TAT1 in lung tissue(n=4) ±s
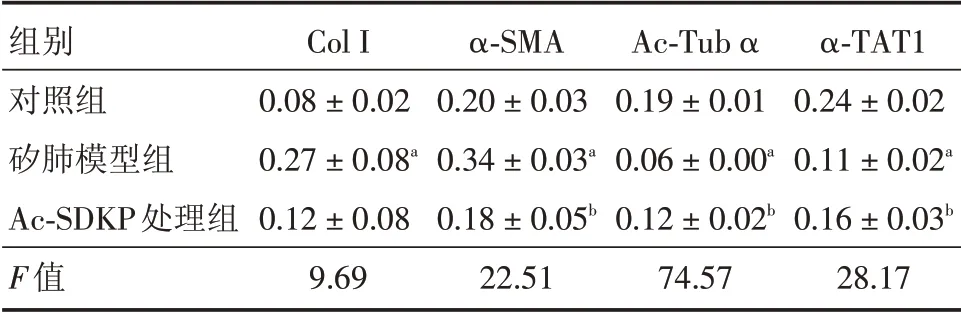
表1 肺组织中Col I、α-SMA、Ac-Tub α、α-TAT1 蛋白表达(n=4)Tab.1 The expression of Col I,α-SMA,Ac-Tub α,α-TAT1 in lung tissue(n=4) ±s
注:与对照组相比,aP <0.05;与矽肺模型组相比,bP <0.05
组别对照组矽肺模型组Ac-SDKP处理组F值Col I 0.08±0.02 0.27±0.08a 0.12±0.08 9.69 α-SMA 0.20±0.03 0.34±0.03a 0.18±0.05b 22.51 Ac-Tub α 0.19±0.01 0.06±0.00a 0.12±0.02b 74.57 α-TAT1 0.24±0.02 0.11±0.02a 0.16±0.03b 28.17
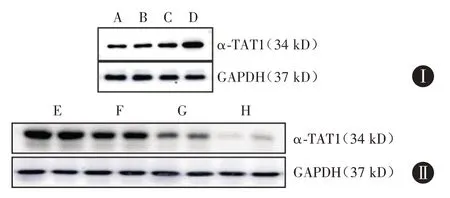
图3 α-TAT1过表达载体(n=3)与α-TAT1沉默载体(n=4)的筛选Fig.3 Screening of over-expression vector of α-TAT1(n=3),silencing vector of α-TAT1(n=4)
表2 α-TAT1 过表达(n=3)与沉默载体(n=4)的筛选Tab.2 Screening of over-expression(n=3)and silencing(n=4)vector of α-TAT1±s
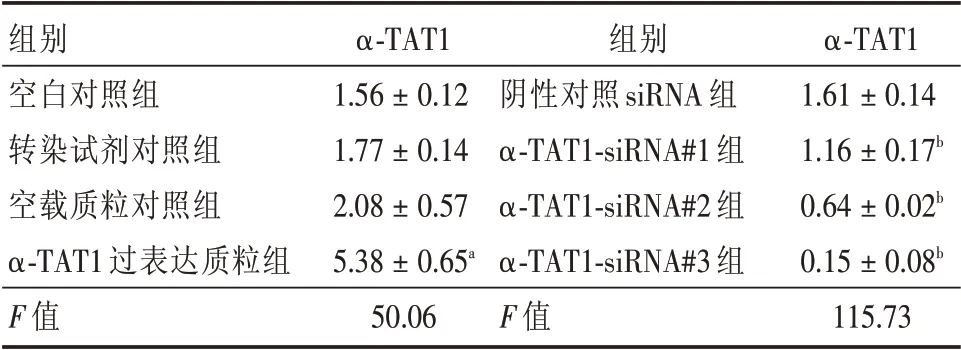
表2 α-TAT1 过表达(n=3)与沉默载体(n=4)的筛选Tab.2 Screening of over-expression(n=3)and silencing(n=4)vector of α-TAT1±s
注:与空载质粒对照组相比,aP <0.05;与阴性对照siRNA 组相比,bP <0.05
组别空白对照组转染试剂对照组空载质粒对照组α-TAT1 过表达质粒组F 值α-TAT1 1.56±0.12 1.77±0.14 2.08±0.57 5.38±0.65a 50.06组别阴性对照siRNA 组α-TAT1-siRNA#1 组α-TAT1-siRNA#2 组α-TAT1-siRNA#3 组F 值α-TAT1 1.61±0.14 1.16±0.17b 0.64±0.02b 0.15±0.08b 115.73
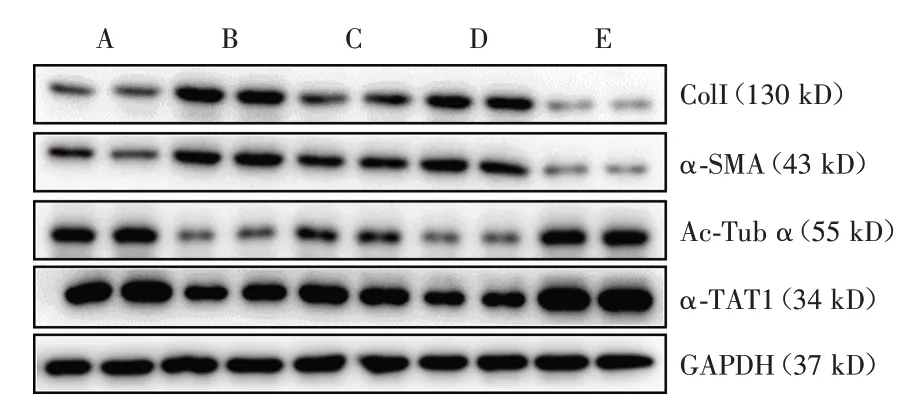
图4 α-TAT1 对TGF-β1 介导的肌成纤维细胞分化的调节(n=4)Fig.4 Regulation effect of α-TAT1 on TGF-β1 induced myofibroblast differentiation(n=4)
表3 α-TAT1 对TGF-β1 介导的肌成纤维细胞分化的调节(n=4)Tab.3 Regulation effect of α-TAT1 on TGF-β1 induced myofibroblast differentiation(n=4)±s
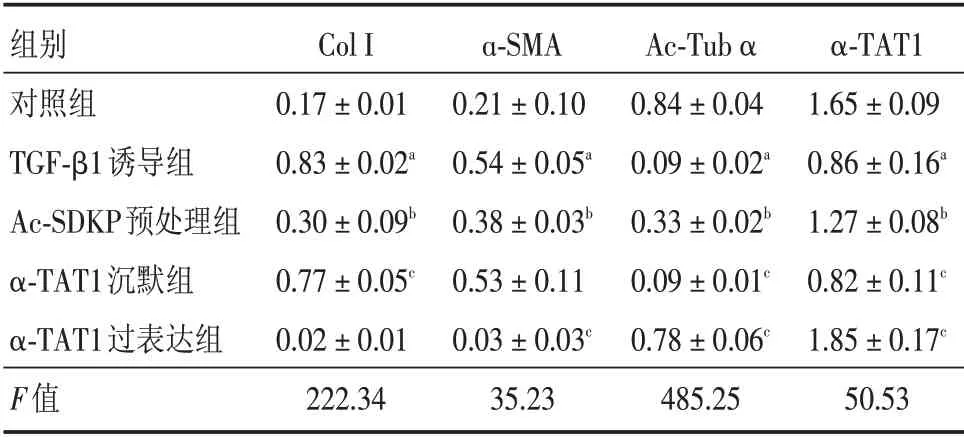
表3 α-TAT1 对TGF-β1 介导的肌成纤维细胞分化的调节(n=4)Tab.3 Regulation effect of α-TAT1 on TGF-β1 induced myofibroblast differentiation(n=4)±s
注:与对照组相比,aP <0.05;与TGF-β1 诱导组相比,bP <0.05;与Ac-SDKP 预处理组相比,cP <0.05
组别对照组TGF-β1诱导组Ac-SDKP预处理组α-TAT1沉默组α-TAT1过表达组F值Col I 0.17±0.01 0.83±0.02a 0.30±0.09b 0.77±0.05c 0.02±0.01 222.34 a-SMA 0.21±0.10 0.54±0.05a 0.38±0.03b 0.53±0.11 0.03±0.03c 35.23 Ac-Tub α 0.84±0.04 0.09±0.02a 0.33±0.02b 0.09±0.01c 0.78±0.06c 485.25 α-TAT1 1.65±0.09 0.86±0.16a 1.27±0.08b 0.82±0.11c 1.85±0.17c 50.53
Western blot 结果显示(图4、表3),与对照组相比,TGF-β1 诱导组的Col I、α-SMA 表达上调至对照组的4.88 倍(P<0.001)、2.57 倍(P= 0.027),Ac-Tub α、α-TAT1 表达下调至对照组的10.71%(P<0.001)、52.12%(P<0.001),差异均有统计学意义;Ac-SDKP 预处理后,Col I、α-SMA 蛋白表达下调至TGF-β1 诱导组的36.14%(P= 0.010)、70.37%(P=0.044),Ac-Tub α、α-TAT1 表达上调至TGF-β1 诱导组的3.67 倍(P<0.001)、1.48 倍(P=0.001),差异均有统计学意义;在此基础上给予α-TAT1 沉默时,Col I、α-SMA 表达上调至Ac-SDKP预处理组的2.57倍(P=0.004)、1.39倍(P=0.553),Ac-Tub α、α-TAT1 表达下调至Ac-SDKP 预处理组的27.27%(P<0.001)、64.57%(P<0.001),除α-SMA 外差异均有统计学意义;令α-TAT1 过表达,Col I、α-SMA 表达下调至Ac-SDKP 预处理组的6.67%(P=0.073)、7.89%(P<0.001),Ac-Tub α、α-TAT1 表达上调至Ac-SDKP 预处理组的2.36 倍(P= 0.002)、1.46 倍(P<0.001),除Col I 差异均有统计学意义。
3 讨论
Ac-Tub α常作为微管稳定的标志之一[5-6],课题组前期研究发现,在矽肺纤维化模型中,Ac-Tub α表达下调,能很好地反映矽肺的发生与发展[1]。在急性肾损伤中也有报道,Ac-Tub α水平下降[8],阻碍了肾小管上皮细胞再生,加速肾纤维化的进程[8]。微管蛋白乙酰化可稳定微管骨架,维持上皮细胞的极化状态,并通过稳定肺泡上皮细胞紧密连接,有效地抵御外界刺激和上皮-间质转化[9],微管蛋白去乙酰化,促进心肌成纤维细胞增殖和心脏纤维化[10]。课题组前期也发现,Ac-SDKP 通过抑制组蛋白去乙酰化酶6 的活性,维持Ac-Tub α的乙酰化水平,从而有效的延缓矽肺纤维化[1]。可见,维持微管蛋白的乙酰化水平,调节微管骨架的稳定性,有望成为控制矽肺纤维化病情进展的重要治疗靶点。
在基础和临床上,针对微管稳定的调节在抗器官纤维化的治疗中逐渐被关注[11-12],然而,据目前报道,微管稳定剂可维持Ac-Tub α水平,但其抗器官纤维化效果存在差异。如ZHANG 等[13]证明,单侧输尿管梗阻模型给予微管稳定剂紫杉醇治疗,可有效的延缓肾纤维化进程。而KONG 等[8]发现,在缺血再灌注损伤恢复期给予紫杉醇治疗,反而加速肾纤维化。因此,微管稳定剂抗纤维化的机制和疗效复杂。
α-TAT1 是一种特异的微管乙酰转移酶,其进入微管空腔,催化α 微管蛋白第40 位赖氨酸位点Lys-40 乙酰化,上调Ac-Tub α 水平[2-5]。由于其作用靶标明确,阐释α-TAT1/Ac-Tub α 途径在抑制器官纤维化中的机制更有价值。研究报道,在缺血再关注损伤中,肾组织微管网络破坏和肾纤维化与α-TAT1 的表达水平降低有关[8]。课题组近期发现,α-TAT1 过表达能够通过保护肺泡Ⅱ型上皮细胞[14],和促进活化的成纤维细胞(肌成纤维细胞)凋亡[15]的双重作用,抑制矽肺纤维化的进程。另有报道,肌动蛋白-转录因子心肌相关转录因子(myocardin-related transcription factor,MRTF)-血清反应因子(serum response factor,SRF)转录环可调节α-TAT1 基因表达,控制Ac-Tub α水平[16-17]。在本研究发现,Ac-SDKP 介导的Ac-Tub α水平上调和对α-SMA 表达抑制作用可被α-TAT1-siRNA 阻断,证实α-TAT1 可调节细胞微管和微丝骨架动态变化,从而抑制肌成纤维细胞转化[17]。
综上所述,本研究以α-TAT1 作为调节微管稳定的靶点,揭示了α-TAT1 具有一定的拮抗矽肺纤维化的效果。此外,本研究还发现,Ac-SDKP 可活化α-TAT1/Ac-Tub α 信号,抑制大鼠矽肺纤维化和肌成纤维细胞的转化。未来的研究中,笔者将深入探讨α-TAT1 对肺泡上皮细胞和成纤维细胞表型转化的机制,并着重比较α-TAT1 对上皮细胞和间质细胞表型转化的差异。这将对抗纤维化的靶向治疗提供重要的实验依据。
——水芹主要害虫识别与为害症状

