小菜蛾共生真菌棒曲霉 XCE02的代谢产物及抗菌活性
丁唯嘉,李明哲,陈泽林,蔡佳纯,张梓娜,李月婷,孙晨昊,李春远
(华南农业大学 材料与能源学院,广东 广州 510642)
真菌引起的植物病害对农业生产和食品保藏造成了严重的危害,如香蕉炭疽病使香蕉果实变黑、腐烂[1],小麦赤霉病引起小麦植株出现苗枯、茎腐、秆腐和穗腐等症状[2]。化学农药是目前防治植物真菌病害的主要手段,但也造成病原菌抗药性增强、农药残留等问题[3]。微生物天然产物因具有易降解、毒性低等特点,是化学农药替代品的重点研究对象。已知的昆虫种类达90万种,预测可能有200~3 000 万种[4],而几乎所有昆虫都有共生菌。昆虫共生菌分布于昆虫体内,大部分是酵母类、真菌类和细菌类共生菌[5]。相对于植物共生菌,目前对昆虫共生菌代谢产物的研究远远不足[6]。小菜蛾Plutella xylostella属鳞翅目菜蛾科,1年可传17代,在我国南方尤为泛滥,主要危害甘蓝、青花菜、白菜、油菜、萝卜等十字花科植物[7]。小菜蛾以蔬菜为食,因此会接触到植物病原菌,其共生菌对植物病原菌可能有选择性抑制作用。在前期对小菜蛾共生真菌的研究中,发现分离自肠道的棒曲霉Aspergillus clavatusXCE02菌株在大米固体培养基上培养时,其代谢产物乙醇提取物为 1 mg/mL时对植物病原菌小麦赤霉菌Fusarium graminearum和香蕉炭疽菌Colletotrichum musae显示了较好的抗菌活性,抑菌圈直径分别约为15.61和14.35 mm。本文研究棒曲霉菌株XCE02代谢产物的分离、鉴定及抗菌活性,以期寻找到相应的抗菌先导化合物。
1 材料与方法
1.1 材料
AV 600核磁共振波谱仪(瑞士BrukerBiospin AG);MDS SCIEX APCI 2000 液质联用仪;Orbitrap高分辨质谱仪 (德国 Thermo Fisher Scientific Inc.);SEPA-300 旋光仪;GF254 和柱层析硅胶为青岛海洋化工厂生产;φ为99%的多菌灵购于上海迈瑞尔化学技术有限公司;试验所用其他试剂均为分析纯。
棒曲霉XCE02分离自小菜蛾肠道[8]。植物病原菌小麦赤霉菌和香蕉炭疽菌引种自华南农业大学农学院,以上菌株均保藏于华南农业大学材料与能源学院。
1.2 菌种鉴定及发酵
将XCE02菌株划线接种于马铃薯蔗糖琼脂(PSA)培养基,26 ℃恒温黑暗条件下培养10 d后,观察其生长情况和菌落形态,并进行初步鉴定。
参考文献[9]的方法PCR扩增真菌核糖体ITS基因区段鉴定真菌。用CTAB法提取菌株总DNA[10],用 rDNA-ITS 序列通用引物 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)与 ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[11]进行 PCR 反应。反应体系与文献[12]相同,具体为:TaqPlus PCR MasterMix [天根生化 (北京)科技有限公司 ]25 μL,上游和下游引物各 2 μL,模板 DNA(10 ng)1 μL,dd H2O 20 μL,总体积 50 μL。反应程序为:95 ℃预变性 5 min;95 ℃ 变性 30 s,55 ℃ 退火 30 s,72 ℃ 延伸 35 s,共 30 个循环;72 ℃ 延伸 10 min。PCR产物送至广州天一辉远基因科技有限公司进行测序,已测序的核苷酸序列在NCBI网站进行BLAST相似性比对。
发酵培养:在 1 000 mL 锥形瓶中装入 100 g 籼米、100 mL H2O,于 121 ℃ 高温高压灭菌 30 min 后接种菌株 XCE02,28 ℃ 条件下静置培养 30 d,共培养100瓶。
1.3 发酵产物的提取与分离
发酵产物用95%(φ)乙醇溶液浸泡3次,减压浓缩除去水后用乙酸乙酯萃取3次,减压浓缩,经硅胶柱层析,以石油醚−乙酸乙酯(体积比为100∶0~0∶100)溶液、乙酸乙酯−甲醇 (体积比为 100∶0~80∶20)溶液系统梯度洗脱,得到10种化合物。
1.4 结构鉴定
通过分析化合物的氢谱(1H NMR)、碳谱(13C NMR)、电喷雾质谱(ESIMS)、电喷雾高分辨质谱(HRESIMS)等试验数据与文献或与标准品对照等方法,鉴定10种化合物的结构。
1.5 抗菌活性试验及数据处理
采用滤纸片扩散法[12-13]测试结构较为新颖的化合物对香蕉炭疽菌、小麦赤霉菌的抗菌活性,28 ℃条件下香蕉炭疽菌和小麦赤霉菌分别培养48和24 h,以多菌灵和溶解样品的溶剂(φ为5%的二甲基亚砜,DMSO)分别作为阳性对照和空白对照。鉴于所得样品数量较少,配制的溶液浓度较低,多菌灵和待测样品均为250 μg/mL,用十字交叉法量取抑菌圈直径,每种样品,同一植物病原菌在每个培养皿上测试2组抑菌圈直径,重复3次,共得到6组抑菌圈数据,最终结果以6组抑菌圈数据的平均值±标准误表示。用SPSS 17.0统计软件进行单因素方差(One-way ANOVA)和相关性分析。
2 结果与分析
2.1 菌株鉴定
菌株在PSA培养基上培养10 d后菌落表面呈蓝灰绿色,基层有较多分生孢子。菌落边缘有一薄层白色菌丝紧贴基质生长,背面暗黄色。孢子穗圆筒形,小梗单层,孢子梗宽为 7.5~15.0 μm;顶囊棍棒形;分生孢子椭圆形,(2.5~3.5) μm × (2.8~3.9) μm,表面光滑,壁稍厚序列,符合曲霉属棒曲霉特征[14]。进一步用PCR扩增真菌核糖体ITS序列的方法验证菌株的种属,DNA测序结果与NCBI BLAST数据库中编号为KY765893.1的棒曲霉序列相似性为100%,与编号为 AY373847.1、NR121482.1、KF669481.1的棒曲霉序列相似性均为99%。此结果与形态学鉴定结果吻合,表明该菌株属于棒曲霉,该菌株的GenBank登录号为MK828108.1。
2.2 化合物的鉴定及波谱数据
分离鉴定了10种化合物,在V(石油醚)∶V(乙酸乙酯) =85∶15 时得到化合物 1 (5 mg);在V(石油醚)∶V(乙酸乙酯)=70∶30 时得到化合物 2 (2 mg),在V(石油醚)∶V(乙酸乙酯)=60∶40 时得到化合物 3(3 mg),在V(石油醚)∶V(乙酸乙酯) =30∶70 得到化合物 4 (3.5 mg)和 5 (2.5 mg);在V(石油醚)∶V(乙酸乙酯)=75∶25)时得到化合物 6 (10 mg);在V(乙酸乙酯)∶V(甲醇)=90∶10 时分离得到化合物 7 (18 mg);在V(石油醚)∶V(乙酸乙酯) =65∶35 时得到化合物 8 和 9 的粗品,再经重结晶得到化合物 8 (12 mg)和 9 (4 mg);在V(石油醚)∶V(乙酸乙酯)=45∶55 时得到化合物 10 (7 mg)。
鉴定化合物 1~10分别为 gliomasolide A、Sch725674、gliomasolide C、clavatustide A、clavatustide B、20−羟基麦角甾−4,6,8(14),22−四烯−3−酮、黄嘌呤、麦角甾醇、过氧化麦角甾醇和丁二酸。其中化合物1~7的波谱数据如下。
化合物1:无色晶体[V(甲醇)∶V(三氯甲烷)=1∶1],熔点 89~91 ℃+30.5 (c0.15,MeOH),HRESIMS(m/z): 313.238 4 [M+H]+。1H NMR (600 MHz, CD3OD)δ6.82 (dd, 15.8, 7.8 Hz, 1H), 5.97 (dd,15.8, 1.0 Hz, 1H), 4.99 (m, 1H), 4.32 (ddd, 12.0, 7.8,5.0 Hz, 1H), 3.65 (m, 1H), 1.87 (m, 1H), 1.75 (m, 2H),1.63 (m, 1H), 1.57 (m, 1H), 1.50 (m, 1H), 1.32~1.43(m, 13H), 1.23 (m, 2H), 1.14 (m, 1H), 0.90 (t, 7.2 Hz,3H)。13C NMR (150 MHz, CD3COCD3)δ168.0,151.2, 123.3, 77.3, 72.7, 70.9, 36.1, 36.0, 34.3, 32.8,32.4, 31.3, 29.7, 26.4, 25.9, 24.9, 23.6, 14.3。
化合物5:黄色无定形固体。HRESIMS(m/z):458.172 8 [M+H]+。1H NMR (600 MHz, CDCl3)δ10.15 (s, 1H), 8.56(s, 1H), 8.50 (d, 8.4 Hz, 1H), 7.64(d, 7.8 Hz, 1H), 7.56 (d, 7.8 Hz, 1H), 7.44 (t, 7.8 Hz,1H), 7.41 (t, 7.8 Hz, 1H), 7.32~7.35(m, 5H), 7.31(m,1H), 7.20 (d, 7.8 Hz, 1H), 7.05 (s, 1H), 5.53 (t, 7.6 Hz,1H), 5.27 (d, 14.8 Hz, 1H), 3.42 (dd, 13.6, 7.6 Hz,1H), 3.27 (dd, 13.6, 7.6 Hz, 1H), 3.12 (d, 14.8 Hz,1H), 3.03 (s, 3H)。13C NMR (150 MHz, CDCl3)δ169.9, 167.6, 167.5, 167.4, 138.2, 135.6, 135.0, 132.8,132.4, 129.9, 129.8, 128.9, 127.5, 127.4, 126.7, 126.6,126.3, 123.4, 123.3, 122.1, 71.7, 54.4, 37.4, 35.9。
化合物6:黄色油状物。HRESIMS(m/z):409.309 7 [M+H]+。+115.6(c0.15, MeOH),1H NMR (600 MHz, CDCl3) 6.63 (d, 9.5 Hz, 1H), 6.05(d, 9.5 Hz, 1H), 5.75 (s, 1H), 5.58 (m, 1H), 5.57 (m,1H), 2.58 (m, 1H), 2.54 (m, 1H), 2.52 (m, 1H), 2.47(m, 1H), 2.23 (m, 1H), 2.02 (m, 1H), 1.96 (m, 1H),1.89 (m, 1H), 1.87 (m, 1H), 1.77 (m, 1H), 1.73 (m,1H), 1.64 (m, 1H), 1.61 (m, 1H), 1.53 (m, 1H), 1.49(m, 1H), 1.38 (m, 1H), 1.29 (s, 3H), 1.06 (s, 3H), 0.98(s, 3H), 0.96 (d, 6.8 Hz, 3H), 0.88 (d, 6.8 Hz, 3H),0.86 (d, 6.8 Hz, 3H)。13CNMR (150 MHz, CDCl3)δ199.7, 164.5, 155.6, 136.7, 133.9, 130.6, 124.8, 124.4,123.1, 74.8, 59.1, 44.4, 44.3, 42.7, 36.8, 36.1, 34.3,34.2, 33.2, 30.7, 18.9, 24.9, 22.5, 20.6, 20.2, 19.9, 16.8, 17.3。
化合物 7:白色粉末。HRESIMS(m/z): 153.041 6[M+H]+。1H NMR (600 MHz, DMSO-d6)δ13.32 (s,1H), 11.53 (s, 1H), 10.84 (s, 1H), 7.92 (s, 1H)。13C NMR (150 MHz, DMSO-d6)δ155.5, 151.4, 149.1,140.6, 106.6。
麦角甾醇(化合物8)、过氧化麦角甾醇(化合物9)和丁二酸(化合物10)为真菌中常见化合物,数据略。
2.3 化合物的结构鉴定
化合物113C NMRδ168.0表明存在1个酯羰基,δ151.2, 123.3 结合1H NMRδ6.82 (dd, 15.8, 7.8 Hz,1H), 5.97 (dd, 15.8, 1.0 Hz, 1H)的低场化学位移提示有 1 个和羰基共轭的双键,13C NMRδ77.3, 72.7,70.9 结合1H NMRδ4.99, 4.32, 3.65 的信号表明存在3个连氧的—CH基团,提示除了酯羰基外,可能有 2 个连—CH 的羟基。1H NMRδ0.90 (t, 7.0,3H)和中高场区重叠的质子信号及碳谱(δ36.3,32.9, 26.4, 23.7, 14.6)表明化合物的分子中存在链状结构单元。根据高分辨质谱313.238 4 [M+H]+的分子离子峰,结合碳谱、氢谱及以上分析推导出化合物的分子式为C18H32O4,除去羰基和双键的不饱和度,表明分子存在1个单环,说明化合物属于大环内酯结构类型。查阅文献[15]对照波谱数据、比旋光度等,化合物1鉴定为gliomasolide A,结构见图1。
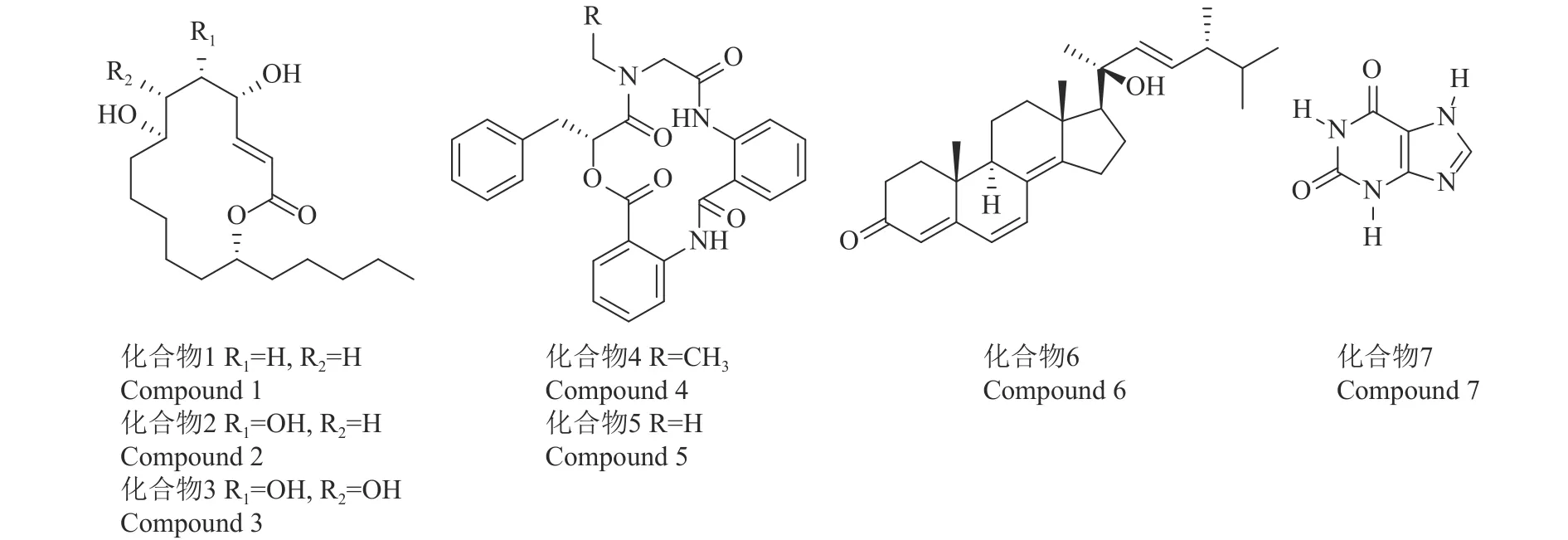
图1 化合物 1~7 的分子结构Fig. 1 Structures of compounds 1−7
化合物2的13C NMR和1H NMR和化合物1非常相似,表明其具有与化合物1相同的碳骨架。化合物 2 的13C NMRδ77.8, 76.1, 72.9, 69.6 结合1H NMRδ4.95, 4.49, 3.99, 3.85 表明其有 4 个连氧的—CH,比化合物1多了1个。而且化合物2的质谱显示其相对分子质量比化合物1多16,由此推测化合物2是化合物1取代了1个羟基的衍生物。查阅文献[16]对照波谱数据、比旋光度等,化合物2鉴定为Sch725674,结构见图1。
化合物31H NMR和13C NMR和化合物2相似,表明其也具有和化合物2类似的大环内酯骨架,两者区别在于化合物 3 有δ77.9, 77.4, 73.7, 71.2,71.3 5个连氧的—CH,比化合物2多1个,同时化合物3的质谱显示其相对分子质量比化合物2多16,由此推测化合物3在化合物2基础上多取代了1个羟基。查阅文献[15]对照波谱数据、比旋光度等数据,化合物3鉴定为gliomasolide C,结构见图1。
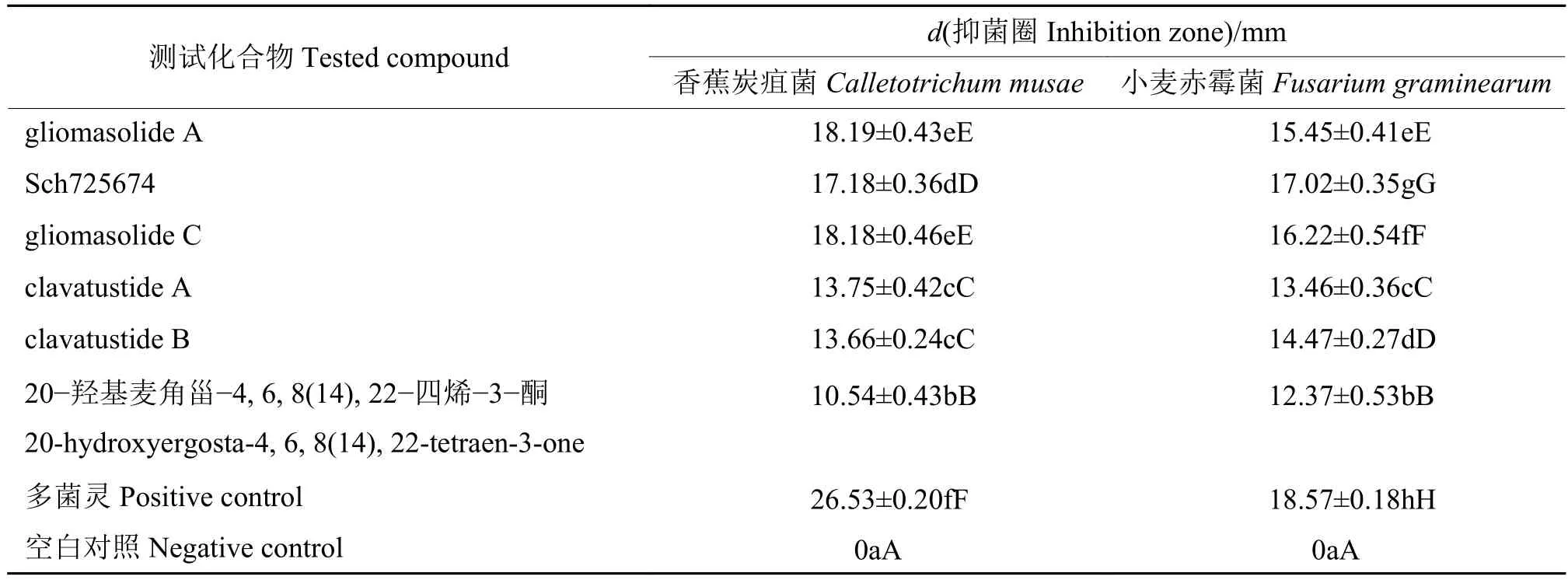
表1 化合物的抗植物病原菌活性1)Table 1 Antifungal activities of compounds against plant pathogens
化合物4 HRESIMS分子离子信号472.187 2[M + H]+可知其分子式 C27H25N3O5,不饱和度为17。13C NMRδ169.6, 167.9, 167.4, 167.4 显示 4 个碳基碳,16 个苯环区碳 (δ122.0~138.1)信号,同时1HNMR显示13个苯环区氢信号,结合耦合常数,表明其分子中存在1个单取代苯环和2个二取代苯环。扣除这些单元后剩余的不饱和度表明化合物4存在环状结构。进一步观察1H NMR发现δ10.22 (s, 1H), 8.05 (s, 1H)有 2 个 NH 信号,13C NMRδ43.4, 13.9 是典型的连接在酰胺氮上的乙基结构单元信号,结合δ71.7的1个连氧碳信号,推测化合物4为2个邻氨基苯甲酸、1个2−羟基苯丙酸以及1个N−乙基甘氨酸组成的环内酰胺类物质。在此基础上查阅文献[17]对照波谱数据、比旋光度等,化合物4鉴定为clavatustide A,分子结构见图1。
化合物513C NMR数据和化合物4十分类似,表明具有相同的环状碳架结构。化合物5的1H NMR和化合物 4 相比少了δ1.02 (t, 7.2 Hz, 3H)的三重峰甲基信号,多了δ3.03 (s, 3H)的氮甲基碳信号,同时化合物5的13C NMR比化合物4少了1个高场区的δ43附近的碳,质谱少了14,相当于CH2的质量单元。这些结果表明二者不同仅在于化合物4连接在酰胺氮上的乙基单元在化合物5中变成了甲基结构。查阅文献[17]对照波谱数据、比旋光度等,化合物5鉴定为clavatustide B,分子结构见图1。
化合物 61H NMR 和13C NMR 提示其属于甾醇类,1H NMRδ0.96 (d, 6.8 Hz, 3H), 0.88 (d, 6.8 Hz,3H), 0.86 (d, 6.8 Hz, 3H)是连在—CH 上的甲基,1.29 (s, 3H), 1.06 (s, 3H), 0.98 (s, 3H)是连在季碳上的甲基,1H NMRδ6.63 (d, 9.5 Hz, 1H), 6.05 (d, 9.5 Hz, 1H), 5.75 (s, 1H), 5.58 (m, 1H), 5.57 (m, 1H)及13C NMRδ164.5, 155.6, 136.7, 133.9, 130.6, 124.8,124.4, 123.1 说明有 4 个双键,13C NMRδ199.7 的信号表明化合物6存在1个α,β不饱和羰基,δ74.8的连氧碳信号(无对应的1H NMR信号)表明化合物6有1个连季碳的羟基。在此基础上查阅文献,波谱数据和比旋光度与文献[18]中的基本一致,化合物 6 鉴定为 20−羟基麦角甾−4, 6, 8(14), 22−四烯−3−酮,结构见图1。
化合物 71H NMR 显示δ13.32 (s, 1H), 11.53(s, 1H), 10.84 (s, 1H)3 个 NH 信号以及 7.92 (s,1H)的双键 CH 信号,结合13C NMRδ155.5, 151.4,149.1, 140.6, 106.6 的信号表明化合物 7 可能是嘌呤类化合物,查阅文献[19]并对照波谱数据等,化合物7鉴定为黄嘌呤。
麦角甾醇(化合物8)、过氧化麦角甾醇(化合物9)和丁二酸(化合物10)的结构通过与实验室标准品进行核磁共振波谱、薄层层析对照确定。
2.4 化合物对植物病原菌的抗菌活性
采用滤纸片扩散法测试了部分化合物对香蕉炭疽菌和小麦赤霉菌的活性。根据文献[12],抑菌圈直径为 [6, 11)、[11, 15)和 [15, 20) mm 分别表示对该菌株有轻度、中度和高度抗菌作用。由表1可知,在浓度为 250 μg/mL 时,gliomasolide A、Sch725674 和gliomasolide C对香蕉炭疽菌和小麦赤霉菌均显示了高度抗菌活性,且 Sch725674、gliomasolide C 对小麦赤霉菌的抗菌活性与多菌灵接近;clavatustide A, clavatustide B对香蕉炭疽菌和小麦赤霉菌显示中度抗菌作用,20−羟基麦角甾−4, 6, 8(14), 22−四烯−3−酮对小麦赤霉菌中度抗菌,对香蕉炭疽轻度抗菌。但化合物对2种植物病原真菌抗菌活性均弱于阳性对照多菌灵。
3 结论与讨论
从棒曲霉菌株XCE02的发酵液中共分离鉴定出 gliomasolide A、gliomasolide C、20−羟基麦角甾−4,6,8(14),22−四烯−3−酮等10种化合物,结构类型包括有大环内酯、环脂肽、生物碱、甾醇等。滤纸片扩散法抗菌活性测试结果表明,在浓度为250 μg/mL时,化合物 gliomasolide A、Sch725674 和 gliomasolide C对香蕉炭疽菌和小麦赤霉菌显示了高度抗菌活性,推测它们是菌株提取物显示对植物病原菌抗性的重要原因之一,可作为抗菌农药先导化合物开展深入研究。此外 clavatustide A、clavatustide B 和20−羟基麦角甾−4,6,8(14),22−四烯−3−酮也对香蕉炭疽菌和小麦赤霉菌显示了中度或轻度抗菌活性。据文献报道,gliomasolide A可以抑制人宫颈癌细胞的增殖[15],Sch725674对酿酒酵母Saccharomyces cerevisiae和白色念珠菌Candida albicans具有强抑制活性[16],clavatustide A 和 clavatustide B 具有抑制3种人肝癌细胞HepG2、SMMC-7721和Bel-7402增殖的活性[17]。但鲜见这些化合物对植物病原菌抗菌活性的研究报道,本研究结果丰富了昆虫天然共生真菌源抗菌农药先导化合物库。

