白蛋白乳液递送油脂的秀丽隐杆线虫营养评价模型的建立
杨金月,张 涛,常 明,刘睿杰,金青哲,王兴国
(江南大学 食品学院,食品科学与技术国家重点实验室,江苏 无锡 214122)
秀丽隐杆线虫(秀丽线虫)是小型土壤线虫,其脂肪颗粒主要存储于肠道及皮下细胞,身体透明便于脂滴的观察[1];秀丽隐杆线虫脂肪颗粒的标记方法简单,利用油红O和尼罗红等染料都可以使秀丽隐杆线虫脂肪着色[2]。此外,秀丽隐杆线虫脂肪酸的合成、降解代谢与人体高度相似,参与脂肪代谢关键步骤的限速酶与哺乳动物基本相同[3]。因此,秀丽隐杆线虫是理想的脂质代谢研究模型。
由于秀丽隐杆线虫水溶性的培养条件使得利用秀丽隐杆线虫评价非水溶性物质的功效受到限制。目前,利用秀丽隐杆线虫评价脂溶性物质的方法有助溶剂法(二甲基亚砜、乙醇)[4]、显微注射法[5]和包埋法[6]。由于食用油的疏水性,二甲基亚砜和乙醇的效果不佳。显微注射技术操作复杂,对秀丽隐杆线虫易造成损伤。包埋是一种常用的改善脂溶性成分的水相递送的方式,在食品、饮料、农业、化妆品和医药领域等应用广泛[7]。目前已有利用吐温作为乳化剂[6]喂食秀丽隐杆线虫甘三酯的报道。吐温是山梨酸醇脂肪酸酯类乳化剂,使用吐温作为乳化剂将脂肪酸引入秀丽隐杆线虫体内,乳化剂里的脂肪酸在秀丽隐杆线虫体内代谢,利用秀丽隐杆线虫评价包埋的甘三酯在体内的代谢时,很难与乳化剂里的脂肪酸对脂质代谢的影响区分开。
白蛋白是一种具有生物亲和性的大分子乳化剂,是血浆中含量最丰富的蛋白质,具有高溶解度和稳定性,其纯度高、成本低,在乳液传递系统中应用广泛。白蛋白乳液作为药物的载体可以有效地提高药物的疗效并降低毒副作用,增加药物溶解度,显著提高生物利用度[8]。Tang等[9]研究表明,白蛋白具有良好的乳化性能,其乳化能力优于大豆蛋白、酪蛋白、卵清蛋白和β-乳球蛋白。
因此,本实验利用白蛋白作为乳化剂,建立秀丽隐杆线虫油脂评价模型。通过荧光标记和线虫脂肪酸组成分析验证蛋白乳液是否将甘三酯导入秀丽隐杆线虫。研究乳液粒径和油脂浓度对秀丽隐杆线虫摄入的影响。通过秀丽隐杆线虫油脂评价模型的建立,为食用油脂的营养评价提供参考。
1 材料与方法
1.1 实验材料
野生型秀丽隐杆线虫和大肠杆菌OP50由江苏大学赠送。白蛋白,化学纯,北京索莱宝科技有限公司;中碳链甘三酯(MCT),上海佑创实业有限公司;共轭亚油酸甘三酯(CLA-TG),购自当地超市;尼罗红、油红O、荧光素异硫氰酸酯(FITC),美国Sigma公司;正己烷,色谱纯,上海国药集团;甲醇、硫酸、氢氧化钾、三亚油酸甘油酯(LA-TG)等,均为分析纯;甘油三酯(TG)检测试剂盒,南京建成有限责任公司;BCA蛋白浓度测试试剂盒,上海碧云天生物技术有限公司。
Ultra-Turrax T25高速分散机,德国艾卡仪器设备有限公司;GEA Niro高压均质机,意大利GEA Niro Soavi公司;Axio Vert A1倒置荧光显微镜,德国卡尔蔡司公司;Zetasizer Nano-ZS90粒度分析仪,英国马尔文仪器有限公司;M5酶标仪,美国Molecular Devices公司;ZHJH-112B超净工作台;LDZX-50KB立式压力蒸汽灭菌器;EL204电子分析天平;TDL-50C低速台式离心机;GC-14 B气相色谱仪,配备火焰离子化检测器(FID),日本Shimadzu公司。
1.2 实验方法
1.2.1 秀丽隐杆线虫的培养
秀丽隐杆线虫的培养方法参照文献[10]。秀丽隐杆线虫采用液态培养基,为防止大肠杆菌摄入乳液对实验产生影响,在实验过程中大肠杆菌OP50均在60℃放置1 h杀死。喂食乳液前秀丽隐杆线虫经过次氯酸钠和氢氧化钠同期化处理,使得秀丽隐杆线虫处于同一生长周期。
1.2.2 乳液的制备
乳液制备方法在Lu等[11]方法基础上稍加修改。以白蛋白为乳化剂,配制质量分数为1%的蛋白质溶液,搅拌2 h,4℃放置过夜使其充分水化。蛋白质溶液和MCT混合(MCT含量10%),20 000 r/min高速剪切2 min,制得粗乳液,高压均质制得乳液,均质压力10~90 MPa,均质1~3次。新鲜乳液的平均粒径和粒径分布采用Zetasizer Nano-ZS90粒度分析仪进行测定,并以蒸馏水溶液作为分散介质稀释1 000倍,设置参数颗粒折射率为1.456,连续相的折射率为1.330。
1.2.3 显微镜观察
乳液中蛋白和油相的染色方法分别参照Yin[12]、Colmenares[6]等的方法,使用FITC标记白蛋白,尼罗红标记MCT。秀丽隐杆线虫的油红O染色参照Ashrafi等[13]的方法。
1.2.4 秀丽隐杆线虫喂食乳液
同期化秀丽隐杆线虫转移至液态培养基中,每毫升培养基中含有100条秀丽隐杆线虫,加入杀死的大肠杆菌OP50,加入不同粒径(200、300、400 nm)和不同MCT浓度(0.01、0.1、1、10 mmol/L)的乳液,20℃培养50 h。
1.2.5 秀丽隐杆线虫脂肪酸组成测定
秀丽隐杆线虫脂肪酸组成的测定方法参照Watts等[14]的方法并稍作修改。用去离子水将秀丽隐杆线虫冲洗3遍,离心弃上清。将秀丽隐杆线虫移至具塞玻璃离心管中,加入1 mL 2.5%硫酸甲醇,80℃水浴振荡1 h。加入200 μL正己烷和1 mL超纯水,5 000 r/min离心1 min,取上层用GC进行分析。
气相色谱条件:氮气为载气,流速1.0 mL/min,进样口温度250℃,分流比1∶20,进样量1.0 μL,升温程序为60℃保持3 min,5℃/min升至170℃,保持15 min,2℃/min升至220℃,保持10 min。以峰面积占比定量,保留时间定性。
1.2.6 秀丽隐杆线虫甘三酯消化吸收的测定
按照1.2.2方法制备CLA-TG和LA-TG蛋白乳液,乳液平均粒径为(200±20)nm。按照1.2.4方法将乳液喂食给秀丽隐杆线虫。采用甘油三酯试剂盒测定秀丽隐杆线虫甘三酯含量,用蛋白质定量,蛋白浓度测定采用BCA蛋白浓度测定试剂盒。
1.2.7 结果统计与分析
所有实验至少重复3次,数据均以“平均值±标准偏差”表示,采用SPSS 22软件进行数据统计分析,组间差异采用One-Way ANOVA方差分析。P<0.05,差异具有显著性;P<0.01,差异具有极显著性。数据绘图采用Origin 8.0软件。
2 结果与讨论
2.1 乳液的特征
按1.2.2方法制备乳液,研究均质压力和均质次数对平均粒径的影响,结果如图1所示。

图1 均质压力和均质次数对平均粒径的影响
由图1可知,均质1次时,均质压力从10 MPa增加到90 MPa,平均粒径逐渐减小。均质压力为10 MPa时,均质1、2、3次的平均粒径分别为(458.93±10.18)、(345.34±10.18)、(280.50±12.88)nm。均质压力为90 MPa时,均质1、2、3次的平均粒径分别为(165.56±11.17)、(150.88±9.01)、(148.81±10.23)nm。当均质压力小于70 MPa时,随均质次数的增加平均粒径减小;当均质压力大于70 MPa时,均质次数对平均粒径的影响不大。这种变化可能是因为当均质压力大于70 MPa,乳液在均质1次时已达到较小粒径,再次提供能量使得乳液平衡发生改变,过小粒径的乳液会再次发生聚集,达到粒径平衡状态,所以再次均质时乳液粒径不会继续减小。在本实验条件下,所能制得的乳液最小粒径为(148.81±10.23)nm。考虑到过小颗粒可能产生的纳米毒性[15]和大颗粒乳液稳定性差[11]等因素,本实验研究不同乳液粒径对其摄入的影响时选择平均粒径为(200±20)、(300±20)、(400±20)nm的3种乳液,粒径分散系数小于0.2。图2为3种乳液粒径分布图。
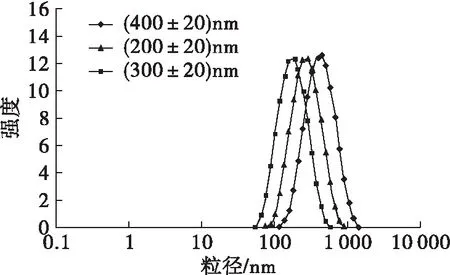
图2 3种乳液粒径分布图
从图2可以看出,3种乳液粒径分布均符合正态分布,分布均匀。
2.2 乳液摄入显微镜观察(见图3)

图3 乳液荧光染色图片(a)和秀丽隐杆线虫喂食染色乳液的荧光图片(b)
从图3可以看出,白蛋白制备的乳液为单层结构,外层的白蛋白(蛋白被FITC染成绿色)和内部的MCT(MCT被尼罗红染成红色),将FITC和尼罗红荧光染色的乳液喂食秀丽隐杆线虫,发现秀丽隐杆线虫具有绿色和红色荧光,说明秀丽隐杆线虫成功摄入蛋白乳液。秀丽隐杆线虫全身呈现红色荧光,而只有肠腔呈现绿色荧光,分析原因可能是由于尼罗红作为脂溶性染料具有很强的标记能力,在喂食荧光标记的乳液过程中乳液中的尼罗红将秀丽隐杆线虫本身的脂质标记,使得秀丽隐杆线虫通体呈现红色荧光,而FITC只标记乳液中的蛋白,乳液被秀丽隐杆线虫摄食后进入肠腔,因此在肠腔观察到绿色荧光。
2.3 影响乳液摄入的因素
粒径和甘三酯浓度是影响乳液摄入率的两大因素,实验选择MCT作为油相研究了秀丽隐杆线虫摄入不同粒径和不同MCT浓度的乳液后的脂肪酸组成,结果如表1所示。
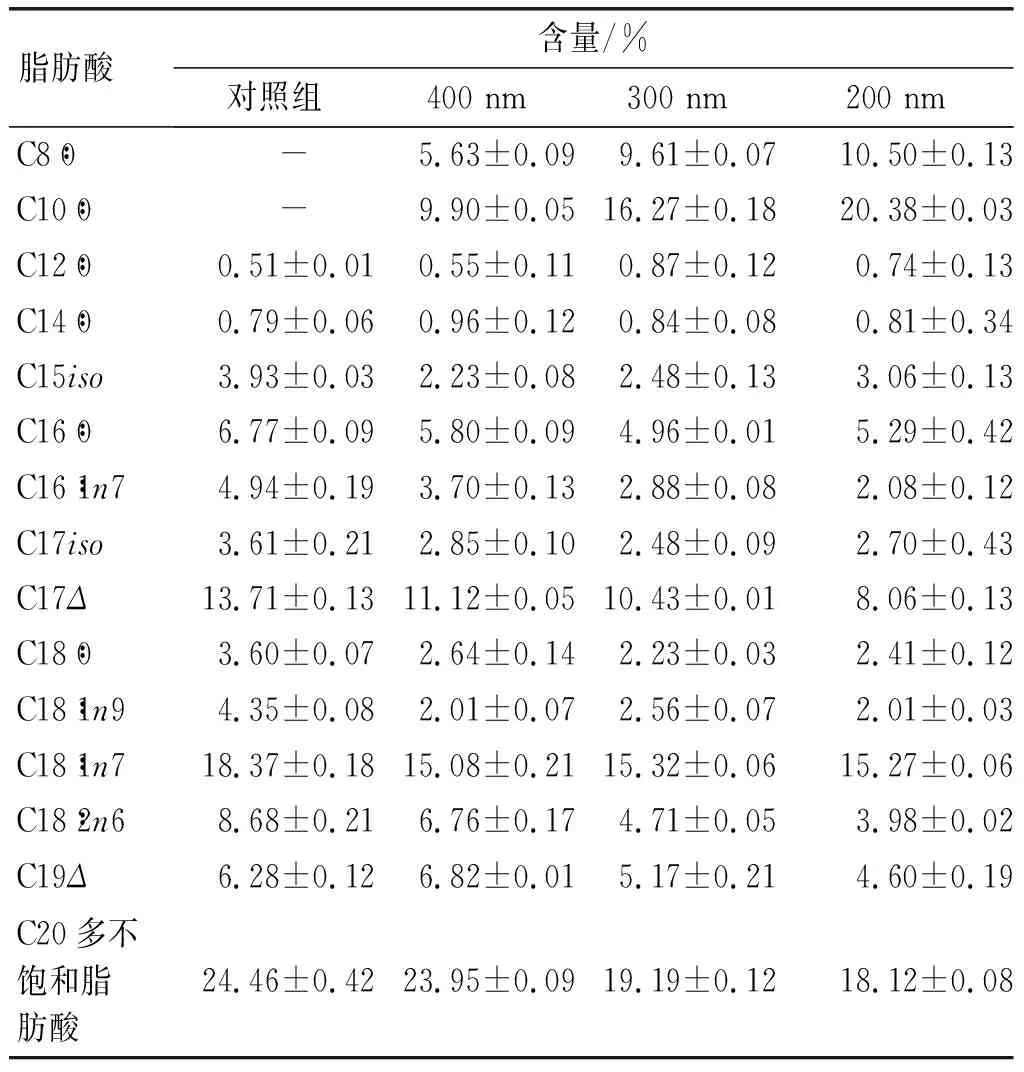
表1 喂食不同粒径乳液秀丽线虫脂肪酸组成及含量
注:乳液中MCT浓度为1 mmol/L。
从表1可以看出,秀丽隐杆线虫体内出现原来不存在的辛酸(C8∶0)和癸酸(C10∶0),证明秀丽隐杆线虫可以摄入乳液中的MCT。摄入400、300、200 nm粒径的MCT乳液秀丽隐杆线虫体内积累的辛酸(C8∶0)含量分别为5.63%、9.61%、10.9%,癸酸(C10∶0)含量分别为9.90%、16.27%、20.38%。数据显示在实验粒径条件下秀丽隐杆线虫均能摄入乳液,粒径越小越有利于秀丽隐杆线虫摄入。Colmenares等[6]研究发现使用吐温型水包油乳液来传递亲脂性化合物,秀丽隐杆线虫可以摄取40~500 nm的乳液,特别是300~500 nm的大粒径乳液。这与本实验结果不一致。分析原因,可能是由于实验中不同的培养环境。Colmenares等[6]使用固体琼脂培养皿,小粒径乳液可能渗入琼脂内部,而秀丽隐杆线虫更容易摄入琼脂表面的大乳液,采用液态培养基时,小颗粒乳液更易随液态培养基被秀丽隐杆线虫摄入。
选用吸收最好的200 nm粒径组为实验组研究MCT浓度对秀丽隐杆线虫摄入的影响,结果如表2所示。
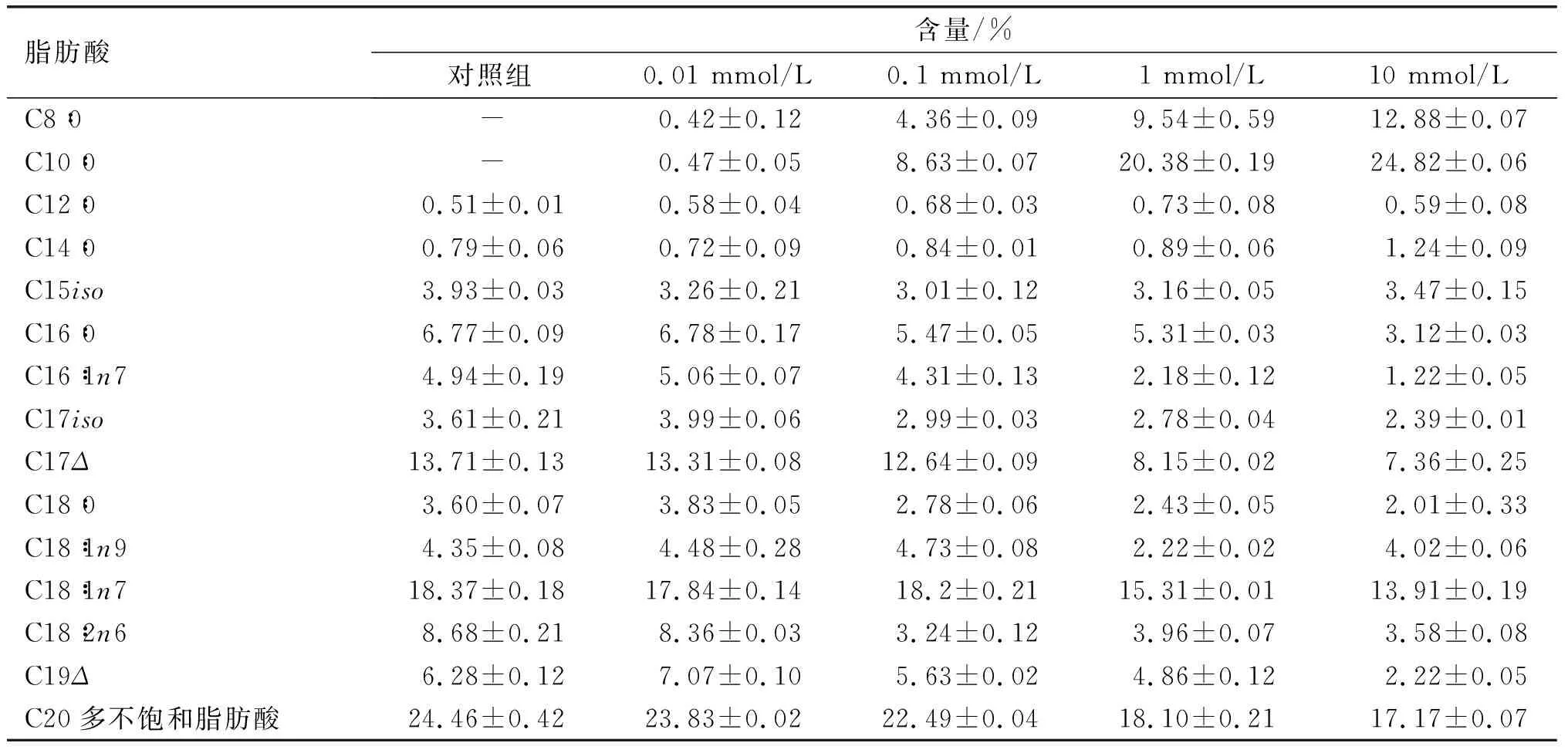
表2 MCT浓度对秀丽隐杆线虫脂肪酸组成的影响
由表2可以看出,粒径为200 nm时,摄入浓度分别为0.01、0.1、1、10 mmol/L MCT乳液的秀丽隐杆线虫体内积累的辛酸(C8∶0)含量分别为0.42%、4.36%、9.50%、12.88%,癸酸(C10∶0)含量分别为0.47%、8.63%、20.38%、24.82%。因此,在0.01~10 mmol/L范围内秀丽隐杆线虫均能摄入乳液,随着MCT浓度增加秀丽隐杆线虫摄入乳液的量增加。
2.4 乳液的消化吸收
脂肪酸分析和荧光标记说明秀丽隐杆线虫可以摄入乳液中的MCT,但是否能消化利用MCT需要进一步验证。已有研究报道CLA-TG具有降低秀丽隐杆线虫体脂的生物活性,LA-TG虽然结构和CLA-TG相似却不具有该功效[16]。为进一步证实秀丽隐杆线虫可以生物利用乳液中的MCT,检测喂食CLA-TG乳液后秀丽隐杆线虫的TG含量,以喂食LA-TG乳液作为对照组,结果如图4所示。
由图4可知,当浓度为0.1 mmol/L时,CLA-TG组秀丽隐杆线虫的TG含量((0.116±0.001 41)mmol/mg)显著低于LA-TG组((0.174±0.006 57)mmol/mg)(P<0.05)。说明该浓度下CLA-TG被秀丽隐杆线虫利用,从而降低秀丽隐杆线虫体脂。当浓度为0.01 mmol/L和1 mmol/L时,LA-TG组和CLA-TG组线虫TG含量无显著变化。分析可能原因,当TG浓度为0.01 mmol/L时,秀丽隐杆线虫摄入CLA-TG未达到发挥生理功效的有效剂量;当TG浓度为1 mmol/L时,秀丽隐杆线虫摄入CLA-TG过多,大量CLA-TG在秀丽隐杆线虫体内积累造成TG增加。本实验表明,TG在秀丽隐杆线虫体内发挥功效是与其浓度相关的。后续使用秀丽隐杆线虫评价油脂营养时,选择合适的TG浓度至关重要。
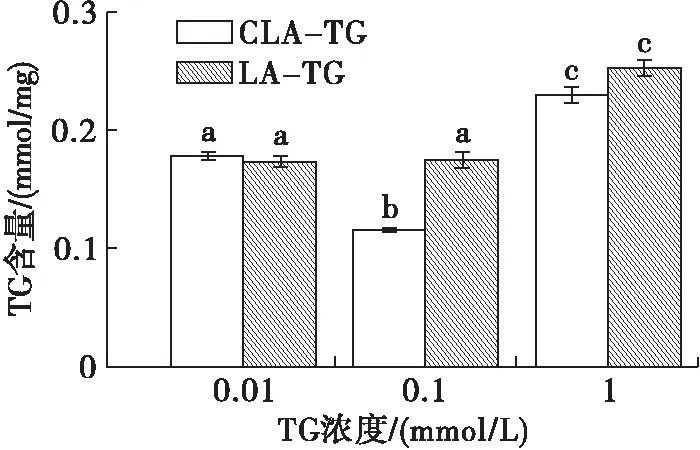
图4 秀丽隐杆线虫喂食CLA-TG和LA-TG乳液后TG含量变化
3 结 论
本实验建立利用白蛋白乳液喂食秀丽隐杆线虫甘三酯的方法。采用高压均质的方法制备平均粒径200~400 nm的蛋白乳液。通过脂肪酸分析和荧光标记观察验证秀丽隐杆线虫可以摄入乳液。当乳液的平均粒径在200~400 nm范围时,粒径越小越有利于秀丽隐杆线虫摄入油脂;当培养基中MCT浓度在0.01~10 mmol/L范围时,浓度越高越有利于秀丽隐杆线虫摄入油脂。此外,本文还利用共轭亚油酸甘油三酯进行了方法验证,结果显示乳液递送的共轭亚油酸甘油三酯被秀丽隐杆线虫成功代谢,减少了体内脂肪的积累,证实了乳液中的甘三酯可以被消化吸收。白蛋白乳液传递系统操作简单,白蛋白作为乳化剂稳定、生物亲和性好。本实验为利用秀丽隐杆线虫研究甘三酯及伴随物等非水溶性物质提供方法,拓宽了秀丽隐杆线虫作为体外模型的应用。

