甲磺酸帕珠沙星与单磷酸阿糖腺苷配伍稳定性研究
巩佳威,曲晓宇,金 芳,宋燕青
(吉林大学第一医院,吉林 长春 130000)
甲磺酸帕珠沙星为新一代喹诺酮类抗菌药物,安全性较高,体内、体外试验表明,对革兰阳性菌尤其是厌氧菌的抗菌活性明显增强,且抗菌时间长[1-2]。单磷酸阿糖腺苷主要用于治疗疱疹病毒和肝炎病毒感染所致皮炎、口炎、脑炎和巨细胞病毒感染等疾病[3-6]。为安全、有效、合理联合配伍,本研究中对甲磺酸帕珠沙星与单磷酸阿糖腺苷进行了配伍稳定性考察,为甲磺酸帕珠沙星的临床合理使用提供参考。现报道如下。
1 仪器与方法
1.1 仪器
Agilent Technologies 1220 Infinity 型高效液相色谱仪(美国安捷伦公司);FE20 型pH 计(梅特勒-托利多仪器有限公司);FA2004 型电子分析天平(上海舜宁恒平有限公司)。
1.2 试药
甲磺酸帕珠沙星对照品(批号为130460-2000701,纯度>99%),单磷酸阿糖腺苷对照品(批号为140710-200401,纯度>99%),均由中国食品药品检定研究院提供;甲磺酸帕珠沙星氯化钠注射液(重庆莱美药业股份有限公司,批号为S181041,规格为每支100 mL ∶帕珠沙星0.3 g 与氯化钠0.9 g),注射用单磷酸阿糖腺苷(开封明仁药业有限公司,批号为2018010301,规格为每支0.1 g);0.9%氯化钠注射液(中国大冢制药有限公司,批号为8L95D3,规格为每瓶100 mL)。
2 方法与结果
2.1 配伍溶液配制
模拟临床用药浓度,在25 ℃常温、25 ℃避光和4 ℃冷藏条件下,将注射用单磷酸阿糖腺苷1 g 溶解到0.9%氯化钠注射液100 mL 中,与100 mL 甲磺酸帕珠沙星氯化钠注射液进行混合,摇匀,作为配伍溶液。
2.2 外观及pH 变化
将上述配伍溶液置清洁透明的具塞纳氏比色管中,在25 ℃常温、25 ℃避光和4 ℃冷藏条件下,于配伍后0,1,2,6 h 时分别检查外观变化。以甲磺酸帕珠沙星(A)与配置的单磷酸阿糖腺苷和0.9%氯化钠注射液(B)为空白对照,观察并记录混合后的溶液(C)是否有颜色与沉淀变化,(-)表示无明显变化,(+)表示颜色变化或产生沉淀,(+)的数量表示颜色变化与沉淀的加深程度。结果见表1。2 种药物配伍后在25 ℃常温、25 ℃避光、4 ℃冷藏条件下0 ~6 h 均出现白色混浊,随时间的增加,逐渐产生沉淀并持续增加。

表1 甲磺酸帕珠沙星与单磷酸阿糖腺苷配伍放置不同时间的外观变化(n=5)
同时,采用pH 检测仪测定0,2,4,6 h 的pH 是否发生变化,结果见表2。可见,两药混合后在25 ℃常温、25 ℃避光、4 ℃冷藏条件下,pH 明显得到中和,0 ~6 h内未发生明显变化。
表2 甲磺酸酸帕珠沙星与单磷酸阿糖腺苷配伍放置不同时间后pH 变化(± s,n=5)
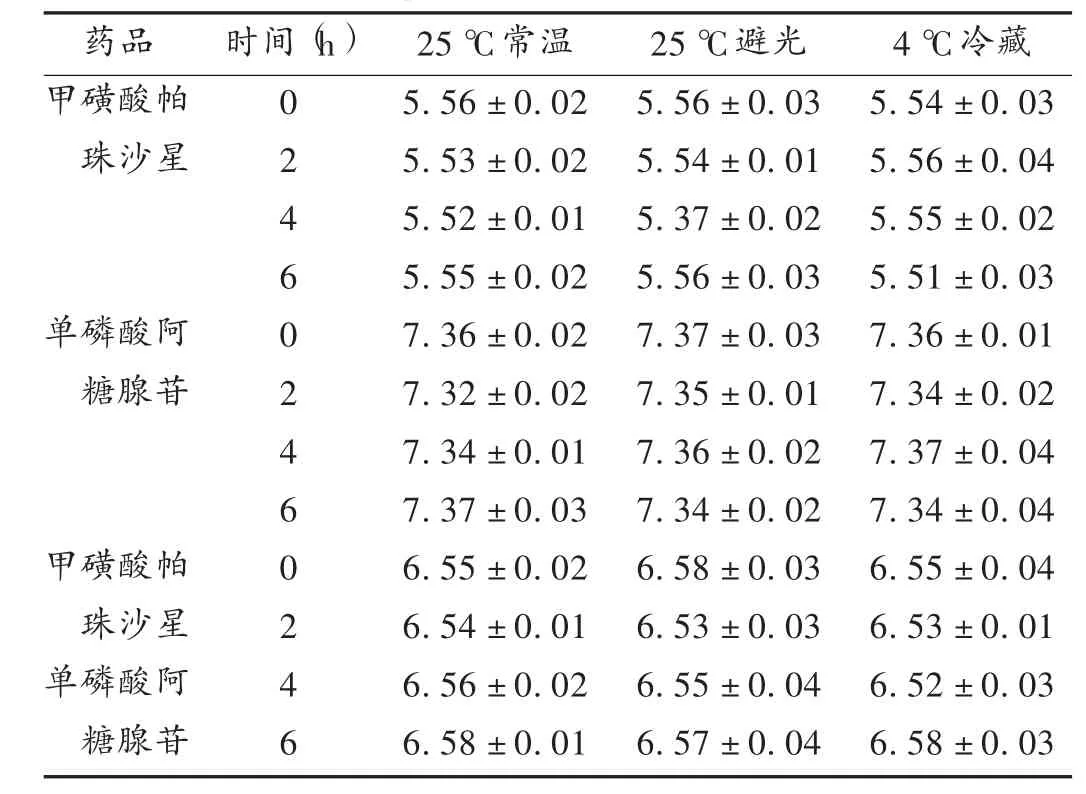
表2 甲磺酸酸帕珠沙星与单磷酸阿糖腺苷配伍放置不同时间后pH 变化(± s,n=5)
药品甲磺酸帕珠沙星时间(h)单磷酸阿糖腺苷甲磺酸帕珠沙星单磷酸阿糖腺苷0 2 4 6 0 2 4 6 0 2 4 6 25 ℃常温5.56 ±0.02 5.53 ±0.02 5.52 ±0.01 5.55 ±0.02 7.36 ±0.02 7.32 ±0.02 7.34 ±0.01 7.37 ±0.03 6.55 ±0.02 6.54 ±0.01 6.56 ±0.02 6.58 ±0.01 25 ℃避光5.56±0.03 5.54±0.01 5.37±0.02 5.56±0.03 7.37±0.03 7.35±0.01 7.36±0.02 7.34±0.02 6.58±0.03 6.53±0.03 6.55±0.04 6.57±0.04 4 ℃冷藏5.54 ±0.03 5.56 ±0.04 5.55 ±0.02 5.51 ±0.03 7.36 ±0.01 7.34 ±0.02 7.37 ±0.04 7.34 ±0.04 6.55 ±0.04 6.53 ±0.01 6.52 ±0.03 6.58 ±0.03
2.3 含量测定
2.3.1 色谱条件与系统适用性试验
色谱柱:20RBAXSB-C18柱(250mm×4.6mm,5μm);流动相:甲磺酸帕珠沙星采用甲醇-0.1%磷酸(25 ∶75,V/ V),单磷酸阿糖腺苷采用甲醇-0.1%磷酸(2 ∶98,V/ V);流速:1.000 mL/min;柱温:35 ℃;检测波长:甲磺酸帕珠沙星为243 nm,单磷酸阿糖腺苷为258 nm;进样量:10 μL。在此色谱条件下,两者峰形均良好,选择性高。详见图1。

图1 高效液相色谱图
2.3.2 溶液制备
取30 mg 甲磺酸帕珠沙星对照品,精密称定,置25 mL容量瓶中,加水溶解至刻度,摇匀,作为甲磺酸帕珠沙星对照品溶液。取单磷酸阿糖腺苷对照品100 mg,精密称定,置25 mL 容量瓶中,加水溶解至刻度,摇匀,作为单磷酸阿糖腺苷对照品溶液。供试品溶液用针头过滤器滤过后,精密量取1 mL,置10 mL 容量瓶中,加流动相稀释至刻度,摇匀,即得供试品溶液。
2.3.3 方法学考察
线性关系考察:将甲磺酸帕珠沙星对照品溶液分别稀释至0.6,0.9,1.2,1.5,2.0 mg/mL,得甲磺酸帕珠沙星梯度质量浓度对照品溶液。同法制得单磷酸阿糖腺苷0.4,0.8,2.4,3.5,4.0 mg/mL 对照品溶液,考察线性关系,得回归方程,Y甲=225.25X+81.876,r=0.999(n=5);Y单=555.29X+91.169,r=0.999(n=5)。结果表明,甲磺酸帕珠沙星和单磷酸阿糖腺苷进样质量浓度分别在600 ~1 200 μg/mL 和400 ~4 000 μg/mL 范围内与峰面积线性关系良好。
精密度试验:取2.3.2 项下的甲磺酸帕珠沙星对照品和单磷酸阿糖腺苷对照品溶液各2 mL,连续进样6 次。结果甲磺酸帕珠沙星的RSD为0.63%(n=6),单磷酸阿糖腺苷的RSD为0.89%(n=6),表明仪器精密度良好。
重复性试验:取标准曲线项下中间浓度溶液,采用2.3.1 项下色谱条件进样试验,重复6 次,记录峰面积。结果的RSD<2%,表明该方法重复性良好。
加样回收试验:取已知质量浓度的甲磺酸帕珠沙星,加入甲磺酸帕珠沙星对照品,分别制备含有甲磺酸帕珠沙星600 μg/mL 的溶液和含有注射用单磷酸阿糖腺苷1 000 μg/mL 的溶液各3 份。采用2.3.1 项下色谱条件进样试验,记录峰面积,采用外标法计算回收率。结果甲磺酸帕珠沙星、单磷酸阿糖腺苷的回收率分别为(99.40±0.34)% 和(99.82±0.40)% ,RSD分 别 为0.54%和0.41%(n=3)。
定限量和检测限确定:取甲磺酸帕珠沙星对照品和单磷酸阿糖腺苷对照品适量,采用流动相连续稀释,配置成一定浓度的待测样品,进行信噪比(S/N)为3 ∶1和10 ∶1 的检测限和定量限测定。结果见表3。
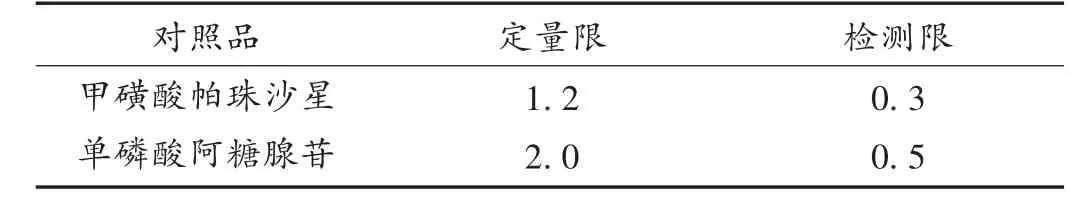
表3 样品定限量和检测限试验测定结果(ng)
2.4 配伍输液稳定性考察
按2.3.1 项下色谱条件,根据待测药品输液袋中在25 ℃常温、25 ℃避光、4 ℃冷藏条件下于0,2,4,6 h 时取出适量待测定的甲磺酸帕珠沙星(A)与单磷酸阿糖腺苷(B),配伍后测定上清液中的甲磺酸帕珠沙星(A1)与单磷酸阿糖腺苷(B1)的含量,以外标法计算浓度,并以0 h 时浓度为100%计算药物相对含量。结果见表4。可见,在25 ℃常温、25 ℃避光、4 ℃冷藏条件下单磷酸阿糖腺苷含量基本无变化,而甲磺酸帕珠沙星0 h 即发生含量下降,分别为71%,64%,61%,并随时间的延长含量持续下降。

表4 甲磺酸帕珠沙星和单磷酸阿糖腺苷配伍含量变化(X±s,n=5)
3 讨论
甲磺酸帕珠沙星化学结构中存在羟酸结构,具有酸的性质,与碱性药物混合时会因pH 的改变发生化学反应,析出结晶,同时甲磺酸帕珠沙星的酮式和喹啉式构型在不同酸度时可能发生互变[7]。此外,甲磺酸帕珠沙星需要避光保存,不宜与强还原性药物配伍,如维生素C[8]。如甲磺酸帕珠沙星配伍强酸强碱类药物或还原性药物易发生配伍禁忌,临床应增强风险意识。
静脉输液放置时间延长,序贯滴注等问题也是临床使用注射剂普遍存在的问题[9-10]。因每种药物的渗透性、pH、理化性质都不同,如发生配伍禁忌进入血液循环会造成安全隐患。甲磺酸帕珠沙星与单磷酸阿糖腺苷在配伍0 h 出现白色混浊,并随时间的延长,应严禁使用同一注射器进行配置,或使用同一通路进行输注。此外,本研究中只考察在25 ℃常温、25 ℃避光、4 ℃冷藏条件下,放置时间至6 h,因为6 h 时甲磺酸帕珠沙星的含量不足20%,足以表明两药存在配伍禁忌。应提示临床医师与药师,增强风险意识,合理慎重用药,临床联合使用2 种药物时不能共同配伍或使用同一“Y”型管进行输注,避免续贯滴入。联合用药时建议可分时间间隔或用0.9%氯化钠注射液进行冲管,以保证临床配伍安全和临床安全用药。

