异养小球藻的热酸解提油废水回用
毕生雷,王林风,赵明星,刘钺,乔建援,郑彬
1(河南天冠企业集团有限公司,车用生物燃料技术国家重点实验室,河南 南阳,473000) 2(江南大学 环境与土木工程学院,江苏 无锡,214122)
生物柴油是一种清洁能源,可以通过油料作物种植、微生物发酵、地沟油回收利用等方式获得[1]。油料作物种植占地面积广、生长周期长,而地沟油价格昂贵、回收困难,尚不能完全满足生物柴油生产的需要[2]。利用小球藻、圆红冬孢酵母等高含油微生物生产生物柴油已成为重要的研究领域。异养小球藻(Heterotrophicchlorella)不仅可以用来产油脂,也可以用来生产藻粉、饵料、叶黄素、藻蛋白、小球藻生长因子等高附加值产物而备受重视[3-4]。
根据废水生成和组分特点,小球藻生产过程产生的废水可以分为两大类。一是对小球藻发酵液直接进行固液分离后得到发酵上清液;二是对小球藻进行产品提取后得到提取废液(可以对发酵液直接进行提取,也可以对离心后得到的藻泥进行提取),包括叶黄素提取废液、藻蛋白提取废液、提油废水等。发酵上清液中的成分较为复杂,来源多样化,主要包括剩余的营养盐、藻细胞自身代谢产生的有机酸与碱液中和形成的有机酸盐、细胞自溶产生的细胞碎片、藻油等[5]。尽管发酵上清液中的成分种类较多,但是研究表明,发酵上清液具有较好的回用潜力。例如,韩士群等研究表明,异养小球藻细胞在自溶时会释放出对细胞生长有促进作用的小球藻生长因子[6]。吴娟等发现,使用异养小球藻发酵液上清液替代30%的配料用水能够提高异养小球藻生物量[7]。与发酵上清液相比,小球藻提取废液随下游产品不同而性质差异显著。本文主要关注热酸解提油废水回用的可行性。
热酸解法是成本、能耗较低的异养小球藻油脂的提取方法。提取时,需要直接向发酵液中加入小球藻干重1/7的浓H2SO4,然后经热酸解、萃取、相分离、离心等操作分别得到热酸解提油废水和藻油(图1)。通常情况下,热酸解提油废水占发酵液体积的90%左右,且pH为1.0左右,还含有油、酸、盐、醇等复杂成分的多相体系,处理难度极大[8-9]。目前异养小球藻下游提取废水的处理方法主要包括膜分离法、絮凝法、吸附法等物理化学方法,以及活性污泥法、生物膜法等生物方法。这些方法在实际应用时存在着成本高、能耗大等局限性,往往需要多种方法结合起来使用才能使出水水质达到排放要求[8]。本文将对异养小球藻热酸解提油废水回用工艺进行初步探讨,以达到削减下游污水处理量、降低污水处理成本的目的。
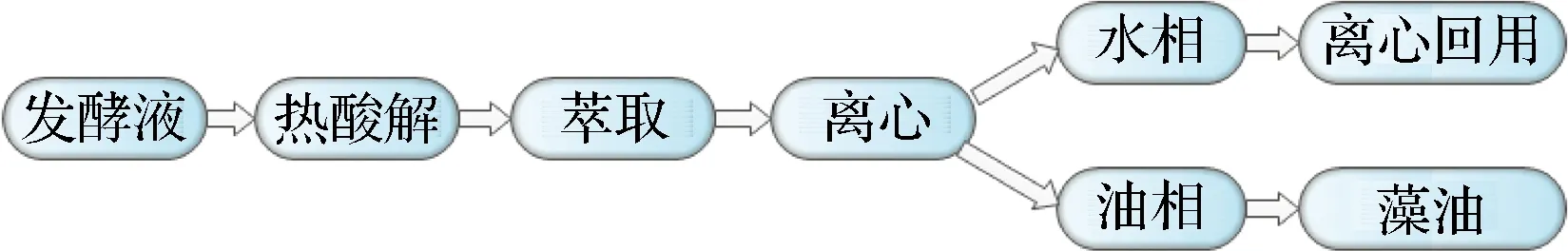
图1 热酸解法提油废水制备流程Fig.1 Preparation process of oil extraction wastewater by heating acidolysis
1 材料与方法
1.1 实验材料与设备
异养小球藻藻种,清华大学生命科学院提供。异养小球藻热酸解法提油废水,车用生物燃料技术国家重点实验室提供。实验所用化学试剂均为分析纯,国药集团。
SPX-150A/B型生化培养箱,杭州绿博;ZWY-111B型恒温震荡培养器,上海智城;XSP-9CA型显微镜,上海光学仪器。
1.2 实验方法
1.2.1 热酸解提油废水的获得
异养小球藻发酵液经热酸解、萃取、离心,从而获得水相(图1)[10]。水相体积约为热酸解液体积的90%,水相中含有未利用完全的培养基成分、小球藻代谢产物、H2SO4、部分萃取剂残留(乙醇、正已烷)等。水相再次离心后,取上清液,调节pH至7.0后备用。
1.2.2 摇瓶种子培养条件
平板挑一环藻细胞接入摇瓶,200 r/min,28 ℃培养7 d,种子培养合格时种子液中应无菌、干重达到10 g/L以上[1,11]。
1.2.3 摇瓶培养方法
1.2.3.1 摇瓶发酵控制条件
初始pH 6.5,摇床转速200 r/min,摇床温度28 ℃,接种体积分数为10%。
1.2.3.2 配料用水
对照组配料用水全部为自来水,实验组配料水为自来水加不同比例的热酸解提油废水,提油废水的添加体积分数分别为5%、10%、15%、20%、30%、40%、60%。
1.2.4 发酵培养基
发酵培养基配方为(g/L):葡萄糖30、酵母粉3、K2HPO4·3H2O 0.075、MgSO4·7H2O 0.075、CaCl2·2H2O 0.025、KH2PO40.175,其他微量营养盐若干[1,11]。
1.2.5 分析方法[1,11]
葡萄糖含量采用HPLC法测定;细胞数采用血球板计数;干重测定方法:取10 mL发酵液,离心后弃上清液,加蒸馏水至10 mL洗涤,再次离心弃上清液,反复操作2次,100 ℃烘干藻泥,然后计算干重。
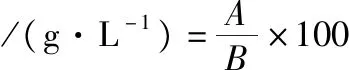
(1)
式中:A,发酵液烘干后质量,g;B,发酵液体积,L。
1.2.6 数据分析方法
使用origin75绘图并分析。
2 结果与讨论
热酸解提油废水中既含有小球藻生长因子,又含有可能对小球藻生长产生抑制的物质,如残留的萃取剂、各种盐、油脂等。本文分别通过检测藻细胞干重、发酵液中葡萄糖含量等指标来考察提油废水回用对异养小球藻发酵的影响。
2.1 热酸解提油废水回用对异养小球藻干重的影响
生物量是某一时刻单位空间内特定微生物的个体数或质量,能够反映微生物的生长程度。干重是生物量检测方法中较为直观、结果较为稳定的一个。排除杂质的影响,异养小球藻的干重主要受到细胞数量、细胞内蛋白和油脂含量的影响。
如图2所示,随着发酵时间的推移,各实验组干重均比发酵初期有不同程度的增加。当热酸解提油废水的回用比例为5%、10%、15%时,相同发酵时间内实验组干重增加幅度均高于对照组。其中,回用比例为5%、10%时,实验组在前4 d的干重增长与对照组保持一致;4 d后,对照组干重停止增长,而这2组的干重仍在稳定增加。当热酸解提油废水回用比例超过15%时,随着废水回用比例的不断增加,发酵终了细胞干重持续下降,分别为对照组的95.86%、63.79%、44.12%和10.20%。
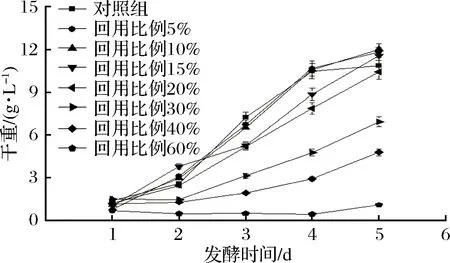
图2 不同回用比例对发酵液干重的影响Fig.2 Effect of different reuse ratio on dry weight of fermentation broth
与提油废水相比,发酵液上清液的回用比例更高。据报道,上清液回用比例可达30%,且在发酵第4天时,干重即达到最大值13.4 g/L[7]。而采用热酸解提油废水回用时,最佳回用比例为10%,发酵终了干重仅12.02 g/L。原因在于,上清液回用时仅简单离心去除藻细胞,保留了大量的代谢产物、部分质量较小的细胞碎片和胶体等,从而导致在发酵末期,因营养不足、摇瓶溶氧不足藻细胞停止生长[12]。而热酸解提油废水回用时经过反复离心,废水中仅含有代谢产物、醇等物质,固形物杂质基本不存在,而且发酵过程中干重一直没有上清液回用时高,因此没有出现溶氧不足而影响藻细胞生长的现象。之所以出现生物量比上清液回用低是因为,热酸解提油废水pH仅为1,在使用前用碱中和,与上清液相比,废水中不仅有代谢产物、残余的萃取剂,还因酸碱中和增加了盐浓度,导致发酵液渗透压增加,影响藻细胞利用营养物质的效率[13]。上清液回用和热酸解废水回用均能够提高干重,对照组停止生长后实验组仍能继续生长,说明两者均含有能够促进藻细胞生长的物质。
综上,回用比例为5%、10%时,异养小球藻的生长得到促进,最终生物量提高;回用比例为15%时,异养小球藻生长得到抑制,但生物量持续增长,最终生物量仍然比对照组有所提高;而当回用比例超过20%时,异养小球藻的生长得到抑制,最终生物量下降。
2.2 回用提油废水对发酵液pH值的影响
发酵过程中pH值不断发生变化,因此必须监控并调节好发酵过程中的pH值,否则将会对微生物的细胞膜透性、氧化-还原电位、酶活性造成影响[14]。pH值变化的原因包括培养基灭菌,微生物代谢,培养基中氨基酸和磷酸盐、铵盐的消耗,发酵后期细胞死亡,自溶[15-17]。研究发酵液pH值变化有助于整体把控发酵过程。
为了提高异养小球藻产油能力和生长速度,培养基中的氮源一般使用酵母粉等有机氮以及葡萄糖等能够被细胞快速利用的碳源,但培养基灭菌时,有机氮中的氨基酸和还原糖在高温条件下易发生美拉德反应,从而造成还原糖损失、pH值下降[18]。如图3所示,在发酵初期,各实验组的pH值没有明显差异,说明在培养基灭菌前后回用提油废水对发酵液影响不大。
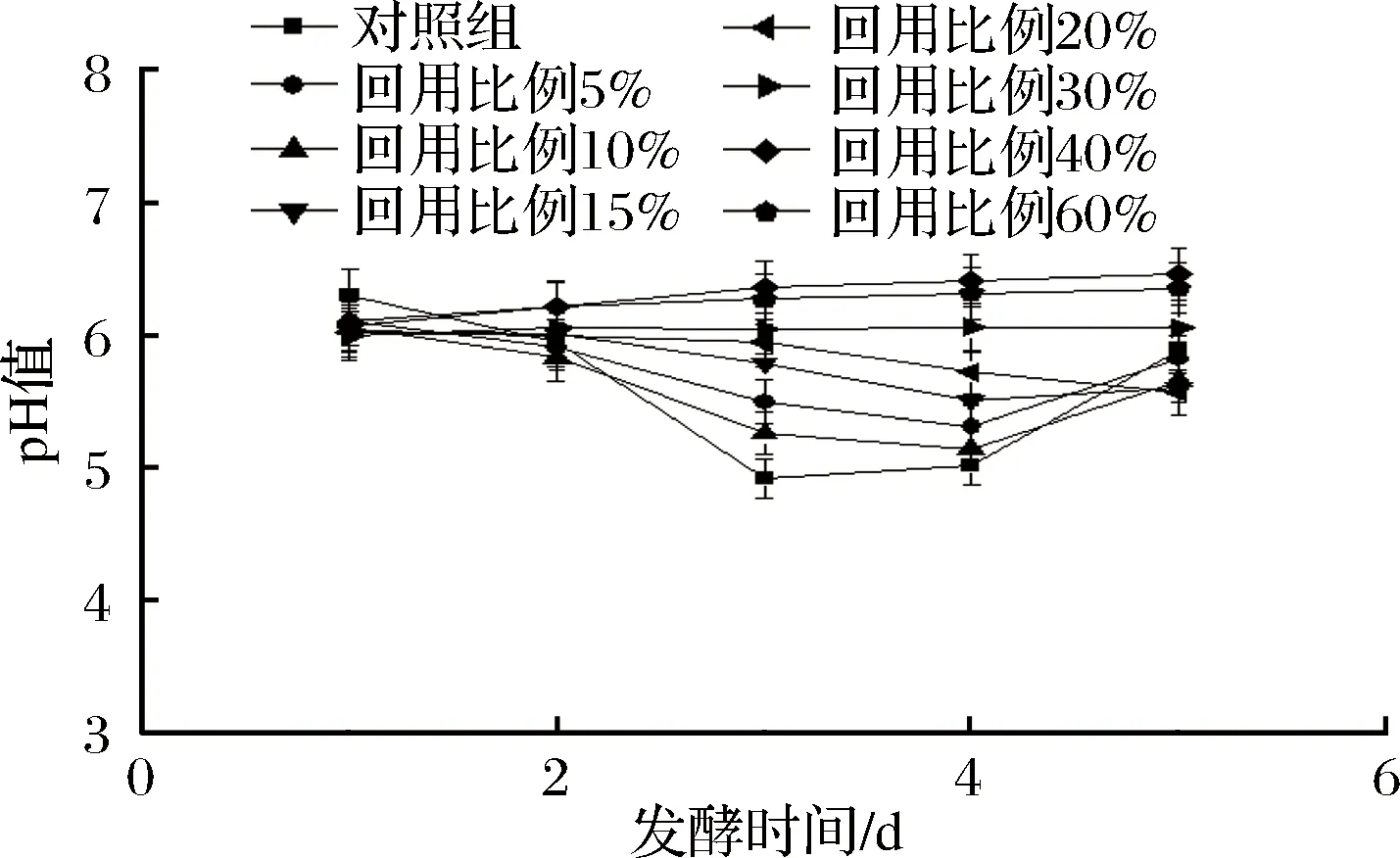
图3 不同回用比例对发酵液pH值的影响Fig.3 Effect of different reuse ratio on pH of fermentation broth
随着发酵时间的推移,回用比例为40%和60%的实验组,发酵液pH值不断缓慢上升,回用比例30%实验组pH值没有明显变化,回用比例20%实验组pH值一直处于下降过程中,而其他实验组pH值均是先下降再上升,其中对照组pH下降最快,在发酵第3天即达到最低然后开始上升,回用比例5%、10%和15%实验组则在第4天才开始上升。因此可以认为,热酸解法提油废水的回用不会影响培养基的主要成分,但能够影响藻细胞的正常生长。
在发酵液上清液回用实验中,回用30%比例的上清液,发酵过程中pH在发酵初期下降,发酵第3天达到最低然后缓慢上升,但上升缓慢,而本实验热酸解提油废水回用比例10%实验组发酵第4天pH才开始上升,pH上升速度较快,说明回用发酵液上清液藻细胞活性更强,细胞死亡、自溶速度更慢。原因可能是发酵液上清液中刺激细胞生长、维持细胞活性的物质含量更大。
实验表明,热酸解法提油废水中含有抑制藻细胞新陈代谢的物质。对照组在发酵过程中产生了更多的有机酸,在发酵中后期率先将培养基中的关键营养物质消耗完,从而引起细胞自溶、pH值上升[19]。回用比例为40%、60%时,提油废水回用对藻细胞影响较大,可能是受渗透压影响藻细胞吸收利用营养物质困难,从而导致生长代谢停滞甚至细胞缓慢死亡;回用比例为20%、15%时,提油废水回用对藻细胞有一定影响,藻细胞生长缓慢,发酵过程代谢水平降低、产酸量减少;回用比例为5%和10%实验组提油废水回用对藻细胞影响较小,发酵过程代谢产酸与对照组接近,而且细胞死亡、自溶较少。
2.3 回用提油废水对发酵液葡萄糖含量的影响
葡萄糖是活细胞的能量来源,异养小球藻发酵的过程实质上是分解葡萄糖并在酵母粉的刺激下将其转化为油脂储存在藻细胞内的过程。发酵过程中葡萄糖含量的降低速度能够反映异养小球藻生长速度及代谢速度[20]。葡萄糖的损耗除了灭菌时的美拉德反应外,还包括发酵过程中的杂菌污染消耗、代谢途径变化引起的损耗,这些都会造成葡萄糖对产物转化率的降低。观察热酸解提油废水对发酵过程的影响除了观察干重、pH值,还要观察葡萄糖含量的变化。
如图4所示,在发酵初期各实验组的葡萄糖含量基本接近,说明提油废水在培养基高温灭菌过程中影响不大,各实验组葡萄糖损失接近。在发酵中后期,回用比例5%、10%实验组和对照组一样,葡萄糖快速消耗并在发酵第5天消耗完毕,回用比例15%实验组在第5天葡萄糖略有剩余,而其他实验组葡萄糖均有大量残留。葡萄糖残留过多,不仅造成浪费,而且说明发酵过程中藻细胞活性低、发酵不彻底[21]。因此可以认为,热酸解法提油废水的回用影响藻细胞新陈代谢,大量废水的回用能够抑制葡萄糖的消耗。
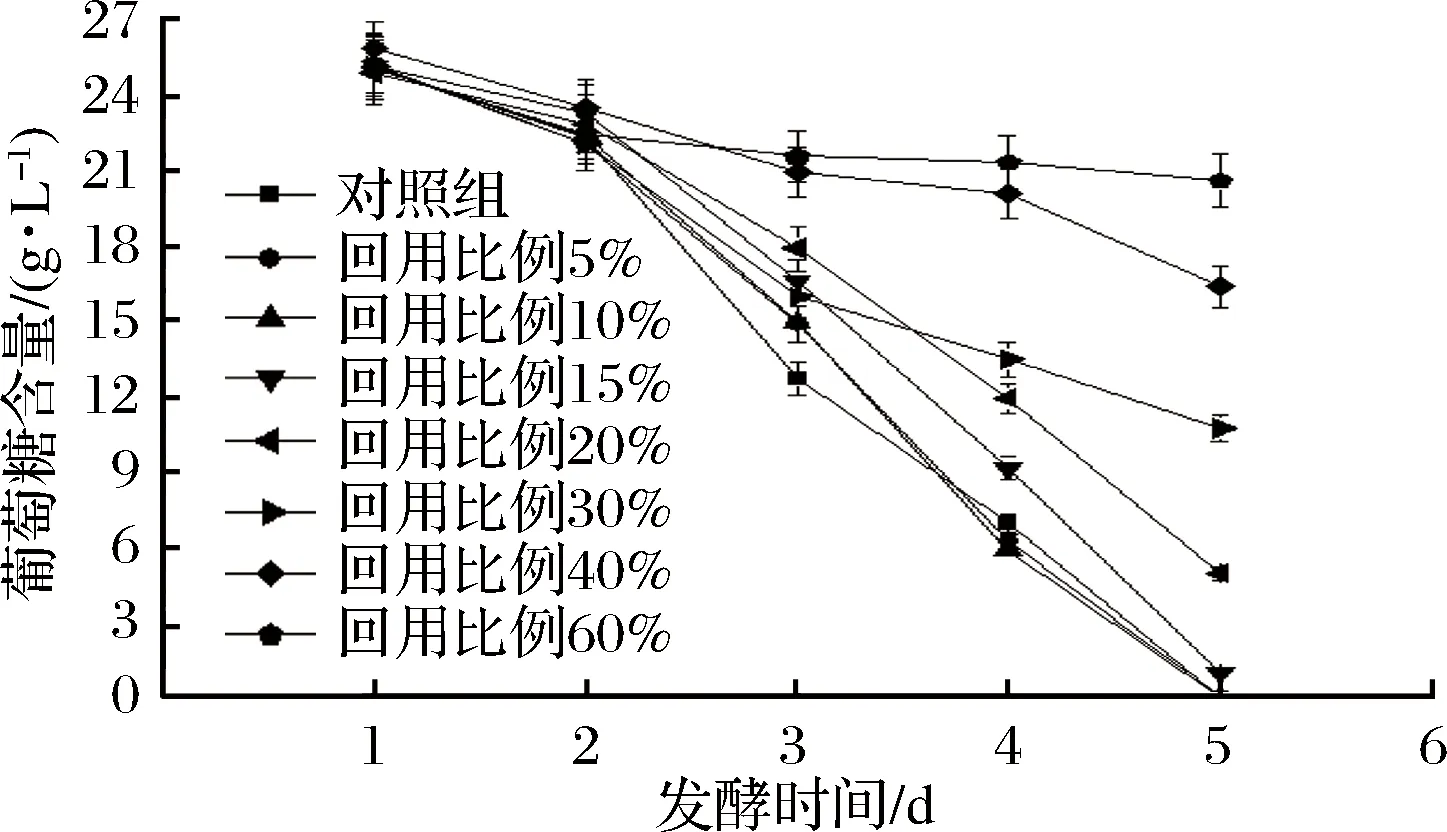
图4 不同回用比例对发酵液葡萄糖含量的影响Fig.4 Effects of different reuse ratios on glucose concentration in fermentation broth
与本实验结果相同,在发酵液上清液回用实验中,回用30%的上清液,发酵过程中葡萄糖含量同样快速下降,到发酵终了葡萄糖消耗完毕。但使用相同的培养基配方,发酵液上清液回用实验中发酵终了干重比本实验高,说明发酵液上清液回用提高了葡萄糖的转化率,相同用量的葡萄糖转化成更多的干重[22],原因可能是上清液中含有更多能够刺激藻细胞生长、提高藻细胞活性的物质。
实验表明,热酸解法提油废水中含有影响葡萄糖吸收利用的物质,回用比例为60%时,葡萄糖仅消耗了17.6%,回用比例为40%、30%时,葡萄糖消耗了33.3%、52.9%,回用比例为20%、15%时,葡萄糖消耗了80.4%、96.1%,而回用比例为10%、5%时,葡萄糖被全部消耗,回用比例越高,越影响异养小球藻对葡萄糖的吸收利用。
综上,提油废水回用5%、10%、15%时对异养小球藻生长代谢不会造成明显影响,回用比例为5%、10%能够提高异养小球藻发酵终了生物量、生长效率。相同条件下,回用提油废水替代较多的自来水更有利于降低异养小球藻培养成本,因此认为提油废水回用比例10%最佳。
3 结论
异养小球藻热酸解提油废水中既含有促进小球藻生长的因子,也有抑制小球藻生长的物质。当提油废水回用比例小于15%时,对藻细胞生长没有明显的抑制作用,甚至还能提高异养小球藻的发酵效率。热酸解提油废水(约pH 1)在中和过程产生的大量盐分以及提油废水中残留的萃取剂可能是造成小球藻生长抑制的主要因素。

