枇杷果酒酵母的筛选、分离与鉴定
吴卓凡,圣弟青,王金晶,钮成拓,刘春凤,郑飞云,李崎*
1(江南大学,工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)
枇杷(Loquat)别名芦橘、金丸等,属蔷薇科植物,原产地为长江下游,后来传至全国各地,因其叶子形状神似乐器琵琶而得名枇杷,其花、果、叶均可入药。枇杷是一种季节性水果,应季的时候产量较大,且不耐储存和运输[1]。结果季节会有一定量的滞销鲜果或品相较差的果子,枇杷阶段性的产能过剩会对果农会造成一定量的经济利益损失[2]。市场上暂无纯种发酵枇杷果酒销售,其余品类的枇杷果酒亦较少,由于枇杷的食药特性[3]受到消费者的青睐,枇杷果酒销量可期。枇杷果酒作为一种可商业化的果酒,暂无专用菌株。
市售的发酵枇杷果酒较少,仅有浙江、四川2个枇杷产地有少量传统方法发酵的枇杷果酒,而且皆采用自然发酵,酒精度及发酵度较低,工艺耗时数月,产量较低。枇杷果酒市值相对于其他成熟果酒市场而言较小,但是枇杷的食药用价值较高,枇杷果酒的市场潜力较大。优良菌株对果酒发酵产品的影响至关重要[4]:菌株起酵快、发酵能力强,就意味着枇杷果酒的生产周期短、设备利用率高、单位生产成本低、固定产量设备及人工需求量低;菌株性能稳定及风味物质佳,就意味着产品稳定性好、易受消费者喜爱。所以枇杷果酒在目前缺少专用菌株以及纯种发酵技术的情况下,亟需1株能生产高品质的枇杷果酒的酿酒酵母[5]。
本实验利用生物技术,从自然界分离筛选得到1株在枇杷果汁内起酵快、发酵强、风味佳的枇杷果酒专用酵母,并对其进行了菌种鉴定。
1 材料与方法
1.1 材料与试剂
枇杷果汁,绿源果汁公司;琼脂粉、胰-蛋白胨、葡萄糖、酵母粉、卡那霉素和TTC等,国药试剂;酵母基因组提取试剂盒,TIANGEN生物科技有限公司;蔗糖(98%纯度)食品级,市售。
1.2 仪器与设备
双人单面净化工作台,苏州净化有限公司;电子天平,Ohaus公司;紫外-可见分光光度计,上海天美公司;恒温摇床,强乐实验设备公司;移液器,德国Eppendorf公司;Hve-50全自动高压蒸汽灭菌锅,日本平山制作所株式会社;高速离心机,美国Thermo Scientific公司;R5408冷冻离心机,德国Eppendorf公司;气相色谱-质谱联用仪(GC-MS),美国Thermo Scientific公司。
1.3 培养基与菌种
枇杷汁富集培养基(g/L):枇杷汁,蔗糖 142,灭菌冷却后加入氨苄青霉素 1。YPD培养基(g/L):酵母粉10,胰蛋白胨20,葡萄糖20。斜面保藏培养基(g/L):酵母粉10,胰蛋白胨20,葡萄糖20,琼脂粉20。TTC平板培养基下层(g/L):葡萄糖50,蛋白胨20,酵母浸膏15,酸性磷酸钾10,MgSO44,柠檬酸0.27,琼脂20,氨苄青霉素1。TTC平板培养基上层(g/L):葡萄糖5,琼脂15,灭菌冷却后加入TTC 0.5。
菌种:法国酿酒酵母D254作为对照。
1.4 实验方法
1.4.1 菌种分离与TTC筛选
将新鲜成熟的白玉枇杷果榨汁,调整糖度为22 °Bx,放入已灭菌的500 mL烧杯中,于室外自然环境(环境温度20~30℃)中敞口自然发酵[6],待烧杯中有较多气泡产生且有酒香味时,取5 mL发酵醪液接入100 mL YPD液体培养基。另外将枇杷果皮和果园土壤分别放入带玻璃珠与无菌水的三角瓶中打浆[7],适度稀释后取5 mL悬液接入100 mL YPD液体培养基,28℃摇床培养24 h。
用TTC下层培养基制备平板,待平板冷却后进行涂布分离。将培养好的菌液稀释成原液、10-1、10-2、10-3、10-4、10-5共6个梯度,每个梯度3个平行,28 ℃静置培养2 d,等到菌落直径>2 mm后进行下一步实验。配制TTC上层固体培养液(注意TTC试剂的避光和避高温),将TTC上层平板倒入,避光倒置2 h后观察。典型的酿酒酵母菌落表面有光泽、柔软粘湿、易挑取[8],其中有产酒精能力的酿酒酵母在TTC平板上显红色[9]。据此特征从TTC平板上选取有典型酿酒酵母形态并且显示红色的菌落,将所有单个的菌落挑取一环于10 mL YPD培养基,扩大培养24 h。若两个菌落接合生长,则使用YPD固体平板进行划线分离,直到出现单菌落。以上菌种经过培养后都使用斜面进行临时保藏。
1.4.2 菌种复筛
将YPD试管内28℃培养24 h后的酵母以8%的接种量接入枇杷汁杜氏小管中(SO2质量浓度250 mg/L)[10],使用杜氏小管发酵法25℃静置培养,接种8 h后,每隔2 h观察各菌株的产气速度和产气量。记录菌株的起酵时间、产气速度与静置3 d后的发酵气味。
1.4.3 菌种的三级筛选
1.4.3.1 枇杷果酒发酵指标测定
将杜氏小管筛选获取的发酵能力强、起酵速度快且发酵气味宜人的菌种进行小瓶发酵实验。菌株活化后将菌液低温离心并去上清,使用PBS缓冲液清洗2~3次后将酵母泥用枇杷果汁重悬浮,并按5%接种量接入糖度调整为22 °Bx的枇杷汁中,25℃发酵7 d,每日记录失重并摇起絮凝的酵母。主酵结束测定每瓶发酵液的酒精度、残糖[10],并对其进行GC-MS风味物质半定量分析与感官品评。
1.4.3.2 感官品评
组织品评小组6人(均具有相关专业知识与背景)对枇杷果酒进行感官品评[11],总分取平均值为菌株感官品评得分。主要从外观、香气、风味和典型性4个方面评价,根据表1评分标准得出枇杷果酒感官品评结果。

表1 枇杷果酒感官品评评价表(总分100分)Table 1 Sensory evaluation standard of loquat wine
1.4.3.3 GC-MS风味物质半定量分析
采用气相色谱-质谱联用仪(GC-MS)分析枇杷果酒的香气成分[12-13]。检测时将酒样经过1∶1稀释(因为高浓度的乙醇会抑制其他挥发性物质)。样品配置:在20 mL容量的顶空瓶中,加入4 mL枇杷果酒样品,4 mL去离子水,50 μg/L 2-辛醇内标,3.0 g NaCl固体。样品前处理条件:在45℃下加热5 min,共进行萃取60 min。等到萃取全部结束后,将头插入样品进口,进行5 min的解除吸附操作,然后进行GC-MS分析。风味物质以2-辛醇作为参比计算含量。
1.4.4 菌种鉴定
以1%的接种量取-80℃甘油管保藏的菌液接种于液体YPD培养基中活化,使用28℃摇床培养24 h。取2 OD培养液高速离心60 s,遗弃上层清液,获得一定的菌体,用试剂盒提取目的酵母基因组DNA。使用引物ITS-1以及ITS-2扩增目的酵母的基因组DNA[14],得到的PCR产物进行核酸电泳检测。若条带大小合适,则产物寄送至苏州Genewiz公司进行sanger测序。采用MEGA7.4软件将测定的18S rDNA序列与GenBank中酵母菌的序列进行比对,下载匹配度前10位的序列与待鉴定菌株构建菌株系统发育树。
2 结果与分析
2.1 TTC平板初筛
通过TTC平板分离筛选后,涂布浓度为10-5的平板上约有40个单菌落,覆盖TTC上层平板2 h后约70%的酵母菌落有显红色,如图1所示。其中对照菌株D254在TTC平板上显色较好。将有产酒精能力的菌株全部用斜面临时保藏,储存于-4℃冰箱。
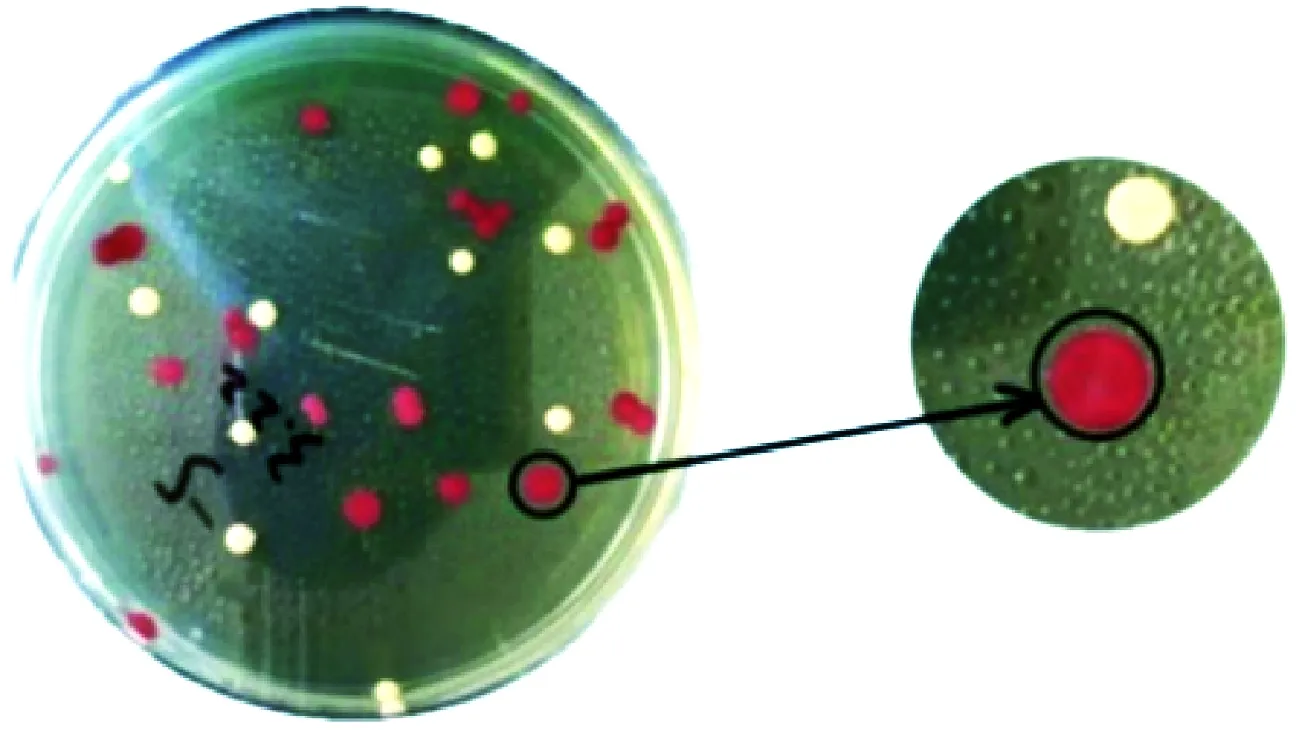
图1 TTC初筛平板Fig.1 TTC chromogenic media注:产酒精的菌株菌落颜色显红色,白色为不产酒精的菌株。
从枇杷果汁自然发酵液中筛选出70株的酿酒酵母,编号PP-1~PP-70。从枇杷果皮中筛选出59株的酿酒酵母,编号GP-1~GP-59。从果园土壤中筛选出80株的酿酒酵母,编号T-1~T-80。可见自然界中有大量适合在枇杷果汁中生长的酿酒酵母,而且种类较多。
分离筛选中使用TTC平板可以大量减少进入筛选阶段的菌株,剔除不产酒精的酵母,减少杜氏小管发酵阶段30%的工作量,在企业和研究机构选育优良菌株时有重要意义。
2.2 菌株的复筛
复筛目的是从209株菌中筛选出发酵能力合格且气味合格的菌株[15],因为发酵能力差、气味差或不耐受SO2的菌株在实际果酒生产发酵中毫无意义,避免下一步发酵筛选时耗费大量的时间与成本检测无用菌株的各项指标。
将209株分离出来的酿酒酵母使用10 mL YPD试管 28 ℃活化24 h,按8%的接种量接入放置了杜氏小管的10 mL枇杷果汁试管中,于25 ℃静置培养,进行杜氏小管产气能力及SO2耐受性检测,结果如表2所示。
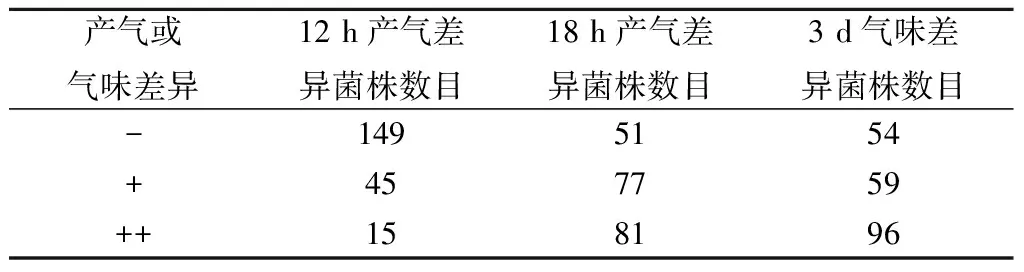
表2 酿酒酵母杜氏小管发酵筛选结果Table 2 Results of CO2 release of the strains
注:“-”表示产气量较少不足50%或有异味;“+”表示产气量在50%~90%或无异味;“++”表示产气量在90%~100%或有酒香味。
产气最快的菌株8 h时便开始产气,至8.5 h后产气满杜氏小管,而3 d后仍然有超过30株菌未能产气,可见不同酵母的发酵能力差异较大,其中对照菌株D254在10 h开始产气,11 h内产气满杜氏小管,发酵风味较好,无异味。共有15株酵母在12 h内产气量超过杜氏小管90%,但其中3株酵母在3 d时无酒香味或有异味,故复筛一共筛选获得了12株发酵能力较好、气味较好的酵母,其中有9株来自枇杷果汁自然发酵液,2株来自枇杷果皮,1株来自果园土壤,来源于枇杷果汁自然发酵液的菌株数量占比达75%,可见自然发酵后发酵能力强的菌株大致得到富集。
2.3 菌株的三级筛选
2.3.1 小瓶发酵及指标测定
对12株较为优良的菌株以及对照菌株共计13株菌进行小瓶发酵实验,25℃静置发酵7 d后测定发酵指标。如表3所示,除PP-15、GP-5外的所有菌株酒精度均大于对照菌株D254,发酵能力较强。
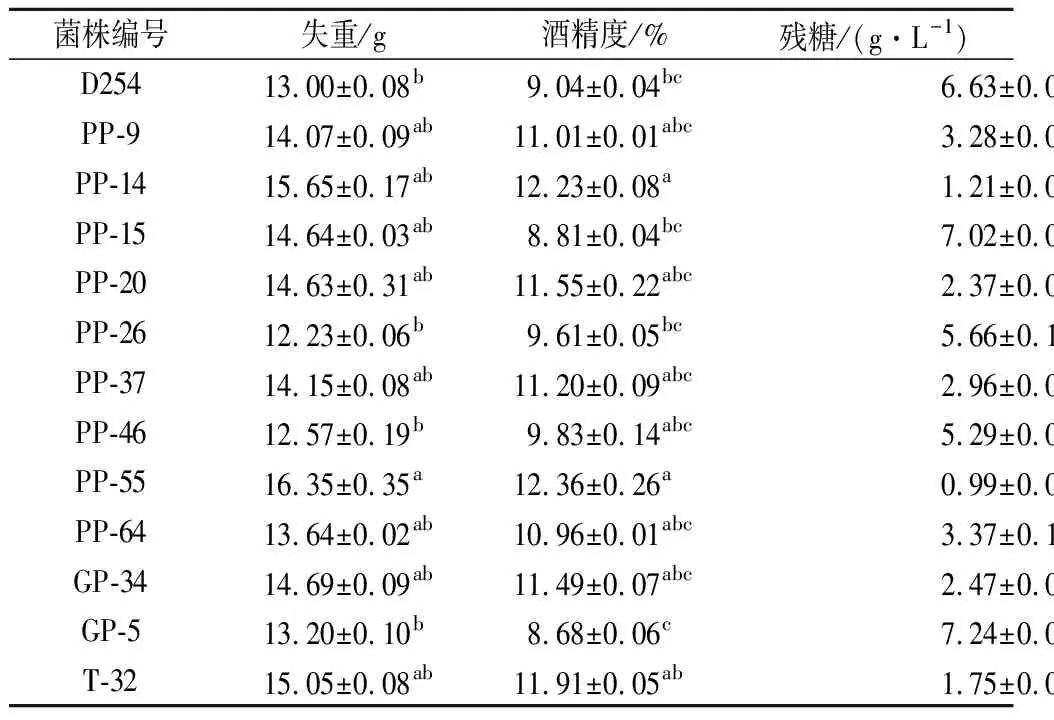
表3 酿酒酵母小瓶发酵酒液指标测定Table 3 The contents of alcohol and weight loss, and residualsugar of loquat wine fermented by different strains
注:同一列中不同字母表示显著差异(P<0.05)。下同。
酒精度作为菌株起酵速度、发酵能力、最终发酵度的判断条件,相同发酵时间下酒精度低的菌株在工业生产中发酵周期较长,会导致单位时间产量降低,影响设备的经济效益。在本轮筛选中大部分菌株的相应发酵能力对比D254都较好,在7 d的发酵后均能将绝大部分的碳源转化为酒精。经统计学分析,各菌株之间的酒精度有一定差异,高至12.3%、低约8.6%,但均在发酵果酒酒精度的正常范围内,故本轮筛选中保留全部菌株进行下一步分析。
2.3.2 感官品评及风味物质分析
经过专业团队的感官品评,去除了PP-26与PP-9共2株风味上有明显缺陷(过酸、双乙酰过高或有其他异味)的菌,去除了PP-15、PP-14、PP-20与PP-55共4株感官品评分数较低的菌(低于72分),将其他菌种与D254进行GC-MS分析,将风味物质按类别计算含量,感官品评结果与GC-MS分析结果如表4所示。

表4 GC-MS风味物质半定量分析与感官品评结果Table 4 Concentrations of various flavors of loquat wine fermented by different yeast and sensory evaluation results
其中GP-34菌株各项挥发性物质总含量均较高,相比D254醇类物质高31%,酯类物质高86%,酸类物质高25%,酚类物质高11%,醛酮类物质略低于D254,经SPSS显著性分析,GP-34与D254的醛酮类物质无显著性差异。总挥发性物质以GP-34最高,相比D254增加45%,感官品评结果亦为最优。
枇杷果酒内共检出超过70种风味物质,将其分为醇类、酸类、酯类、酚类与醛酮类五类风味化合物,它们构成了果酒的发酵香味、枇杷的典型性香味。其中醇类与酯类物质含量比例较高,是枇杷果酒较为重要的香味物质[16-17]。酯类物质具有浓郁花果香味且阈值较低,对酒体正面贡献较大;醇类物质主要是高级醇,在一定范围内展现为正面贡献,含量超标则会导致“上头”,醛酮类、酚类物质虽然含量较少,但是也和醇类、酯类相互作用,维持酒体平衡。
对GP-34菌株与对照菌株D254的GC-MS报告进行归纳,计算出实际各种香味物质含量,以香气活力值(odor active valne,OAV)OAV表示香味物质实际含量与阈值的比值,通过对比OAV>1的香味物质,分析出枇杷果酒贡献较大的风味物质[18],如表5所示。
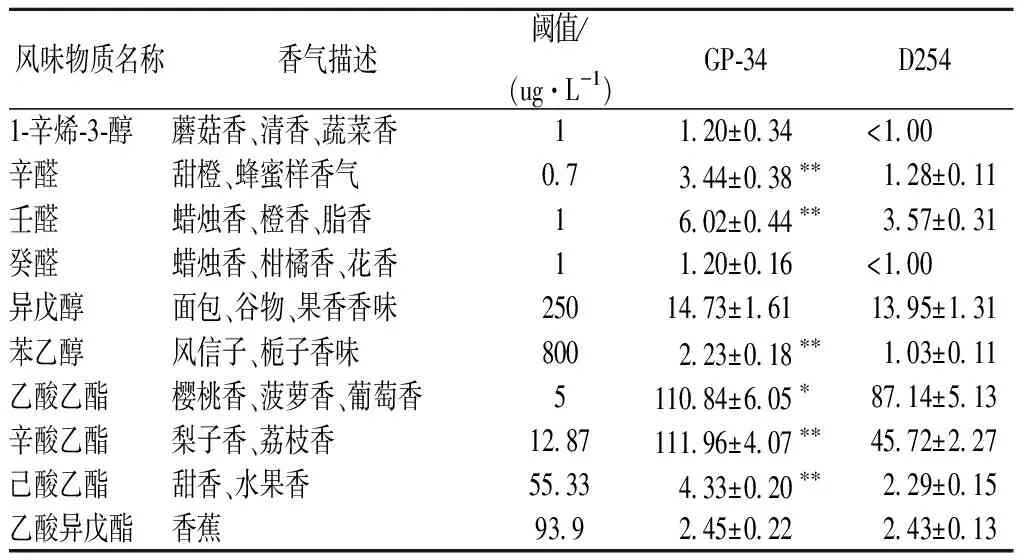
表5 GP-34中主要风味物质贡献值Table 5 OAVs of odorants of different loquat wines
注:**表示在P<0.01水平上极显著差异;*表示在P<0.05水平上显著差异。
首先可以看出GP-34菌株各主要香气组分OAV值均大于D254,可能是其感官品评获得高分的原因。经SPSS 24.0软件作统计学分析,GP-34菌株与对照菌株D254发酵枇杷果酒的辛醛、壬醛、苯乙醇、辛酸乙酯、己酸乙酯的OAV值呈极显著差异,乙酸乙酯的OAV值呈显著差异。分析2株菌的OAV值,菌株GP-34的OAV>1的有4种酯、3种醇、3种醛,醇类和酯类占总OAV值95%以上;菌株D254相比GP-34少2种风味物质,并且辛酸乙酯、己酸乙酯大幅减少。其中乙酸乙酯、辛酸乙酯以及异戊醇在总OAV值中的比例较高,意味着这3种物质对酒体风味有着极大的贡献。乙酸乙酯和异戊醇是酵母发酵带来的风味物质,富有浓郁的果香与谷物香,辛酸乙酯是一种长链酯,具有清新的水果香气,这可能是枇杷果酒风味的重要组成部分[19]。识别出重要香味物质成分对枇杷果酒的进一步改良意义重大,可以通过靶向筛选获得香味更浓郁、典型的果酒菌株。综合以上结果,GP-34菌株适合枇杷果酒的酿造,发酵能力强,风味物质优。
2.4 菌种鉴定
提取GP-34菌株的基因组DNA,PCR扩增后进行核酸电泳,结果如图2所示,PCR产物的电泳条带明亮、容易分辨,大小约为500 bp。
将产物进行Sanger基因测序,测序获得的18S rDNA序列长约480 bp,解析序列后在NCBI网站上进行BLAST,导入匹配度前10的酵母菌18S rDNA序列用MEGA 7.4软件进行分析,构建系统发育树[20]。如图3所示,GP-34菌株与酿酒酵母(Saccharomycescerevisiae)100%同源,说明GP-34菌株属于酿酒酵母属。同时,发现GP-34与1株标记为水果来源的酿酒酵母(序列ID:LC269108.1)具有最高的18S rDNA序列相似性(100%),故将GP-34菌株鉴定为酿酒酵母。
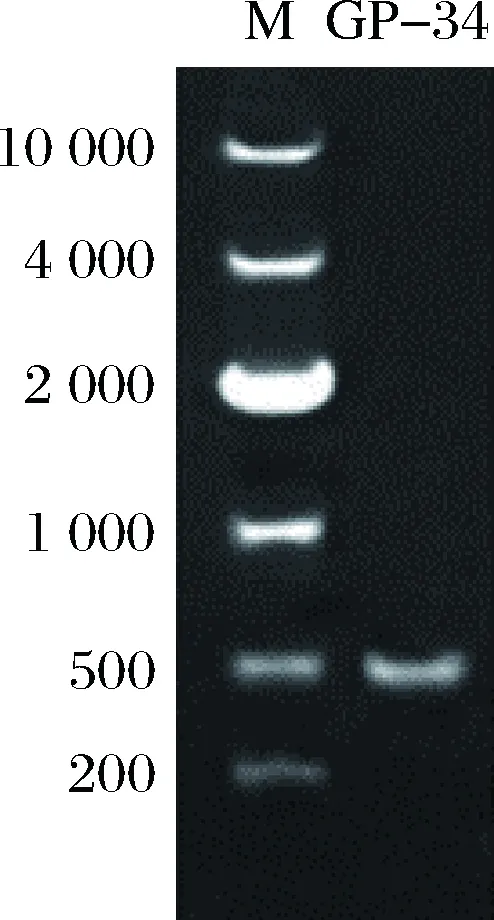
图2 PCR产物电泳条带Fig.2 PCR analysis of 18S rDNA

图3 基于18S rDNA测序结果构建酵母菌株系统发育树Fig.3 Phylodenetic tree of Saccharomyces cerevisiae based on 18S rDNA sequencing
3 讨论
果酒加工的核心要素是原料、菌种和工艺,优质的专用菌株是企业的核心资产,使用不适用的菌株进行生产会造成质量与产量的损失。本实验主要进行了枇杷果酒专用酵母的筛选,目的是获得1株发酵能力强、香气浓郁且口感好的酿酒酵母。一级筛选高效地筛选出大量能利用枇杷果汁进行酒精发酵的酵母,二级筛选淘汰了发酵能力弱或气味不宜人的酵母,小瓶发酵后进行感官品评与GC-MS分析获得了1株口感柔和且风味浓郁的酵母,编号为GP-34。该菌株在22 °Bx的枇杷果汁中酒精度可达11.49%,可以耐受250 mg/L的SO2。在风味方面,GP-34的感官品评结果最优,醇类、酯类、酸类、酚类与总挥发性物质均高于对照商业菌株D254,重要风味化学物的OAV全面高于D254。经过经18S rDNA测序与系统发育树分析,鉴定GP-34为酿酒酵母Saccharomycescerevisiae。
专用果酒酵母筛选的意义在于获得在相应果汁环境下发酵能力强、发酵风味好的菌株。发酵能力强的菌株可以通过定向富集、杜氏小管筛选等方法获得,而风味优良、口感好的菌株需要进一步的筛选。果酒的风味由70多种物质构成,但是由于各种香味物质会相互抑制或促进,难以使用香味物质的含量与比例来展现风味的优劣,而通过感官品评结果验证GC-MS数据可以更直观反映出不同菌株的风味优劣。
枇杷果酒专用菌株的获得有利于枇杷果酒行业的开拓,具有较强工业应用前景,为进一步的果酒研发奠定了基础。

