乌头碱对类风湿性关节炎成纤维细胞样滑膜细胞增殖、凋亡及自噬的影响①
邵 鑫 袁叶双 蒋先虹 贾艾敏 刘 静 陈 勇 刘 福
(川北医学院药学院,南充 637000)
类风湿关节炎(Rheumatoid arthritis,RA)是一种病因不明的慢性系统性自身免疫性疾病,致病率和致残率均较高[1]。近年来研究发现,类风湿性关节炎成纤维细胞样滑膜细胞(RA-FLS)比例失衡和功能改变与RA的发生发展密切相关,RA-FLS是一种类似于肿瘤细胞样增殖的细胞,无接触性抑制,胞内抗凋亡相关基因表达上调,RA-FLS活性增强、凋亡减少是导致RA患者滑膜异常增生的关键原因[2]。自噬是一种广泛存在于真核细胞内,并依赖溶酶体降解胞质细胞器和大分子的途径,对维持细胞内平衡有至关重要的意义[3]。通常情况下,自噬是在应激条件下促进细胞存活的一种调节方式,但过度激活自噬会导致细胞死亡[4]。由于RA-FLS细胞凋亡和自噬异常均可导致RA疾病的发生及进展,因此研究药物对RA-FLS的影响成为治疗RA的有效方案。乌头是一种传统的中草药,在中国已有两千多年的历史,是一种解热、镇痛和抗风湿药。乌头碱是乌头的主要活性成分之一[6],已有研究表明适量的乌头碱可抑制肝癌细胞增殖[7],并可诱导人胰腺癌细胞发生凋亡[8,9]。最近的证据表明,乌头碱具有免疫调节特性,可能是治疗自身免疫性疾病的潜在有效药物[10]。本研究通过乌头碱作用于原代培养细胞RA-FLS,观察乌头碱对细胞增殖及凋亡的影响,并探究能否诱导自噬,其诱导的自噬又是否为抑制RA-FLS增殖、促进RA-FLS凋亡的影响因素。
1 材料与方法
1.1材料
1.1.1仪器 倒置显微镜(日本Olympus公司);CO2培养箱(上海力新仪器有限公司);高压蒸汽灭菌器(日本Sanyo公司);流式细胞仪(美国Becton Dickinson公司);电子天平(德国Sartorius公司);聚合酶链式反应(PCR)仪(美国ABI公司);超微量紫外分光光度计(北京五洲东方科技发展有限公司);激光共聚焦显微镜(日本Olympus公司)。
1.1.2主要药品与试剂 乌头碱(Aconitine,成都曼斯特生物科技有限公司,批号:MUST-18110905,纯度:98.01%);胎牛血清、胰酶、二甲亚砜(DMSO)(美国Gibco公司);MTT试剂(上海碧云天生物科技有限公司);LC3、β-actin引物(生工生物工程上海股份有限公司);AnnexinV/PI双染试剂盒(南京凯基生物科技有限公司);逆转录试剂盒(德国QIAGEN公司);BCA蛋白浓度测定试剂盒(美国thermo fisher公司);兔抗人LC3单克隆抗体(美国Cell Signaling Technology公司),鼠抗人β-actin单克隆抗体(成都ZenBioScience公司);辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗(成都ZenBioScience公司);ECL化学发光液(合肥市Biosharp生物公司);4%多聚甲醛(合肥市Biosharp公司);Ⅱ型胶原酶、皂素(美国Sigma公司);BSA(德国Biofroxx公司);山羊血清封闭剂、DAPI染剂、抗荧光淬灭剂(上海碧云天生物科技有限公司);异硫氰酸荧光素(FITC)标记的羊抗兔IgG二抗(成都ZenBioScience公司)。
1.2方法
1.2.1原代细胞培养 RA-FLS采用原代细胞培养[11]。从川北医学院附属医院关节置换术的RA患者(n=3)的膝关节获得人滑膜组织标本,将滑膜组织用含有2%青霉素-链霉素的磷酸盐缓冲盐水(PBS)洗涤3次,并剔除血污和脂肪至洗涤液明亮。将组织用无菌剪剪成1 mm×1 mm×1 mm体积的小块,加入3倍体积4 mg/ml的Ⅱ型胶原酶,放入37℃孵箱中消化4 h,每半小时振荡数次。温育后,用PBS稀释消化液并用200目无菌筛网过滤,1 000 r/min,5 min离心后悬浮在含有10%胎牛血清和1%青霉素-链霉素的DMEM培养基中,放入37℃,5%CO2的孵箱中培养。取第3代至第7代较纯的RA-FLS用于本实验研究。
1.2.2乌头碱对RA-FLS增殖活力的影响 采用MTT法[12]检测检测乌头碱对RA-FLS增殖活力的影响。实验分组:空白组(未加细胞组)、对照组(未加药组)、乌头碱230 μmol/L组、乌头碱460 μmol/L组,乌头碱用DMSO配制成母液冻于-20℃,待用时用培养基配制成所需浓度,对照组加入等量DMSO。取对数生长期细胞,完全培养基调整密度至5×104个/ml,接种100 μl于96孔板,另设空白组,加入等体积完全培养基。于37℃、5%CO2的培养箱中过夜,待细胞贴壁成形后弃去原培养基,加入含乌头碱的终浓度分别为0(对照组)、230、460 μmol/L的无血清基础培养基100 μl;孵育24 h后每孔加入20 μl 5 mg/ml的MTT溶液,置孵箱中继续孵育4 h后小心弃去全部液体,加入150 μl的DMSO溶液,避光溶解10 min后采用酶标仪于570 nm波长处测定各孔吸光度(OD)。细胞增殖活力(%)=[1-(对照组细胞OD值-给药组细胞OD值)/(对照组细胞OD值-空白组OD值)]×100%。每组设置3个复孔,试验均重复3次。
1.2.3乌头碱对RA-FLS细胞凋亡的影响 采用流式细胞术[13]检测乌头碱对RA-FLS细胞凋亡的影响。取对数生长期细胞,接种于6孔板,于37℃、5%CO2的培养箱中培养,待细胞融合率约为80%时弃去原培养液,加入含乌头碱的终浓度分别为0、230、460 μmol/L的无血清基础培养基继续分别培养24后,收集各组细胞,再以PBS 500 μl重悬细胞,先后加入AnnexinV-FITC、PI染色试剂各5 μl,混匀,在冰上避光孵育15 min,在1 h内采用流式细胞仪进行检测。采用FlowJo V10软件进行数据采集及处理。
1.2.4乌头碱对RA-FLS细胞中LC3 mRNA水平相对表达的影响 采用实时荧光定量逆转录-聚合酶链反应(RT-qPCR)法[14]检测乌头碱对RA-FLS中LC3 mRNA水平相对表达的影响。取对数生长期细胞,加入相应终质量浓度的含乌头碱分别为0、230、460 μmol/L的无血清基础培养基2 ml,培养24 h。TRIzol试剂提取各组细胞总RNA后,采用紫外分光光度法检测RNA的浓度及纯度。然后按逆转录试剂盒进行逆转录获得cDNA后,采用RT-qPCR仪检测β-actin、LC3基因的表达水平。总反应体积为10 μl。扩增程序:95℃预变性 30 s;95℃反应5 s,60℃反应30 s,72℃反应20 s,40个循环。LC3的正义链序列为AATCCCGGTGATCATCGAGC,反义链序列为GCCGGATGATCTTGACCAAC(5′-3); β-actin的正义链序列为AGCACTGTGTTGGCGT-ACAG,反义链序列为TCCCTGGAGAAGAGCTACGA(5′-3′)。以β-actin为内参,采用2-ΔΔCt法计算各目标基因mRNA的表达水平。
1.2.5乌头碱对RA-FLS细胞中LC3蛋白相对表达的影响 采用Western blot法[15]检测乌头碱对RA-FLS中LC3蛋白相对表达的影响。取对数生长期细胞,加药处理(与1.2.4相同)。用RIPA裂解液提取细胞总蛋白,并采用BCA蛋白浓度测定试剂盒进行蛋白定量,在90℃金属浴条件下使蛋白变性10 min,于-20℃保存,待用。使用时分别取变性蛋白样品25 μg,进行SDS-PAGE凝胶电泳,转膜,5%脱脂奶粉,封闭,β-actin、LC3一抗(1∶1 000) 4℃孵育过夜;次日二抗(1∶10 000)孵育,然后在凝胶成像仪中采用ECL化学发光液显色。采用Image J 1.52a 软件对蛋白条带进行图像分析,计算蛋白相对灰度值。
1.2.6免疫荧光 采用免疫荧光观察细胞自噬[16]。取对数生长期细胞接种于铺有载玻片的6孔板中,加入相应终质量浓度的含乌头碱分别为0、230、460 μmol/L的无血清基础培养基2 ml,此外,另设雷帕霉素(Rapamycin)阳性对照组(50 nmol/L),培养24 h后,依次进行以下步骤:用4%多聚甲醛溶液室温固定 15 min;PBS洗涤2次后,用含有0.1% 皂素的 PBS 通透细胞 15 min;PBS洗涤2次后用5%正常山羊血清封闭45 min;加入LC3一抗孵育(兔抗-LC3 1∶100,杭州华安生物科技有限公司)在4℃下过夜,次日用PBS洗涤3次,后在37℃下进行二抗(羊抗兔IgG-TRITC,1∶400)避光孵育45 min,后用PBS洗涤3次,然后用DAPI染核5 min,封片,观察。用激光扫描共聚焦显微镜(OILMPUS)进行样品分析。
2 结果
2.1乌头碱对RA-FLS细胞增殖活力的影响 由图1可见,与对照组相比,乌头碱加药组细胞形态由长梭形逐渐变圆,胞核色素沉着,细胞间隙增加。MTT结果显示,以对照组细胞增殖活力为100%计算,乌头碱230 μmol/L组的细胞增殖活力为(80.56±4.99)%,乌头碱460 μmol/L组的细胞增殖活力为(53.03±2.96)%(见图2)。
2.2乌头碱对RA-FLS细胞凋亡的影响 图3中,凋亡细胞为早期凋亡细胞(右下象限)与晚期凋亡细胞(右上象限)之和,流式检测结果显示,乌头碱230 μmol/L组细胞凋亡率为(15.12±2.87)%,与对照组(11.69±1.36)%相比虽有所增加但差异没有统计学意义(P=0.135),而乌头碱460 μmol/L组(26.16±5.68)%,与对照组相比差异具有统计学意义(P<0.05)。
2.3乌头碱对RA-FLS细胞中LC3 mRNA相对表达的影响 RT-qPCR结果显示,乌头碱230 μmol/L组LC3 mRNA的相对表达为(1.655 90±0.456 79)、乌头碱460 μmol/L组(1.739 20±0.214 51),均高于对照组 (1.048 70±0.338 34),且差异均具有统计学意义(P<0.05)(见图4)。
2.4乌头碱对RA-FLS细胞中LC3蛋白相对表达的影响 Western blot结果显示,乌头碱230 μmol/L组LC3/β-actin 蛋白的相对表达为(0.606 20±0.035 1)、乌头碱460 μmol/L组(1.062 70±0.154 06),均高于对照组 (0.247 40±0.032 24),且差异均具有统计学意义(P<0.05)(见图5)。
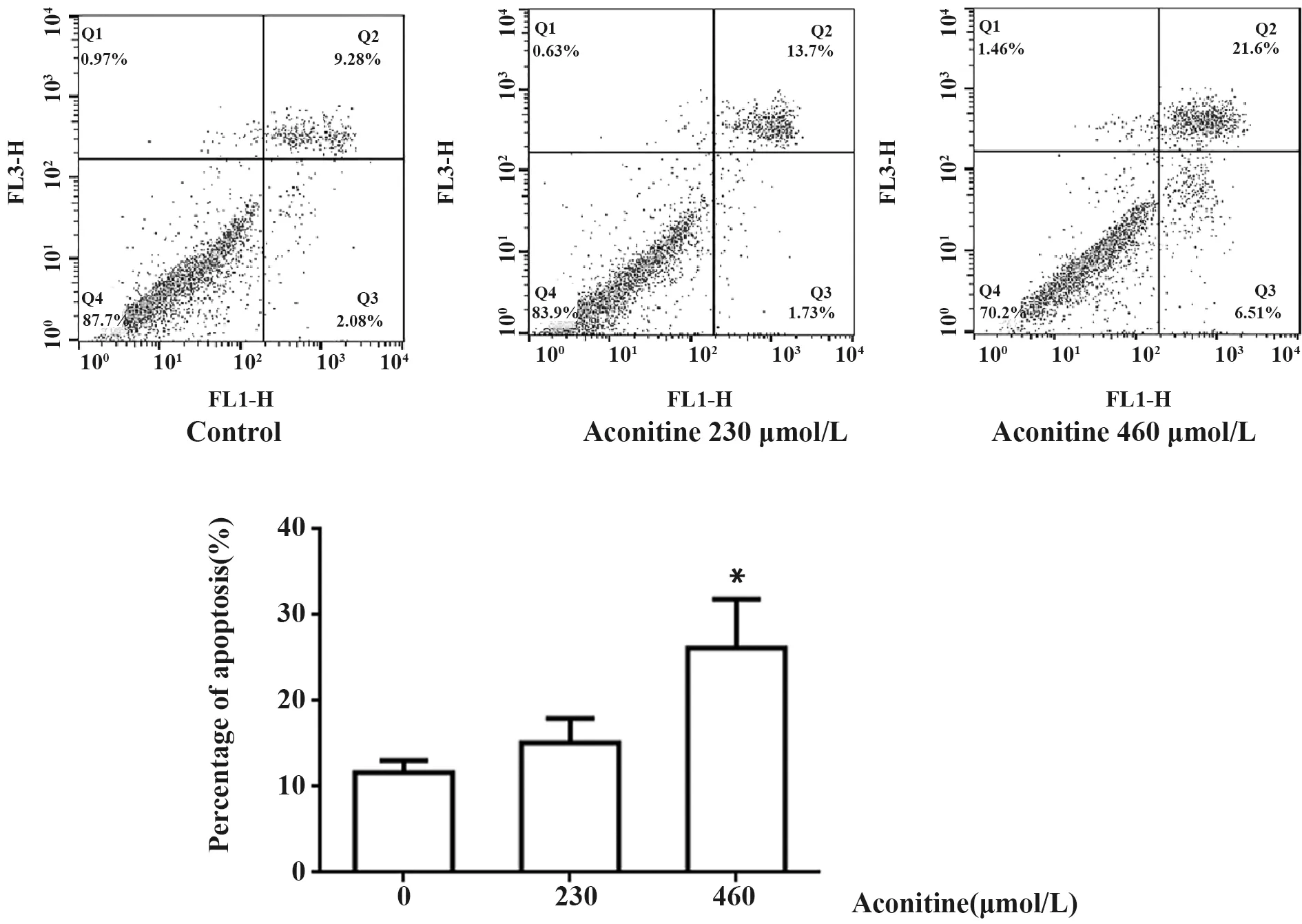
图3 乌头碱对RA-FLS凋亡的影响Fig.3 Effect of aconitine on apoptosis of RA-FLSNote:Cell apoptosis was determined by flow cytometry.*.P<0.05 vs control group(Aconitine=0 μmol/L).
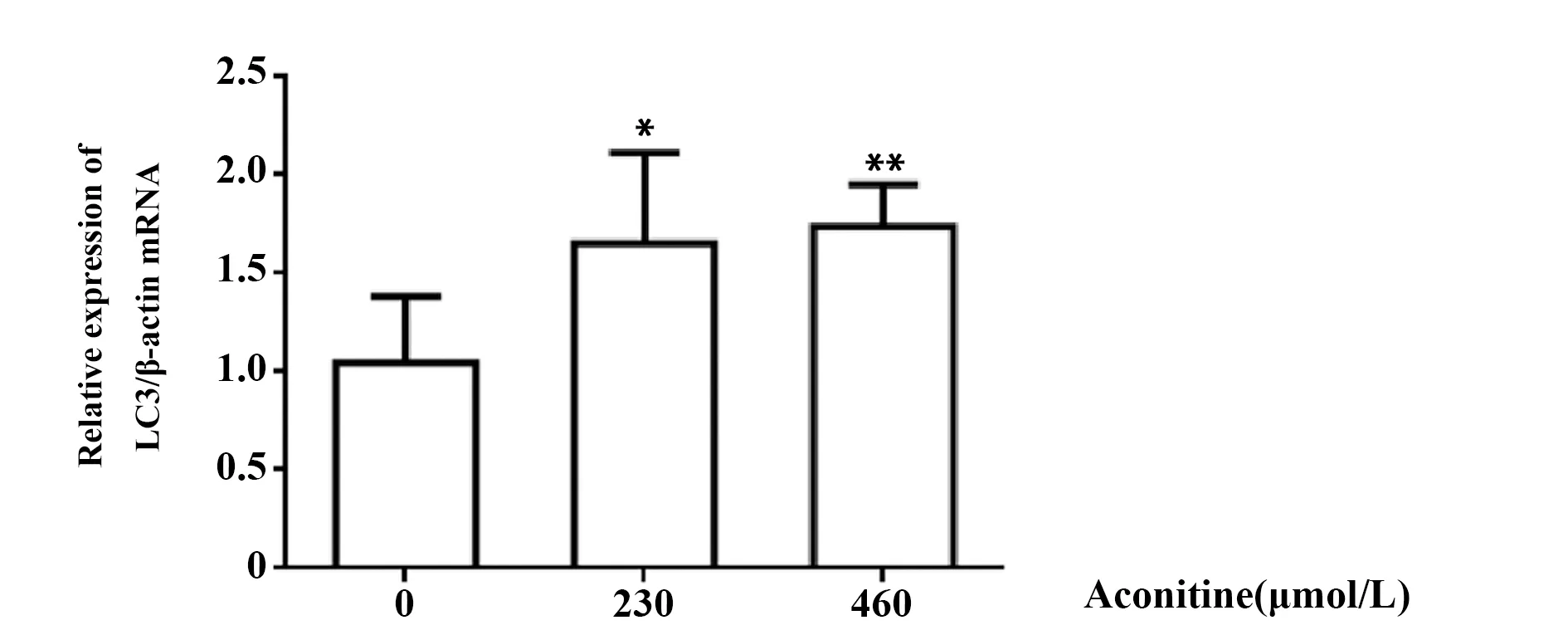
图4 乌头碱对LC3/β-actin mRNA相对表达的影响Fig.4 Effect of aconitine on relative expression of LC3/β-actin mRNANote:The mRNA levels was determined by RT-qPCR.*.P<0.05,**.P<0.01 vs control group(Aconitine=0 μmol/L).
2.5免疫荧光法检测自噬相关蛋白 采用绿色荧光标记自噬蛋白LC3,绿色斑点代表自噬体的形成。图中共聚焦结果显示,未加药对照组中绿色荧光呈弥散状分布于细胞中,雷帕霉素阳性组中绿色荧光成斑点状出现在细胞中。乌头碱组绿色荧光显著,且出现绿色斑点,尤以乌头碱460 μmol/L组最为明显,提示细胞膜上自噬体形成,细胞自噬水平升高,乌头碱可使RA-FLS中的自噬活化(见图6)。

图5 乌头碱对LC3/β-actin蛋白相对表达的影响Fig.5 Effect of aconitine on relative expression of LC3/β-actin proteinNote:The protein levels was determined by Western blot.β-actin was used as loading control.**.P<0.01,***.P<0.001 vs control group(Aconitine=0 μmol/L).

图6 共聚焦结果图Fig.6 Confocal results
3 讨论
RA的病理学特征是滑膜的炎性细胞浸润导致的慢性炎症和进行性关节损伤[17],RA-FLS释放大量致炎因子介导RA关节破坏,且具有类似肿瘤样细胞生长的特性,在具有侵袭性表型的RA发病机理中起重要作用[18,19],抑制RA-FLS的异常增殖对RA的治疗具有重要作用。在本研究中,我们初步发现乌头碱能有效抑制RA-FLS的增殖活性,且随着乌头碱剂量增加细胞增殖活性百分率也逐渐降低。
目前LC3蛋白是检测细胞自噬的常用指标[20],自噬是一种保守的遗传调控途径,它可以分解代谢错误折叠的蛋白质、损伤的细胞器等细胞内容物,其具体过程为通过双层膜结构包裹蛋白或细胞器后形成自噬小泡,在溶酶体内完成降解,维持细胞内环境稳态[21,22]。微管相关蛋白1轻链(Microtubulesas sociated protein1 light chain,LC3)是酵母菌Atg8基因的同源产物,LC3在 Atg4蛋白酶的作用下裂解生成LC3 I[23]。当发生自噬现象时,经泛素样加工修饰催化的LC3Ⅰ与自噬小体膜上的磷脂酰乙醇胺结合,形成LC3Ⅱ[24]。LC3Ⅱ是自噬过程中十分重要的信号分子,同时也是自噬发生的标记性蛋白[25]。LC3Ⅱ与自噬小体膜紧密结合,存在于自噬小体膜上,因此通过检测LC3Ⅱ水平的高低可以监测自噬的发生以及判断其活性的强弱[26,27]。在本研究中,通过RT-qPCR表明乌头碱230 μmol/L组及460 μmol/L 组中RA-FLS的LC3相对基因表达水平高于对照组,随后,验证乌头碱加药组同样增强LC3相对蛋白的表达水平,且差异具有统计学意义,这些结果说明乌头碱能有效诱导RA-FLS细胞中自噬水平,呈浓度依赖性。此外,通过免疫荧光检测LC3自噬体的形成,雷帕霉素阳性组中绿色荧光成斑点状聚集在细胞中,与未加药对照组相比,乌头碱加药组中绿色荧光明显增强,LC3Ⅱ成斑点状聚集于细胞中,同样也证实乌头碱组可诱导RA-FLS的自噬水平。自噬对细胞具有双重作用,当自噬过度激活时,细胞发生裂解,引起自噬性细胞死亡[28];而当自噬适度激活时,可加速胞内损伤蛋白质及细胞器的降解,产生氨基酸等小分子,供给物质及能量需要,进而促进细胞存活[29]。此前,我们通过流式细胞术已检测出乌头碱230 μmol/L组及460 μmol/L组均能促进RA-FLS凋亡,差异具有统计学意义,且随着乌头碱剂量增加细胞凋亡百分率也增加,说明乌头碱能诱导RA-FLS发生凋亡并具有浓度依赖性。以上结果表示,乌头碱促进RA-FLS细胞凋亡可能与其过度激活LC3基因及蛋白的表达,诱导自噬体的产生有关。
综上,乌头碱可有效抑制RA-FLS的增殖活性并诱导凋亡,且具有浓度依赖性,这可能与其过度激活RA-FLS中的自噬水平有关。