鸭寡腺苷酸合成酶样蛋白原核表达及多克隆抗体制备
毕可然,李银,韩凯凯,赵冬敏,刘青涛,刘宇卓,黄欣梅,杨婧
鸭寡腺苷酸合成酶样蛋白原核表达及多克隆抗体制备
毕可然1,2,李银1,韩凯凯1,赵冬敏1,刘青涛1,刘宇卓1,黄欣梅1,杨婧1
(1江苏省农业科学院兽医研究所/农业部兽用生物制品工程技术重点实验室,南京 210014;2海洋生命与水产学院,江苏海洋大学,江苏连云港,222005)
【】已有研究获得鸭寡腺苷酸合成酶样蛋白(oligoadenylate synthase-like protein,OASL)基因全长,并且证明其可以抑制鸭坦布苏病毒复制。因此在通过原核表达和多克隆抗体制备技术获得带有GST标签的鸭寡腺苷酸合成酶样融合蛋白和该融合蛋白的特异性抗体,为进一步明确鸭寡腺苷酸合成酶样蛋白抑制病毒复制分子机制提供物质基础。根据前期研究已经获得的鸭OASL基因开放阅读框(open reading frame,ORF)序列设计全长扩增引物pGEX-OAS-F和pGEX-OAS-R。利用动物组织总RNA提取试剂盒提取健康樱桃谷鸭幼鸭脾脏总RNA;通过RT-PCR,利用随机引物和M-MLV反转录酶扩增获得鸭脾脏cDNA,以cDNA为模板,利用设计合成的pGEX-OAS-F和pGEX-OAS-R引物进行PCR扩增,扩增后的产物经1.5%的琼脂糖凝胶电泳检测,检测后将片段大小与目的条带大小相同的PCR产物切胶纯化,纯化后的产物克隆到pEASY-T1载体,挑取单克隆菌落送基因公司测序,测序验证正确的PCR纯化产物通过限制性内切酶HI和I酶切连接至带GST标签的原核表达载体pGEX-4t-1。重组质粒转化到大肠杆菌BL21(PLYSS)TM,经终浓度为0.5 mmol·L-1的IPTG诱导表达4 h后检测该融合蛋白的表达情况。离心收集诱导表达的大肠杆菌菌液,进行超声波破碎处理,收集上清及沉淀,采用SDS-PAGE和Western-blotting分析融合蛋白的表达。利用GST柱亲和纯化上清中的可溶性融合蛋白,经20 mmol·L-1Tris-HCL和0.10 mol·L-1NaCL溶液透析后获取纯化的融合蛋白,采用SDS-PAGE分析纯化的融合蛋白。采用皮下多点注射方法免疫新西兰白兔,经3次免疫后制备多克隆抗血清,采用SDS-PAGE和间接免疫荧光检测抗体的纯度和效价。克隆测序结果表明,设计合成的鸭OASL基因全长扩增引物pGEX-OAS-F 和 pGEX-OAS-R能够从樱桃谷鸭脾脏中获得鸭OASL基因ORF序列,并且序列组成与前期研究结果一致。被扩增的序列经酶切后,鸭OASL基因能够与pGEX-4t-1载体成功连接,IPTG诱导后可以在大肠杆菌BL21(PLYSS)TM中表达,表达产物经SDS-PAGE和Western-blotting分析显示,融合蛋白大小约为84 kD,主要以可溶性蛋白形式表达,在包涵体中也有少量表达。经GST亲和层析纯化上清中的可溶性鸭OASL融合蛋白,得到0.5 mmol·L-1纯度抗原蛋白。经3轮免疫新西兰大白兔制备多克隆抗体,纯化后ELISA结果显示鸭OASL蛋白抗体具有较好的灵敏度,最高效价为1:512 000,SDS-PAGE结果显示抗体大小为55 kD,与ORF理论值相同,且抗体纯度为90%以上。设计合成的引物能够成功地获得鸭脾脏OASL基因ORF序列,该ORF能够在原核细胞中成功表达,表达的融合蛋白通过免疫新西兰兔能够获得高纯度和高效价的鸭OASL多克隆抗体,研究成果为后续深入研究鸭OASL蛋白抑制病毒复制分子机制奠定坚实的物质基础。
鸭寡腺苷酸合成酶;原核表达;多克隆抗体
0 引言
【研究意义】养鸭业是我国的特色产业和农村经济发展的支柱产业之一,随着养殖规模的扩大和养殖密度的提高,各种病害频繁发生,病毒病是危害养鸭业健康发展的重要疫病之一。鸭寡腺苷酸合成酶样蛋白(duck oligoadenylate synthetase-like protein,DuOASL)是寡腺苷酸合成酶家族蛋白的一种,已有研究表明OAS家族蛋白是一种具有广谱的抗病毒活性蛋白,当人被病毒感染后,人OASL蛋白快速通过C端泛素化区与视黄酸诱导基因蛋白I(retinoic acid inducible gene-I,RIG-I)的CARDs结构域结合,进而激活RIG-I信号通路,增强机体细胞检测病毒RNA的能力,继而激活机体免疫系统来感知病毒并且抑制病毒复制[1]。因此,基于笔者前期的研究结果,通过原核表达和多克隆抗体制备技术获得带有GST标签的原核表达蛋白和多克隆抗体对深入探讨鸭寡腺苷酸合成酶样蛋白抑制病毒复制分子机制奠定坚实物质基础。【前人研究进展】在禽类中,日本学者首次证实鸡体内OAS 家族蛋白为OASL蛋白,该蛋白可以抑制黄病毒属的西尼罗河病毒复制[2];最近,Tag-EL-Din-Hassan等[3-4]进一步证实,鸡OASL蛋白不仅具有重要的抗病毒特性,而且该蛋白的抗病毒特性不依赖于2—5寡腺苷酸合成酶。我国学者杨超等也报道鹅体内仅有OASL蛋白,过表达鹅OASL能抑制新城疫病毒在鹅胚成纤维细胞中的复制[5]。韩凯凯等基于鸭卵泡组织差异蛋白组学分析发现鸭OASL蛋白在鸭坦布苏病毒感染组和未感染组表达存在差异,在病毒感染组中表达明显增强[6]。前期研究首次获得了鸭OASL基因全长,蛋白结构分析表明,鸭OASL蛋白N端具有寡腺苷酸合成酶样结构域,C端具有泛素化样结构域,并且寡腺苷酸合成酶样结构域中具有保守的寡腺苷酸合成酶活性位点,预测可能具有寡腺苷酸合成酶的特性[7]。Hassan 等[8]2018年对鸭、鹅和鸵鸟的OAS基因进行了功能分析,结果证实鸭、鹅和鸡的OASL一样,既具有寡腺苷酸合成酶特性,又具有不依赖于寡腺苷酸合成酶的抗黄病毒特性;而鸵鸟的OASL只具有抗黄病毒特性,不具有OAS1蛋白的寡腺苷酸合成酶特性。在哺乳动物OAS家族蛋白抗病毒研究中,一些学者证实OAS蛋白可以激活受体内切核糖核酸酶L(Endoribonuclease L,RNase L),二者结合后可以通过OAS/RNaseL途径实现抗病毒的作用,进而降解感染细胞中的RNA,有效阻止RNA病毒的复制(图1)[9],该信号通路在宿主控制黄病毒、呼肠孤病毒、脑心肌炎病毒和流感病毒的先天性免疫反应中起重要作用[10-12]。此外,鸭OASL蛋白C端泛素化样结构域与人OASL蛋白相似性高达96.2%[13],而人OASL蛋白C端泛素化结构域是RIG-I信号通路激活的关键区域(图2)[14]。2015 年,Ibsen等[15]证实人OASL 蛋白C端泛素化结构域可以取代K63连接的多泛素化链与RIG-I蛋白的CARDs结构域结合,N端寡腺苷酸合成酶样结构域具有一个结合dsRNA的凹槽,二者协同作用不仅可以检测病毒RNA,还可以激活RIG-I信号通路,对病毒RNA具有监测和抑制作用。之后,Alcorn 等[16]也证实哺乳动物OASL蛋白具有抵抗流感病毒NS1 蛋白介导的免疫逃逸潜力,同时,不像RIG-I蛋白,过表达的OASL蛋白不会激活干扰素因子,进而不会产生对宿主有毒副作用的其他产物。Dhar等[17]也发现哺乳动物OASL蛋白能够克服呼吸道合胞体病毒NS1介导的免疫逃逸,实现对病毒复制的抑制。BI等[13]通过鸭OASL蛋白过表达和干扰表达在细胞学水平证实其可以抑制鸭坦布苏病毒的复制。HU等[18]通过对数据库中已有动物OAS家族蛋白序列及结构进行系统分析后发现,即使没有dsRNA刺激,古老的OAS蛋白也具有2—5和3—5寡腺苷酸合成酶特性。然而受进化压力影响,高等后生动物OAS蛋白与dsRNA的亲和能力增强并且仅具有2—5寡腺苷酸合成酶特性,研究结果为后生动物体内OASs的功能研究提供新的思路。Wang等[19]通过分子克隆技术获得了猪OASL基因全长,序列分析表明,该基因C端不具有泛素化区域。通过RNAi沉默和过表达表明,猪OASL基因N端31—60氨基酸序列是抗病毒复制的关键区域。Yao等[20]通过分子克隆技术获得了树鼩OAS家族全部基因,分析表明树鼩OAS家族有OAS1、OAS2、OASL1和OASL2四个基因,OAS1和OAS2具有抗病毒特性,而OASL1和OASL2不具有抗病毒特性。【本研究切入点】尽管从分子生物学角度掌握了鸭OASL蛋白的结构特点并发现其有抗病毒复制的特性,但其抗病毒分子机制仍然是一片空白,而且在其它禽类研究中也无相关报道。【拟解决的关键问题】本研究基于前期获得的OASL基因全长,通过RT-PCR扩增、载体构建和蛋白纯化等方法获得带有GST标签的OASL融合蛋白,并通过免疫方法获得鸭OASL蛋白多克隆抗体,为进一步研究鸭OASL蛋白抗病毒复制机理奠定基础。
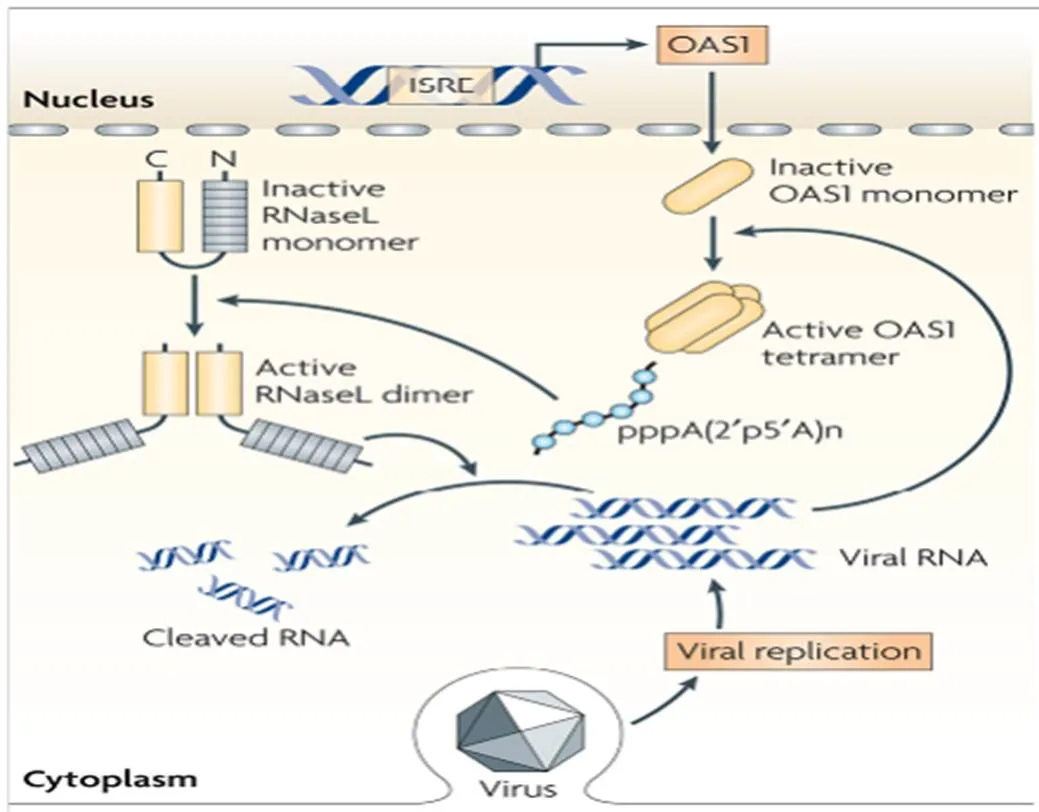
图1 OAS蛋白介导的OAS/RNase L抗病毒途径

图2 OASL蛋白介导的RIG-I信号通路的增强
1 材料与方法
1.1 试验材料
动物总RNA提取试剂盒购自Omega公司,樱桃谷鸭幼鸭、含有GST标签的原核表达载体pGEX-4t-1和大肠杆菌BL21(PLYSS)TM为江苏省农业科学院兽医研究所家禽重大疫病防控项目组保存提供;限制性内切酶H I和I购自宝生物工程(大连)有限公司;DNA聚合酶购自日本Toyobo公司;琼脂糖凝胶回收试剂盒、小量提取质粒试剂盒、无缝克隆试剂盒、鼠源GST标签抗体、辣根过氧化物酶标记山羊抗小鼠IgG和ECL发光液均购自北京全式金生物技术有限公司;新西兰白兔购自江苏省农科院种兔场;其他试剂均为进口分装或国产分析纯。所有试验均在江苏省农业科学院兽医研究所家禽重大疫病防控研究室完成。
1.2 PCR扩增
2017年4月,根据已经获得的鸭OASL基因ORF序列设计原核表达PCR扩增引物pGEX-OAS-F:5′-G GATCTGGTTCCGCGTGGATCCATGGAGCTGTGGA ACGTGTC-3′和pGEX-OAS-R: 5′-CAGTCACGATGC GGCCGCTCGAGTCAGGAGGACGGGCAGCCG-3′,以江苏省农业科学院兽医研究所动物房养殖的樱桃谷鸭幼鸭脾脏cDNA为模板进行PCR扩增,PCR 反应体系50 μL:33 μL 灭菌水,5 μL 10×Buffer,5 μL dNTPs(2 mmol·L-1),3 μL Mg2+,1 μL 脾脏cDNA,1 μL正反向引物,1 μL KOD-Plus-neo。PCR条件:94 ℃ 2min;98 ℃ 10 s、68 ℃ 1min(30个循环);68℃ 7min。扩增产物经1%琼脂糖凝胶电泳,然后利用胶回收试剂盒回收目的条带。
1.3 重组表达质粒构建与鉴定
将目的条带和带有GST标签的pGEX-4t-1载体分别用H I和I双酶切,酶切产物用无缝克隆试剂盒37℃反应45 min,转化到BL21(PLYSS)TM感受态细胞中,构建重组表达质粒pGEX-4t-1-OASL。经菌落PCR鉴定后,挑选阳性重组表达质粒送上海英俊公司测序。
1.4 OASL融合蛋白诱导表达与蛋白分析
鉴定过的重组表达菌株接种于5 mL LB培养基(含50 μg·mL-1氨苄霉素)中,37℃培养过夜,次日取50 μL接种于5 mL的LB培养基(含50 μg·mL-1氨苄霉素)中,37℃震荡培养至菌液浓度OD600达0.4—0.7左右时,取出1 mL作对照,剩余部分加入IPTG至终浓度为0.5 mmol·L-1进行诱导,诱导4 h后收菌液,诱导后的菌液分别经12 000 r/min离心5 min,弃上清,沉淀用菌体裂解液垂悬,超声波破碎30 min,取50 μL破碎混合液后剩余液体12 000 r/min离心5 min,上清液转移到新离心管中,沉淀用PBS重悬,诱导前混合液、诱导后破碎混合液、上清和沉淀分别与4×蛋白电泳上样缓冲液混匀,沸水浴5 min后经SDS-PAGE和Western-bloting检测蛋白表达情况。
1.5 OASL融合蛋白的纯化
鉴定过的重组表达菌株接种于5 mL LB培养基(含50 μg·mL-1氨苄霉素)中,37℃培养过夜,次日取50 μL接种于5 mL的LB培养基(含50 μg·mL-1氨苄霉素)中,37℃震荡培养至菌液浓度OD600达0.4—0.7左右时,取出1 mL作对照,剩余部分加入IPTG至终浓度为0.5 mmol·L-1进行诱导,诱导4 h后收菌液,超声破碎,将上清用0.45 μm滤膜过滤后加入GST亲和层析柱中,洗脱液洗脱后将收集的蛋白溶液加入透析袋中,对未纯化的蛋白、透出液及洗脱液进行SDS-PAGE分析,检测目的蛋白的纯化效果,并用BCA法测定纯化蛋白的浓度。
1.6 OASL融合蛋白多克隆抗体的制备
用纯化和测定的OASL 重组蛋白先后3次皮下多点注射免疫新西兰大白兔。第一次免疫采用弗氏完全佐剂和蛋白样品按1﹕1混合,超声破碎仪乳化后免疫,蛋白免疫量为每只400 μg。二周以后二免,纯化的蛋白与不完全弗氏佐剂等量乳化后免疫,间隔一周后加强免疫,最后一次免疫后的14 d,心脏采血收集血清。
1.7 OASL融合蛋白多克隆抗体的纯化与鉴定
将蛋白OASL与琼脂糖介质偶联制备成抗原亲和纯化层析柱,将所得抗血清与PBS等量混合后缓慢上样,待抗体结合后用甘氨酸洗脱缓冲液洗脱,即得到所需纯化抗体,立即在PBS溶液中进行4℃透析过夜,隔日通过ELISA检测纯化抗体的效价,利用BCA 法测定纯化蛋白的浓度,通过SDS-PAGE电泳观察纯化抗体的纯度。
2 结果
2.1 鸭全长OASL基因扩增和重组表达质粒pGEX- 4t-1-OASL的鉴定
经RT-PCR扩增后,取3 μL扩增产物进行琼脂糖凝胶电泳分析,在溴化乙锭染色后的凝胶上清晰可见1 500 bp左右的单一条带(图3),与预计结果相符。重组表达质粒经菌落PCR鉴定后,8个菌落中有3个含有目的基因,在接近2 000 bp处有明亮且单一的条带(图3)。3个菌落转移至LB液体培养基扩大培养,菌液经小量提取质粒试剂盒提取质粒DNA,上海英俊公司测序后确定序列全长为1 512 bp,与目的条带大小一致。证明OASL基因成功连接到pGEX-4t-1载体上,并且筛选出的菌株为阳性菌株。
2.2 融合蛋白诱导表达与蛋白分析
SDS-PAGE分析发现,经IPTG诱导4 h后融合蛋白主要在上清液中表达,蛋白分子量大小与理论分子量大小83.58 kD相同,IPTG诱导前未见该蛋白条带(图4-A)。Western blotting分析结果与SDS-PAGE结果一致,IPTG诱导前没检测到融合蛋白,IPTG诱导4 h后,混合液中融合蛋白含量最高,上清次之,沉淀最少(图4-B),进一步证明GST标签的鸭OASL蛋白主要以可溶性形式存在,但也有少数的包涵体蛋白。
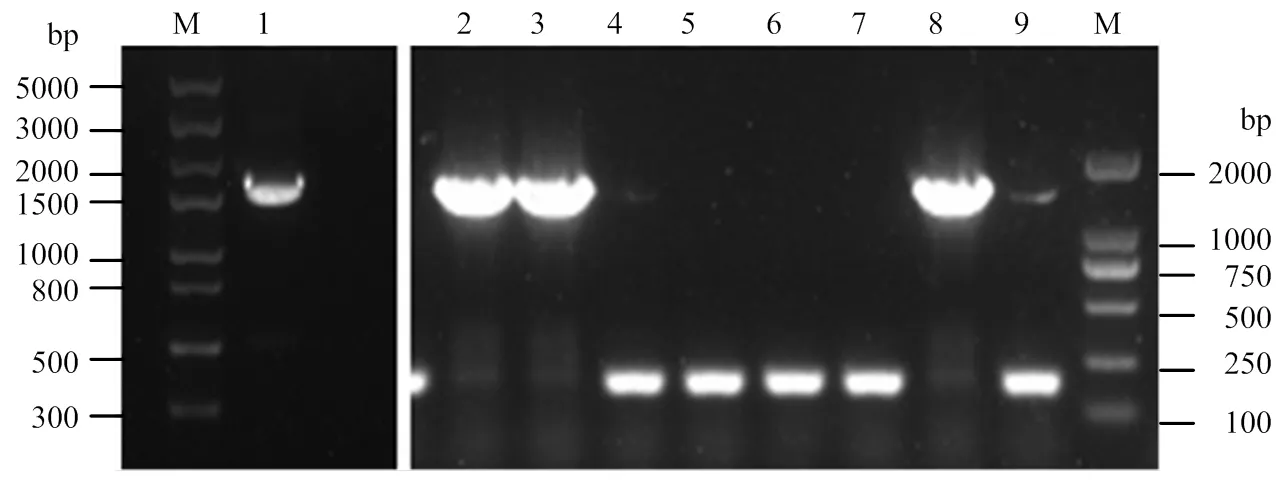
M:左Left:Trans5K DNA marker,右Right:Trans2K DNA marker; 1:RT-PCR; 2-9:菌落PCR Colony PCR

M:蛋白marker;1:IPTG诱导前;2:IPTG诱导后全菌;3:IPTG诱导后沉淀;4:IPTG诱导后上清
2.3 融合蛋白的纯化
鉴定过的重组表达菌株经过扩大体积培养后,将所获菌体进行超声破碎,离心后取上清液,用GST标签亲和层析柱对上清液中的可溶性目的蛋白进行富集,多次洗涤除去多余杂蛋白,最后用GST Elution- Buffer(20 mmol·L-1Tris-HCl,50 mmol·L-1GSH,0.15 mol·L-1NaCl,pH8.0)以1 mL·min-1流速洗脱目的蛋白,收集流出液,上述收集的蛋白溶液加入透析袋中,使用20 mmol·L-1Tris-HCl,0.10 mol·L-1NaCl,pH8.0进行透析过夜,经12%的SDS-PAGE 胶电泳检测,在83 kD附近获得一条明显条带,其分子量大小与理论值相符,同时洗脱液中蛋白所含杂带较少,说明获得纯度较高的目的蛋白(图5)。将目的蛋白用BCA法测定其浓度达0.5 mg·mL-1,作为免疫动物的抗原。

M:蛋白marker; 1:未纯化重组蛋白;2:流出液;3:洗脱液
2.4 多克隆抗体的鉴定
OASL蛋白通过抗原亲和纯化层析柱纯化后,经SDS-PAGE检测可见55 kD左右有一明亮单一的目的条带,与预期结果一致(图6)。结果表明,纯化后的多克隆血清纯度较高。ELISA 方法检测结果显示,重组OASL蛋白浓度为5 μg·mL-1时,OASL家兔多克隆血清效价为1:512 000。

图6 抗体SDS-PAGE检测
3 讨论
寡腺苷酸合成酶(oligoadenylate synthase,OAS)是干扰素诱导机体产生的一种重要抗病毒蛋白,在宿主先天性免疫、信号转导等过程中发挥重要的作用。该酶最早在干扰素处理后的人体细胞中发现,而后在哺乳动物、鸟类和低等生物如海绵动物体内也陆续被发现和报道[21-22]。OAS家族蛋白包括OAS1、OAS2、OAS3和OASL等4个成员,OAS1、OAS2、OAS3和OASL均有核苷酸转移酶结构域(nucleotidyl transferase,NTase),但各有1、2、3和1个OAS 结构域,OASL比起其他3个成员在C 端多了两个泛素样结构域(ubiquitin-like,UBL)(图7)[23],该泛素化区可以与RIG-I蛋白结合,进而激活RIG-I信号通路,实现对病毒增殖的抑制,该结果已经在人、鼠和猪OASL蛋白研究中证实[24-27]。OAS2和OAS3蛋白仅分布在哺乳动物中,OAS1和OASL蛋白广泛分布于各种动物体内[28]。人的OASL基因和鸡的OASL基因有很高的同源性,但是鸡的OASL蛋白却具有很强的酶活性[29]。前期的研究表明,鸭OASL蛋白与其他已报到的禽类OASL蛋白具有很高的同源性,N端的NTase结构域和寡腺苷酸合成酶样结构域都有保守的P-loop、D-box、LIRL、YALELLT、RPVILDPADP区及关键的赖氨酸和精氨酸,这些序列保守区对寡腺苷酸合成酶活性的发挥起着决定性作用[13]。在细胞学水平,通过体外试验证实鸭OASL蛋白能够抑制鸭坦布苏病毒的复制,但在体内,由于缺少相应蛋白的特异性抗体,所以,当鸭被病毒感染后,无法从蛋白质水平对DuOASL进行监测和分析。本试验基于前期获得鸭脾脏cDNA文库,利用RT-PCR方法将鸭OASL基因成功克隆到高效表达载体pGEX-4t-1中进行表达,通过改变诱导剂IPTG 的用量和诱导时间找到表达量最高的条件,对OASL蛋白进行分离纯化,免疫家兔,获得抗OASL的多克隆血清,经间接ELISA 鉴定,多抗血清抗体效价较高,同时,原核表达的OASL融合蛋白具有GST标签抗体,为今后从DuOASL蛋白水平监测鸭被病毒感染状况和从蛋白水平筛选与DuOASL蛋白互作的病毒蛋白奠定物质基础。

图7 OAS 家族的保守蛋白结构域和保守氨基酸区域
4 结论
通过原核表达技术获得了带有GST标签的鸭寡腺苷酸合成酶样蛋白融合蛋白,蛋白纯度是0.5 mg·mL-1。通过免疫学方法获得了鸭寡腺苷酸合成酶样蛋白多克隆抗体,抗体效价为1:51 200。
[1] ZHU J, ZHANG Y, GHOST A, CUEVAS R, FORERO A, DHAR J, IBSEN M, COYNE C, SARKAR S. Antiviral activity of human OASL protein is mediated by enhancing signaling of the RIG-I RNA sensor., 2014, 40(6): 936- 948.
[2] TATSUMI R, HAMADA K, SEKIYA S, WAKAMATSU M, NAMIKAWA T, MIZUTANI M, SOKAWA Y. 2′,5′-oligoadenylate synthetase gene in chicken: gene structure, distribution of alleles and their expression., 2000, 1494:263-268.
[3] TAG-EL-DIN-HASSAN H, SASAKI N, TORIGOE D, MORIMATSU M, AGUI T. Analysis of the relationship between enzymatic and antiviral activities of the chicken oligoadenylate synthetase-like., 2017, 37: 71-80.
[4] TAG-EL-DIN-HASSAN H, SASAKI N, MORITOH K, TORIGOE D, MAEDA A, AGUI. The chicken 2′-5′ oligoadenylate synthetase A inhibits the replication of West Nile virus., 2012, 60: 95-103.
[5] YANG C, LIU F, CHEN S, WANG M, JIA R, ZHU D, LIU M, SUN K, YANG Q, WU Y, CHEN Y, CHENG A. Identification of 2′-5′-oligoadenylate synthetase-like gene in goose: gene structure, expression patterns, and antiviral activity against Newcastle Disease Virus., 2016, 36: 563-572.
[6] HAN K, ZHAO D, LIU Y, LIU Q, HUANG X, YANG J, AN F, LI Y. Quantitative proteomic analysis of duck ovarian follicles infected with duck tembusu virus by Label-Free LC-MS.2016, 7:463. doi: 10.3389/fmicb.2016.00463.
[7] 毕可然,韩凯凯,李银,刘青涛,赵冬敏,刘宇卓,黄欣梅,杨婧. 樱桃谷鸭OASL基因全长cDNA的克隆及其生物信息学分析. 江苏农业学报, 2017, 33(2): 373-378.
BI K R, HAN K K, LI Y, LIU Q T, ZHAO D M, LIU Y Z, HUANG X M, YANG J J. Cloning and bioinformatics analysis of cherry valley duck oligoadenylate synthase-like gene (OASL)., 2017,33(2): 373-378. (in Chinese)
[8] HASSAN T, TAG-EL-DIN-HASSANA H, MASAMI M, TAKASHI A. Functional analysis of duck, goose, and ostrich 2′-5′-oligoadenylate synthetase., 2018 (62): 220-232.
[9] ANTHONY J, BRYAN R. Interferon-inducible antiviral effectors., 2008, 8(7): 559–568.
[10] ZHAO J, FENG N, LI Z, WANG P, QI Z, LIANG W, ZHOU X, XU X, LIU B. 2′,5′-Oligoadenylate synthetase 1(OAS1) inhibits PRRSV replication in Marc-145 cells., 2016, 132: 268-273.
[11] DEO S, PATEL T, DZANANOVIC E, BOOY E, ZEID K, MCELENEY K, HARDING S, MCKENNA S. Activation of 2’ 5’-oligoadenylate synthetase by stem loops at the 5’-end of the West Nile virus genome.,2014, 9(3), e92545.
[12] MELCHJORSEN J, KRISTIANSEN H, CHRISTIANSEN R, RINTAHAKA J, MATIKAINEN S, PALUDAN S, HARTMANN R. Differential regulation of the OASL and OASl genes in response to viral infections., 2009, 29(4):199-208.
[13] BI K, HAN K, LIU Q, ZHAO D, HUANG X, LIU Y, YANG J, LI Y. Molecular cloning, characterization, and expression of duck 2′-5′-oligoadenylate synthetase-like gene.2017, 629:43-51.
[14] ZHU J, ARUNDHATI G, SAUMENDRA N. OASL-a new player in controlling antiviral innate immunity., 2015, 12:15-19.
[15] IBSEN M, GAD H, ANDERSEN L, HOUNUNG V, JULKUNEN I, SARKAR S, HARTMANN R. Structural and functional analysis reveals that human OASL binds dsRNA to enhance RIG-I signaling., 2015, 43(10): 5236-5248.
[16] ALCORN J, SARKAR S. What is the oligoadenylate synthetases-like protein and does it have therapeutic potential for influenza?2015, 9(1):1-3.
[17] DHAR J, CUEVAS R, GOSWAMI R, ZHU J, SARKAR S, BARIK S. 2'-5'-Oligoadenylate synthetase-like protein inhibits respiratory syncytial virus., 2015, 89(19):10115-10119.
[18] HU J, WANG X, XING Y, RONG E, NING M, SMITH J, HUANG Y. E. Origin and development of oligoadenylate synthetase immune system., 2018, 18: 201.
[19] WANG R, YU Y, KONG W, LIA C, KANG Y, WANG G, HE J, ZHAO M. Molecular cloning of porcine 2′,5′-oligoadenylate synthetase-like protein and its role in porcine reproductive and respiratory syndrome virus infection., 2018, 125: 281-289.
[20] YAO Y, YU D, XU L, FAN Y, WU Y, GU T, CHEN J, LV L, YAO Y. Molecular characterization of the 2′,5 -oligoadenylate synthetase family in the Chinese tree shrew ()., 2019, 114: 106-114.
[21] SCHRÖDER H C, NATALIO F, WIENS M, TAHIR M N, SHUKOOR M I,TREMEL W, BELIKOV S I, KRASKO A, MÜLLER W E G. The 2′-5′-oligoadenylate synthetase in the lowest metazoan: isolation, cloning, expression and functional activity in the sponge, 2008, 45(4): 945-953.
[22] KRISTIANSEN H, GAD H, ESKILDSEN-LARSEN S, DESPRES P, HARTMANN R. The oligoadenylate synthetase family: an ancient protein family with multiple antiviral activities., 2011; 31(1):41-47.
[23] 杨超,陈舜,汪铭书,程安春. OAS蛋白结构与抗病毒机制关系的研究进展. 中国预防兽医学报, 2017, 39(8):682-685.
YANG C, CHEN S, WANG M S, CHENG A C. Advances in the study of the relationship between the structure of OAS protein and the antiviral mechanism.2017, 39(8):682-685. (in Chinese)
[24] LI L, YU J, ZHANG Y, YANG Q, LI Y, ZHANG L, WANG J, LI S, LUO Y, SUN Y, QIU H. Interferon-inducible oligoadenylate synthetase-like protein acts as an antiviral effector against classical swine fever virus via the MDA5-mediated type I interferon signaling pathway., 2017, 91(11): e1514-1516.
[25] 朱丹. 猪源OAS抗日本脑炎病毒感染的活性研究[D]. 南京:南京农业大学, 2014.
ZHU D. Investigation on antiviral effect of porcine 2′-5′ oligoadenylate synthetases on JEV replication[D]. Nanjing : Nanjing Agricultural University, 2014. (in Chinese)
[26] CHOIU, KANG J, HWANG Y, KIM Y. Oligoadenylate synthase-like (OASL) proteins: dual functions and associations with diseases., 2015, 47: e144.
[27] LEE M, KIM B, OH G, KIM Y. OASL1 inhibits translation of the type I interferon-regulating transcription factor IRF7., 2013, 14: 346-355.
[28] KJAER K, POULSEN J, REINTAMM T, SABY E, MARTENSEN P, KELVE M, JUSTESEN J. 2009. Evolution of the 2′-5′-oligoadenylate synthetase family in eukaryotes and bacteria., 69:612-624.
[29] TORSHIN I. Three-dimensional models of human 2′-5′-oligoadenylate synthetases: a new computational method for reconstructing an enzyme assembly. Medical science monitor: international medical journal of experimental and clinical research, 2005, 11(7): 235-247.
Prokaryotic Expression and Polyclonal Antibody Preparation of Duck Oligoadenylate Synthase-Like Protein
BI KeRan1,2, LI Yin1, HAN KaiKai1, ZHAO DongMin1, LIU QingTao1, LIU YuZhuo1, HUANG XinMei1, YANG Jing1
(1Institute of Veterinary Medicine, Jiangsu Academy of Agricultural Sciences/Key Laboratory of Veterinary Biological Engineering and Technology, Ministry of Agriculture, Nanjing 210014;2College of Marine Life and Fisheries, Jiangsu Ocean University, Lianyungang 222005, Jiangsu)
【】In previous study, we have obtained the full-length gene of duck oligoadenylate synthase-like protein (duOASL) and confirmed that duOASL could inhibit DTMUV replication. To further investigate the inhibitory effect of duOASL on DTMUV replication, the recombinant protein (pGEX-OASL) with GST tag and polyclonal antibody of duOASL protein was obtained by prokaryotic expression and polyclonal antibody preparation technology. These results would lay a foundation for performing further studies to determine mechanism(s) underlying the antiviral activity duOASL at the molecular level. 【】Primers were designed based on the ORF sequence of duOASL gene from healthy Cherry Valley ducks. Total RNA was extracted from the spleen tissues of duckling by using HP Total RNA kits. The cDNA was synthesized using random primers and M-MLV reverse transcriptase. Full-length of duOASL gene was obtained by synthesising pGEX-OAS-F and pGEX-OAS-R primers by using the cDNA. The PCR results were detected by 1.5% agarose electrophoresis. The sequences of the same size as the target band were purified and cloned to pEASY-T1 vector. The cloned gene ORF was inserted into the expression vector pGEX-4t-1 with GST tag and byH I andI digestion. The recombinant plasmid was transformed intoBL21 and expressed under the induction with 0.5 mmol·L-1IPTG for 4 h. The expression of the fusion protein was detected by SDS-PAGE and Western-blotting. Then the polyclonal antibody was obtained from rabbits which had immunized by the purified duOASL recombinant protein. The purity and titer of the polyclonal antibody were determined by SDS-PAGE and ELISA.【】The recombinant protein was a soluble protein and the molecular weight was 84 kD. The purity was 0.5 mg·mL-1. The antibody titer of polyclonal antibodies was 1:512 000.【】Above results would lay a foundation for further studies of duOASL inhibiting DTMUV replication.
OASL; prokaryotic expression; polyclonal antibody

10.3864/j.issn.0578-1752.2019.23.024
2019-04-23;
2019-07-22
国家重点研发计划项目(2017YFD0500800)、江苏省自然科学基金项目(BK20160064)、国家博士后基金项目(2016M590430)、江苏省农业科技自主创新资金项目(CX(15)1008)
毕可然,Tel:15896101504;E-mail:bikeran@126.com。
李银,Tel:13512510567;E-mail:muziyin08@163.com
(责任编辑 林鉴非)
- 中国农业科学的其它文章
- 加强分子生物学研究,促进苹果产业持续发展

