KDM1A在牦牛卵泡发育过程中的表达
黄向月,熊显荣,韩杰,杨显英,王艳,王斌,李键
KDM1A在牦牛卵泡发育过程中的表达
黄向月1,熊显荣2,韩杰1,杨显英1,王艳1,王斌1,李键1
(1西南民族大学生命科学与技术学院,成都 610041;2青藏高原动物遗传资源保护与利用国家教育部重点实验室,成都 6100041)
【目的】分析牦牛卵泡发育过程中组蛋白赖氨酸脱甲基酶1(lysine-specific histone demethylase 1A,KDM1A)基因的表达谱,探讨KDM1A对牦牛卵泡发育和卵母细胞成熟的影响。【方法】以牦牛卵泡为研究对象,根据卵泡直径的大小,将卵泡分为3组:大(6.0—9.0 mm)、中(3.0—5.9 mm)、小(1.0—2.9 mm)卵泡,收集各组别卵泡中卵丘-卵母细胞复合体(cumulus-oocyte complex, COCs)进行体外培养,对不同发育阶段卵泡中卵母细胞的体外成熟率进行统计并分析;分别提取各组卵泡卵母细胞及壁层颗粒细胞总RNA,通过实时荧光定量PCR(quantitative real-time RCR, RT-qPCR)方法,检测KDM1A基因在不同发育阶段的卵泡中mRNA相对表达量的变化;采用免疫组织化学技术检测KDM1A在牦牛卵泡发育过程中的细胞定位及表达规律,并结合体外成熟与RT-qPCR结果进行关联性分析。【结果】各组卵母细胞体外成熟率与卵泡直径的大小呈显著正相关关系,其伴随卵泡发育的进行呈明显的上升趋势,其中大、中、小卵泡组的体外成熟率依次分别为90.53 %、88.10 %、55.14 %。RT-qPCR结果显示,KDM1A基因在牦牛卵泡发育过程中均有表达,且不同发育阶段的mRNA表达水平差异显著,其中大、中卵泡时期的卵母细胞中的mRNA相对表达量显著低于小卵泡时期(< 0.05),而在小卵泡时期的壁层颗粒细胞中的相对表达量极显著低于大、中卵泡时期 (< 0.01),在大、中卵泡时期的卵母细胞及壁层颗粒细胞中该基因mRNA表达水平均无差异(> 0.05)。免疫组织化学研究发现KDM1A在大、中、小卵泡壁层颗粒细胞以及膜细胞中均表达,其蛋白表达趋势与RT-qPCR结果吻合,即随着发育时间的进行KDM1A表达水平呈上升趋势,其中在大卵泡时期KDM1A的表达量最高。【结论】在牦牛不同发育时期卵泡的卵母细胞及壁层颗粒细胞中KDM1A mRNA及蛋白的表达水平呈动态变化,提示KDM1A在卵泡发育及卵母细胞成熟过程中发挥重要作用。这可能与卵母细胞的减数分裂及颗粒细胞的增殖分化有关,本研究为进一步研究该基因在牦牛卵母细胞减数分裂过程中的作用机制提供基础数据。
牦牛;1;免疫组化;卵泡;表达
0 引言
【研究意义】牦牛()是青藏高原特有的畜种,主要生活在海拔3 000—6 000 m的高寒地区。牦牛是牛属动物中对低氧环境具有较强适应能力的动物之一,有“高原之舟”之称[1]。但牦牛性成熟晚,繁殖性能低下,已成为阻碍牦牛产业及高原人民经济发展的主要因素之一。为此,开展牦牛的繁殖、生产性能等相关研究对提高牧区的生活水平和丰富中国遗传资源多样性具有重要意义[2]。【前人研究进展】卵泡与卵母细胞的发育成熟是影响哺乳动物繁殖效率的因素之一[3]。卵泡发育始于胎儿时期,而卵母细胞的最终成熟发生在初情期以后[4]。且其生长和发育与卵泡的发育进程同步,受周围体细胞(颗粒细胞等)及各种激素的功能活动影响。这些细胞通过间隙连接调节相关激素、蛋白质、代谢物和调节分子,从而促进卵母细胞的发育和成熟[5]。此过程伴随着表观遗传变化。例如,组蛋白H3和H4在减数分裂成熟过程中脱乙酰化,并且H3K4和H3K9甲基化在减数分裂早期表现出动态变化[6-7]。组蛋白赖氨酸甲基化修饰是一个动态的、可逆过程,分别由赖氨酸甲基化转移酶(KTMs)和去甲基化酶(KDMs)两个家族催化完成,KDM1A是组蛋白赖氨酸脱甲基酶家族的成员之一。KDM1A是一个黄素腺嘌呤二核苷酸(Flavin adenine dinucleotide, FAD)依赖性胺氧化酶,可特异性脱去组蛋白H3K4me1/2和H3K9 me1/2的甲基。KDM1A又名LSD1、KIAA0601、p110b、BHC110、NPAO,结构分析显示KDM1A含有SWIRM、Tower以及FAD依赖的单胺氧化酶等结构域[8-9]。功能研究表明,KDM1A定位于细胞核内,通过激活或抑制相关基因的转录,在肿瘤发生和胚胎发育过程中均起着重要的作用[10]。近期研究表明KDM1A蛋白及其mRNA在小鼠的各个组织中广泛表达,该基因通过参与相关基因转录激活、染色质调节[11-12]等机制调控相关信号通路来发挥其生物学功能,例如,在小鼠生殖系统中KDM1A主要通过调节周期蛋白的表达来间接调控生殖细胞减数分裂活动[13]。【本研究切入点】目前对KDM1A基因的研究主要在人、小鼠以及斑马鱼等动物的癌症及胚胎方面[14-17],而该基因在牦牛方面的研究还未见相关报道。【拟解决的关键问题】为阐明KDM1A基因在牦牛卵泡及卵母细胞发育过程中的作用,以牦牛卵泡为研究对象,利用RT-qPCR和免疫组化方法检测KDM1A在卵泡和卵母细胞发育过程中的表达规律,并通过体外培养体系统计不同发育阶段卵泡中卵母细胞的体外成熟率,结合RT-qPCR与免疫组化结果进行关联性分析,为解析KDM1A在牦牛卵泡发育及卵母细胞的成熟过程中的作用机制奠定基础。
1 材料与方法
1.1 主要试剂与仪器
微量RNA提取试剂盒(Single Cell-to-CtTMKit)、Trizol Reagent购自Invitrogen(美国)公司,SYBR® Premix Ex TaqTMⅡ试剂盒,PrimeScriptTMRT Reagent Kit反转录试剂盒、Premix TaqTMDNA聚合酶均购自TaKaRa(大连)公司,胎牛血清(FBS)、Medium培养基购自Gibco公司,雌二醇、促黄体素(LH)、促卵泡生成素(FSH)等购自Sigma公司。荧光定量PCR仪、电泳仪和琼脂糖凝胶成像系统均购自美国Bio-Rad公司,核酸浓度测定仪购于日本岛津。卵母细胞成熟液:M199+10 % FBS+0.01 μg·L-1FSH+0.01 μg·L-1LH+0.001 μg·L-1E2+0.02 ng·L-1EGF。
1.2 样本采集及处理
样本均采自成都青白江屠宰场,采集健康的牦牛卵巢。无菌生理盐水冲洗后将采集的卵巢分为2份进行处理。第一份用4%多聚甲醛固定运回实验室置于4 ℃备用。第二份投入含Ga2+、Mg2+的生理盐水(含双抗),37 ℃保存。运回实验室用生理盐水清洗3次,将卵泡根据卵泡直径大小分成3组:大(6.0—9.0 mm)、中(3.0—5.9 mm)、小(1.0—2.9 mm)卵泡,抽取卵泡液,并置于90 mm的平皿中,在显微镜下收集卵丘-卵母复合体(Cumulus-oocyte complex, COCs),卵母细胞成熟液清洗3次。其中收集每组各10个COCs用0.2%透明质酸酶分离得到卵母细胞,并收集各组卵泡液,离心后吸去血细胞,PBS清洗两次,得到卵泡壁层颗粒细胞,-80 ℃保存备用。剩余COCs用于体外成熟培养,以便进行后续研究。
1.3 卵母细胞体外培养及成熟率观察
挑选各组卵丘细胞3层以上、形态正常的COCs分别置于含35 mm成熟液的培养皿中,在含5.5%的CO2,38.5 ℃饱和湿度的培养箱中体外培养。成熟培养24 h后,在显微镜下观察卵丘细胞的发散情况,将COCs经0.2%透明质酸酶中消化2—3 min,之后用移液枪吹打去除卵丘细胞,通过观察是否有第一极体的排出来判定其成熟情况。
1.4 卵母细胞及壁层颗粒细胞总RNA的提取及检测
Trizol法提取卵泡壁层颗粒细胞RNA,DEPC水处理后应用核酸分析仪检测浓度和OD值,选取OD值在1.8—2.0之间的RNA作为模板。按照PrimeScriptTMRT Reagent Kit反转录试剂盒说明书合成cDNA,并使用GAPDH基因的特异性引物检测cDNA的质量,将琼脂糖凝胶电泳结果显示单一清晰条带的cDNA置于-20℃保存备用。按照Single Cell-to-CTTMKit试剂盒说明书直接将分离得到的各组卵母细胞合成cDNA,-20℃保存。
1.5 引物设计及合成
根据NCBI已报道的野牦牛()1(GenBank登录号:XM_005905175.2)和mRNA序列(GenBank登录号:AC_000162.1),使用Primer 5.0分别设计引物(表1)。由南京金斯瑞生物科技有限公司合成。
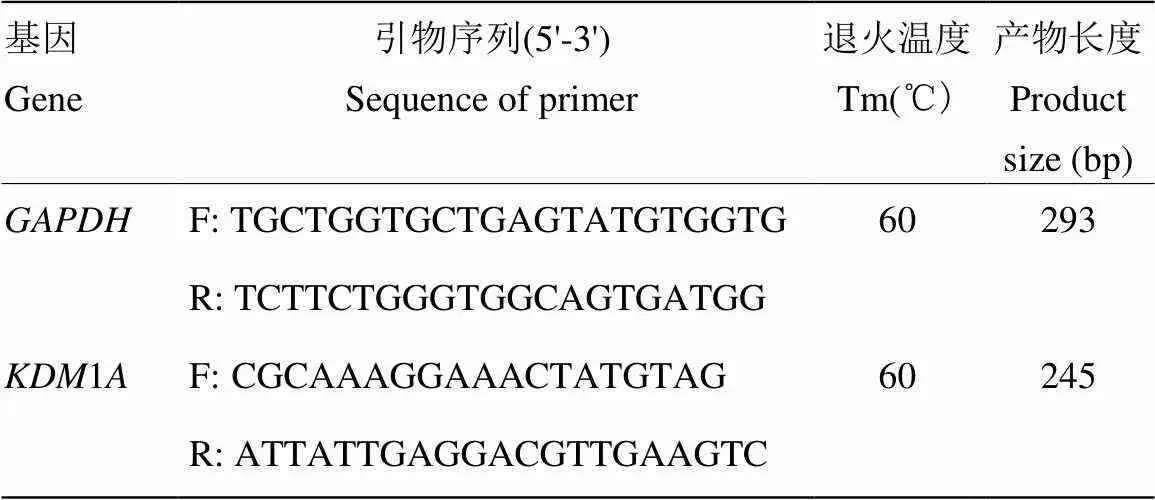
表1 引物信息
F:正向引物;R:反向引物 F: Forward primer; R: Reverse primer
1.6 卵母细胞及壁层颗粒细胞中KDM1A表达分析
采用RT-qPCR检测KDM1A基因在牦牛不同发育阶段卵泡卵母细胞及壁层颗粒细胞中的表达。RT-qPCR反应体系为15 μL,其中SYBR®Premix Ex TaqTMⅡ7.5 μL,cDNA 1.0 μL,ddH2O 5.5 μL,上、下游引物(10 μmol·L-1)各0.5 μL;PCR扩增条件:预变性94℃,4 min,变性94℃,45 s,退火60℃,1 min,72℃,延伸1 min,35个循环,72℃ 7 min。用2-△△Ct法对定量结果进行均一化处理。
1.7 免疫组化分析
利用免疫组化染色法检测KDM1A蛋白的表达。将卵巢组织从4 %的多聚甲醛固定液中取出,制成石蜡切片。脱水后置0.88 mol·L-1H2O2中封闭,0.01 mol·L-1PBS(pH7.4)冲洗3次;5 %胎牛血清封闭,滴加一抗(多克隆兔抗KDM1A,BSA100倍稀释,Abcam公司产品)4 ℃孵育过夜;PBS冲洗3次后滴加二抗(多聚化山羊抗兔IgG,康为世纪公司产品)37 ℃孵育2 h;PBS冲洗后加入DAB显色,经过苏木精复染后,脱水、透明、封片,显微镜下观察。图片利用Image-Pro Plus 6.0进行相对平均光密度分析。
1.8 数据分析
每组试验至少重复3次,所有试验数据使用“平均值±标准误(Mean ± SEM)”表示。采用SPSS软件进行显著性分析,<0.01差异极显著,<0.05差异显著。
2 结果
2.1 不同发育程度卵泡中卵母细胞的成熟
对不同发育阶段卵泡中卵母细胞进行体外成熟培养及成熟率统计分析,结果显示,中卵泡时期的卵母细胞,卵丘细胞明显多于小卵泡期,而大卵泡期的卵丘细胞不如中卵泡期致密,部分卵母细胞老化。体外培养大、中、小卵泡中卵母细胞的成熟率依次分别为90.53 %、88.10 %和55.14 %,其中,以小卵泡时期作为参照,大、中卵泡卵母细胞成熟率约为小卵泡成熟率的1.6倍(< 0.01),而大、中卵泡的成熟率相比较差异不显著(> 0.05)。
2.2 不同发育阶段卵泡中KDM1A的表达
利用RT-qPCR,以内参基因作为参照,检测KDM1A基因在牦牛不同发育阶段卵泡卵母细胞及其相应壁层颗粒细胞中mRNA的表达情况(图1)。结果显示,在卵泡发育各阶段,大、中卵泡时期卵母细胞1的表达水平相差不大(> 0.05),而小卵泡时期的表达水平显著高于这两个时期(< 0.05)(图1-A)。在壁层颗粒细胞中KDM1A基因的表达水平随卵泡发育的进行呈明显的上升趋势,以小卵泡壁层颗粒细胞该基因的表达量作为参考,大、中卵泡的表达量约为小卵泡的3倍(< 0.01)(图1-B)。
2.3 牦牛卵泡中的KDM1A的定位及表达
由于KDM1A基因在不同发育阶段的牦牛卵泡中表达量有显著差异,本试验采用免疫组化检测KDM1A在牦牛不同发育阶段卵泡中的定位(图2)。结果显示,f牦牛卵泡发育各个阶段中KDM1A均有表达,但在不同发育阶段卵泡中该基因的表达水平存在差异。黄色或棕黄色着色判定为阳性细胞,主要见于壁层颗粒细胞(GC)、膜细胞(TC)。随着GC的增殖其荧光信号逐渐增大,直至大卵泡时期的表达量最高,表现为强阳性信号(图2-C)。其中,大、中卵泡时期的平均光密度显著高于小卵泡(< 0.05),而大、中卵泡时期相比较差异不显著(> 0.05)(图3)。通过RT-qPCR和免疫组化技术分析发现,KDM1A在牦牛不同发育阶段的卵泡壁层颗粒细胞中均有表达,且呈现一定的差异性,即随着发育时间的进行卵泡中KDM1A表达量呈上升趋势,其中在大卵泡时期KDM1A的表达水平最高。
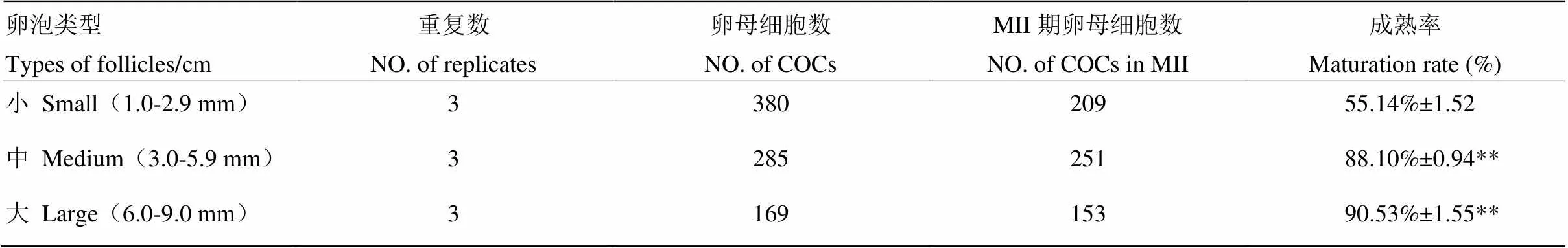
表1 牦牛卵母细胞成熟度
** 表示差异极显著(< 0.01) ** Show extremely significant difference (0.01)
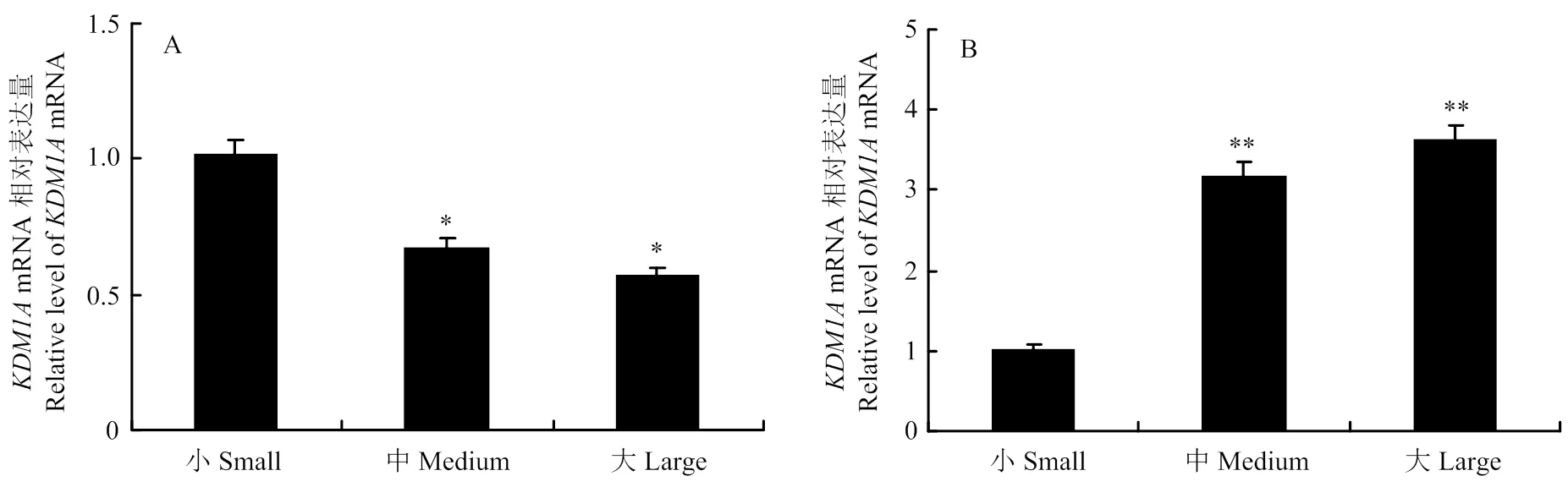
** 表示差异极显著(P < 0.01);* 表示差异显著(P < 0.05)
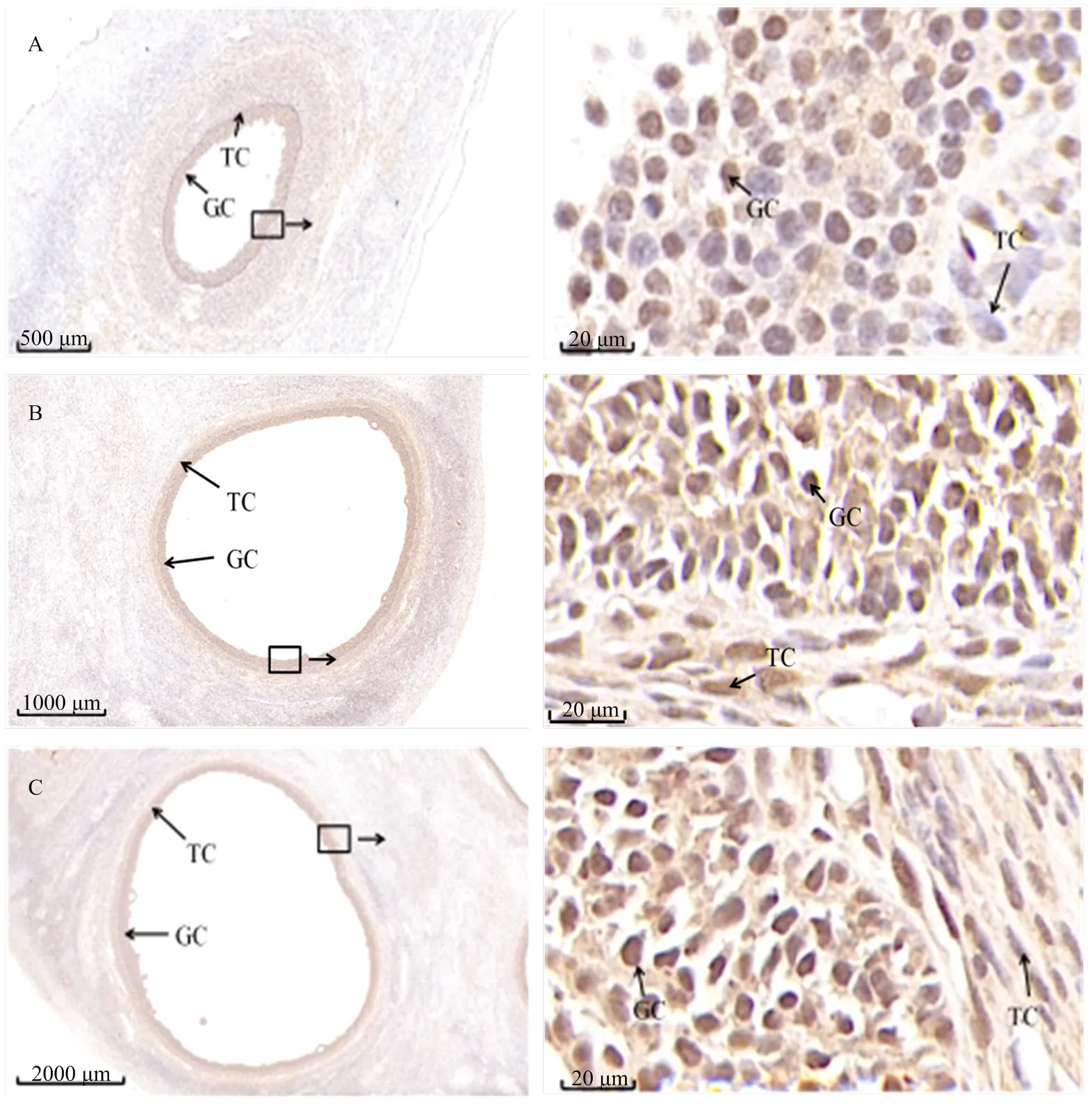
A:牦牛大卵泡组织中KDM1A的定位;B:牦牛中卵泡组织中KDM1A的定位情况;C:牦牛小卵泡组织中KDM1A的定位情况(GC:壁层颗粒细胞;TC:膜细胞)
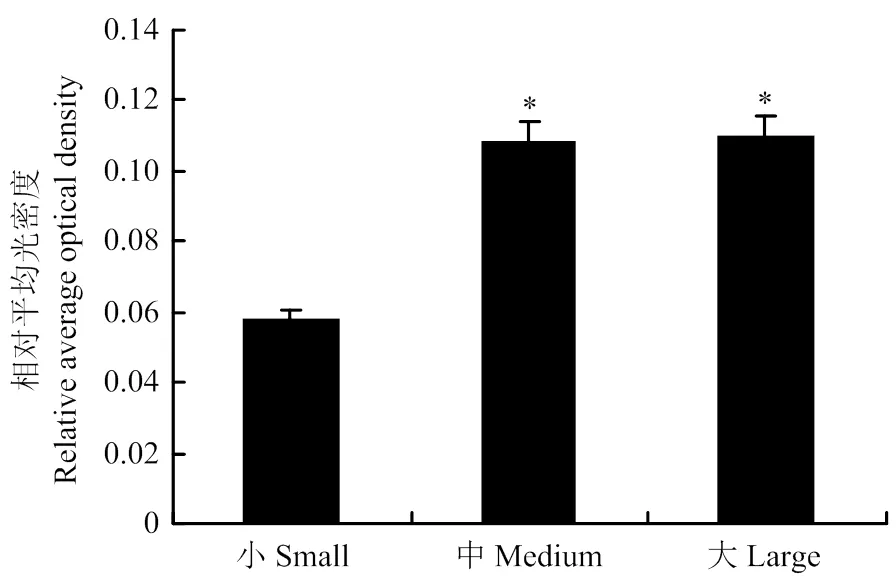
* 表示差异显著(P < 0.05)* Show significant difference (P < 0.05)
3 讨论
哺乳动物KDM1亚家族有KDM1A和KDM1B两个成员,它们主要介导H3K4去甲基化[8,18]。其中KDM1A是一种染色质修饰酶,可通过选择性与核受体的结合催化从H3K4和H3K9中去除甲基化基团[19-20]。组蛋白修饰对哺乳动物的生殖发育至关重要,例如KDM1A与雄激素受体彼此作用,可刺激雄激素受体依赖性转录,如抑制该蛋白表达水平会减少雄激素诱导的转录激活和细胞增殖,从而影响雄性的生殖发育进程[12]。KDM1A同样可通过调控相关基因表达介导卵母细胞发育及成熟过程。因此,探索KDM1A在卵泡及卵母细胞的发育成熟过程中的表达规律将为解析牦牛卵母细胞减数分裂机制奠定基础。
本试验对不同发育阶段牦牛卵泡内的卵母细胞进行体外培养,通过比较卵泡发育程度与卵母细胞成熟度之间的关系分析发现,随卵泡发育的进行,大、中卵泡卵母细胞成熟度相较于小卵泡时期更高。原因可能为发育成熟的卵泡含有更多的mRNA和蛋白储存,可增强卵母细胞的发育能力并为其生长提供更好的环境。有研究发现KDM1A通过下调通路的一些拮抗剂,例如DKK1,来激活Wnt/β-catenin通路,可能影响卵泡的发育及排卵能力[21-22]。此外,母源1缺失会导致小鼠二细胞阶段发育停滞,且在受精后数周出现显著的异常表型[23-24]。由此可知,1可能对卵泡卵母细胞及胚胎的发育潜能有一定影响,但有待进一步的研究来验证。
本试验采用RT-qPCR的方法检测了KDM1A基因在牦牛不同发育阶段卵泡中的表达水平。结果表明1mRNA在牦牛不同发育阶段卵泡内的卵母细胞及其壁层颗粒细胞中均有表达,其中在小卵泡卵母细胞中1高水平表达,之后逐渐降低。这与随发育进行,体外成熟率升高趋势正好相反,这可能与卵母细胞减数分裂进程的恢复有关。参照文献报道, YOKOYAMA[25]等研究确定髓磷脂转录因子1(MyT1)是一种新型KDM1A复杂组件。MyT1是神经细胞特异性锌指因子,它可通过直接与KDM1A相互作用形成稳定的多蛋白复合物发挥相应生物学作用。同时,OH等[26]发现Myt1的下调可能导致部分卵母细胞恢复减数分裂,从而促进其成熟。由此推测,不同成熟率的卵母细胞中KDM1A基因的表达差异可能与其对MyT1的表达调控有关进而参与卵母细胞成熟。此外,1调控小鼠卵母细胞中H3K4me2水平,并调节CDC25B的表达来维持卵母细胞减数分裂阻滞[13]。因此,随着卵泡的发育,1在卵母细胞中表达降低,可能导致卵母细胞恢复减数分裂,从而进一步成熟,使得大卵泡阶段卵母细胞体外成熟率最高,提示1通过调控卵母细胞减数分裂从而参与卵母细胞成熟过程。
在牦牛卵母细胞成熟过程中,卵泡发育程度[27]及颗粒细胞的质量[28]起至关重要的作用。其中,来自不同直径卵泡的卵母细胞发育能力也有所不同。随着卵泡的发育,颗粒细胞的增厚,卵母细胞具备的发育能力也会逐渐增强[29-31]。免疫组化检测发现从小卵泡(1.0—2.9 mm)到大卵泡(6.0—9.0 mm)中的壁层颗粒细胞及膜细胞均表达KDM1A蛋白,且免疫组化结果与实时荧光定量结果吻合,即KDM1A在发育成熟的大卵泡时期表达水平达到峰值。JEESUN等[14]对小鼠卵巢的免疫组化结果显示,伴随卵泡的发育,KDM1A在小鼠卵泡颗粒细胞中表达水平升高。这与本结果一致。已有研究证实雌激素通过与颗粒细胞上的雌激素受体(estrogen receptor, ER)结合可以促进颗粒细胞的分化。同时,KDM1A可以通过CAC1蛋白增强雌激素受体(ERα)活性,使其更好的激活相应的靶基因[32]。由此推测,KDM1A在大卵泡壁层颗粒细胞中高表达可能是因为其诱导颗粒细胞的分化,随颗粒细胞的增多进而促进卵泡的发育过程。综上所述,可以推测1一方面在卵母细胞中通过表达下调使卵母细胞恢复减数分裂,使卵母细胞成熟;另一方面,在颗粒细胞中通过其表达上调来促进颗粒细胞增殖分化,使卵泡及卵母细胞发育成熟。尽管目前尚不清楚卵巢中KDM1A是如何被调控的,但本结果提示KDM1A参与卵泡与卵母细胞的发育过程,该基因的表达对卵泡发育及卵母细胞成熟有积极作用。
4 结论
在牦牛卵母细胞和壁层颗粒细胞中KDM1A mRNA表达水平随卵泡发育的进行依次呈逐渐递减、递增的趋势,且其蛋白表达趋势与RT-qPCR结果吻合。结合不同发育程度牦牛卵泡中存在差异的卵母细胞体外成熟结果,提示KDM1A在卵泡发育及卵母细胞成熟过程中发挥重要作用。这可能与卵母细胞的减数分裂及颗粒细胞的增殖分化有关,为进一步研究该基因在牦牛卵母细胞减数分裂过程中的作用机制提供基础数据。
[1] 王汝, 余四九, 崔燕. 幼龄牦牛甲状腺的显微结构和超微结构观察. 中国兽医科学, 2009, 39(4): 357-361.
WANG R, YU S J, CUI Y. Observation of microstructure and ultrastructure of the thyroid gland injuvenile yak., 2009, 39(4): 357-361. (in Chinese)
[2] 兰道亮, 熊显荣, 位艳丽, 徐通, 钟金城, 字向东, 王永, 李键. 基于RNA-Seq高通量测序技术的牦牛卵巢转录组研究: 进一步完善牦牛基因结构及挖掘与繁殖相关新基因. 中国科学, 2014, 44(3): 307-317.
LAN D L, XIONG X R, WEI Y L, XU T, ZHONG J C, ZI X D, WANG Y, LI J. RNA-Seq analysis of yak ovary: improving yak gene structure information and mining reproduction-related genes.2014, 44(3): 307-317. (in Chinese)
[3] SINHA P B, TESFAYE D, RINGS F, HOSSIEN M, HOELKER M, HELD E, NEUHOFF C, THOLEN E, SCHELLANDER K, SALILEW- WONDIM D. MicroRNA-130b is involved in bovine granulosa and cumulus cells function, oocyte maturation and blastocyst formation., 2017, 10(1): 37.
[4] HUNT P A, HASSOLD TJ. Human female meiosis: what makes a good egg go bad ? T, 2008, 24(2):86-93.
[5] PETRO E M, LEROY J L, COVACI A, FRANSEN E, DE NEUBOURG D, DIRTU A C, DE PAUW I, BOLS P E. Endocrine- disrupting chemicals in human follicular fluid impair in vitro oocyte developmental competence., 2012, 27(4):1025-1033.
[6] HAYASHI K, YOSHIDA K, MATSUI Y. A histone H3 methyltransferase controls epigenetic events required for meiotic prophase.,2005, 438(7066): 374-378.
[7] TACHIBANA M, NOZAKI M, TAKEDA N,SHINKAI Y. Functional dynamics of H3K9 methylation during meiotic prophase progression., 2014, 26(14): 3346-3359.
[8] SHI Y, LAN F, MATSON C, MULLIGAN P, WHETSTINE J R, COLE P A, CASERO R A, SHI Y. Histonedemethylation mediated by the nuclear amine oxidase homolog LSD1., 2004, 119(7): 941-953.
[9] FEI L, NOTTKE AC,YANG S. Mechanismsinvolved in the regulation of histonelysine demethylases. C, 2008, 20(3): 316-325.
[10] 邵根宝, 黄晓佳, 龚爱华, 张志坚, 陆荣柱, 桑建荣. 组蛋白去甲基化酶LSD1及其生物学功能. 遗传, 2010, 04: 331-338.
SHAO G B, HUANG X J, GONG A H, ZHANG Z J, LU R Z, SANG J R. Histone to methylase LSD1 and its biological functions., 2010, 04: 331-338. (in Chinese)
[11] GARCIA-BASSETS I, KWON YS, TELESE F,PREFONTAINE G G, HUTT K R, CHENG C S, JU B G, OHGI K A, WANG J, ESCOUBET-LOZACH L, ROSE D W, GLASS C K, FU X D, ROSENFELD M G. Histone methylation-dependentmechanisms impose ligand dependencyfor gene activation by nuclear receptors., 2007, 128(3): 505-518.
[12] METZGER E, WISSMANN M, YIN N, Müller J M, Schneider R, Peters A H, Günther T, Buettner R, Schüle R.LSD1 demethylates repressive histonemarks to promote androgen-receptor- dependenttranscription., 2005,437(7057): 436-439.
[13] JEESUN K, KUMAR S A, YOKO T, Lin K, Shen J, Lu Y, Kerenyi M A, Orkin S H, Chen T. LSD1 is essential for oocyte meiotic progression by regulating CDC25B expression in mice., 2015, 6: 10116.
[14] SHAO G, WANG J, LI Y. Lysine-specific demethylase1 mediates epidermal growth factor signaling to promote cell migration in ovarian cancer cells., 2015, 5: 15344.
[15] ZHENG Y C, MA J, WANG Z, Li J, Jiang B, Zhou W, Shi X, Wang X, Zhao W, Liu H M.A systematic review of histone lysine-specific demethylase 1 and its inhibitors., 2015, 35(5):1032-1071.
[16] LYNCH JT, HARRISWJ, SOMERVAILLE T C. LSD1 inhibition: a therapeutic strategy in cancer?, 2012, 16(12):1239-1249.
[17] OMBRA M N, DI S A, ABBONDANZA C, Migliaccio A, Avvedimento E V, Perillo B. Retinoic acid impairs estrogen signaling in breast cancer cells by interfering with activation of LSD1 via PKA., 2013, 1829(5): 480-486.
[18] CICCONE D N, SU H, HEVI S,Gay F, Lei H, Bajko J, Xu G, Li E, Chen T. KDM1B is a histone H3K4 demethylase required to establish maternal genomic imprints., 2009, 461(7262): 415-418.
[19] JOHNSON MT, FREEMAN EA, GARDNER DK, Hunt PA. Oxidative metabolism of pyruvate is required for meiotic maturation of murine oocytes in vivo., 2007, 77(1):2-8.
[20] Sanchezlazo L, Brisard D, Elis S, Maillard V, Uzbekov R, Labas V, Desmarchais A, Papillier P, Monget P, Uzbekova S. Fatty acid synthesis and oxidation in cumulus cells support oocyte maturation in bovine., 2014, 28(9): 1502-1521.
[21] Usongo M, Rizk A, Farookhi R. β-Catenin/Tcf signaling in murine oocytes identifies nonovulatory follicles., 2012, 144(6):669-676.
[22] Huang Z, Li S, Wei S, Li X, Li Q, Zhang Z, Han Y, Zhang X, Miao S, Du R, Wang L. Lysine-specific demethylase 1 (LSD1/ KDM1A) contributes to colorectal tumorigenesis via activation of the Wnt/β-catenin pathway by down-regulating Dickkopf-1 (DKK1)., 2013, 8(7): 70077.
[23] Ancelin K, Syx L, Borensztein M,Ranisavljevic N, Vassilev I, Briseño-Roa L, Liu T, Metzger E, Servant N, Barillot E1, Chen C J, Schüle R, Heard E. Maternal LSD1/KDM1A is an essential regulator of chromatin and transcription landscapes during zygotic genome activation., 2016, 2(5): e08851.
[24] Wasson J A, Simon A K, Myrick D A, Wolf G, Driscoll S, Pfaff SL, Macfarlan T S, Katz D J. Maternally provided LSD1/KDM1A enables the maternal-to-zygotic transition and prevents defects that manifest postnatally., 2016, 27(5):e08848.
[25] Yokoyama A, Igarashi K, Sato T,Takagi K, Otsuka I M, Shishido Y, Baba T, Ito R, Kanno J, Ohkawa Y, Morohashi K, Sugawara A. Identification of myelin transcription factor 1 (MyT1) as a subunit of the neural cell type-specific lysine-specific demethylase 1 (LSD1) complex., 2014, 289(26): 18152-18162.
[26] SU O J, Jin H S, Marco C. Wee1B, Myt1, and Cdc25 function in distinct compartments of the mouse oocyte to control meiotic resumption., 2010, 188(2): 199-207.
[27] ABDI S, SALEHNIA M, HOSSEINKHANI. Quality of oocytes derived from vitrified ovarian follicles cultured in two- and three-dimensional culture system in the presence and absence of kit ligand., 2016, 14(4): 279-288.
[28] WIGGLESWORTH K, LEE KB, O'BRIEN M J, Peng J, Matzuk M M, Eppig J J.Bidirectional communication between oocytes and ovarian follicular somatic cells is required for meiotic arrest of mammalian oocytes., 2013, 110(39): 3723-3729.
[29] ALM H, KATSKAKSIAZKIEWICZ L, RYńSKA B, Tuchscherer A. Survival and meiotic competence of bovine oocytes originating from early antral ovarian follicles., 2006, 65(7): 1422-1434.
[30] Lequarre A S, Vigneron C, Ribaucour F, Holm P, Donnay I, Dalbiès-Tran R, Callesen H, Mermillod P. Influence of antral follicle size on oocyte characteristics and embryo development in the bovine., 2005, 63(3): 841-859.
[31] 禹学礼, 昝林森, 邓雯, 庞有志, 王新庄. 卵泡大小及卵泡液对牛卵母细胞体外受精后发育的影响. 中国农业科学, 2005, 38(8): 1664-1668.
Yu X L, Zan L S, Deng W, PANG Y Z, WANG X Z. Effects of follicle size and bovine follicular fluid on developmental competence of bovine oocytes following maturation, fertilization and culture., 2005, 38(8): 1664-1668. (in Chinese)
[32] KIM J H, PARK UH, MOON M, Um S J, Kim E J. Negative regulation of ERa by a novel protein CAC1 through association with histone demethylase LSD1., 2013, 587(1): 17-22.
Expression Pattern of KDM1A in the Development of Yak Follicles
HUANG XiangYue1, XIONG XianRong2, HAN Jie1, YANG XianYing1, WANG Yan1, Wang Bin1, LI Jian1
(1College of Life Science and Technology, Southwest Minzu University, Chengdu 610041;2Key Laboratory of Ministry of Education for Qinghai-Tibet Plateau Animal Genetic Resources Reservation and Exploitation, Chengdu 610041)
【Objective】 The aim of this study was to analyze the role of the lysine-specific histone demethylase 1A (KDM1A) in follicle development and oocyte maturation of yak. 【Method】 Taking yak follicles as research objects and according to the size of the follicles, they were divided into three groups: large-sized (6.0-9.0 mm), medium-sized (3.0-5.9 mm), and small-sized (1.0-2.9 mm) follicles. And the cumulus-oocyte complexes (COCs) were collected from each group and cultured in vitro. The maturation rate of oocytes was counted and analyzed. The total RNA was extracted from oocyte and granulosa cells in each group of follicles. The real time quantitative PCR (RT-qPCR) was used to detect the relative expression of1during follicular development. The cell localization and expression of KDM1A in yak follicle were detected by immunohistochemistry, and the correlation analysis was performed by in vitro maturation and RT-qPCR. 【Result】 The maturation rate of oocytes in vitro maturation was positively related to the size of follicles and showed a rising trend with progressing of follicular development. Meanwhile, the oocyte maturation rates of large-sized, medium-sized and small-sized follicle oocytes were 90.53 %, 88.10 % and 55.14 %, respectively. The result of RT-qPCR was found that1gene of yak was widely expressed during the development of follicles, and its expression level was significantly different in developmental stages of follicles. The relative expression of mRNA in the oocytes of the large and medium-sized follicle was significantly lower than small-sized follicles (< 0.05), but the relative expression of granulosa cells in the small-sized follicle was significantly lower than large and medium-sized (< 0.01), and there was no difference in mRNA expression levels between oocytes and granulosa cells in the large and middle-sized (> 0.05). The results of immunohistochemistry showed that KDM1A was expressed in granulosa cells and membrane cells of follicles, and its expression trend was consistent with RT-qPCR. The expression of KDM1A was the highest in the large follicle and increased with the development of follicles. 【Conclusion】 The expression levels of KDM1A mRNA and protein in oocytes and granulosa cells at the development of yak follicles were dynamic, which indicated that KDM1A played an important role in follicular development and oocyte maturation. It might be related to meiosis of oocytes and proliferation and differentiation of granulosa cells, and these results of study would provide a basic data for further research of the mechanism of KDM1A in the meiosis of yak oocytes.
yak;; immunohistochemistry; follicle; expression
2018-12-06;
2019-09-09
国家重点研发专项(2018YFD0502304)、牦牛遗传资源保护与利用创新团队(13CXTD01)、青藏高原生态畜牧业协同创新中心开放基金(QZGYXT05)、西南民族大学研究生创新型科研项目(CX2018SZ34)
黄向月,E-mail:1036404671@qq.com。通信00作者李键,E-mail:jianli_1967@163.com。通信000作者熊显荣,E-mail:xianrongxiong@163.com
(责任编辑 林鉴非)

