“测量锌与硫酸反应速率”实验装置的创新设计
张盘斌 常国旗 徐立娟
一、实验问题介绍
在人教版《化学(选修4)》化学反应原理中,有“测量锌与硫酸反应速率”的实验,实验装置如图1所示,从装置和原理来看十分简单,实验过程如图2所示。

图1 实验装置

图2 实验过程
但在教学过程中发现了如下的问题。
问题1:课本中指出该实验的氢气发生装置是锥形瓶,收集装置是注射器。因注射器活塞的移动存在阻力,而且锥形瓶的容积较大,因而生成的气体较少时,气体的压力较小,无法推动活塞移动,生成的气体就会被压缩在锥形瓶中,使注射器中没有读数;但当生成的气体较多,气压增大时,活塞就会跳跃移动,不便于读数和计时,使读出数据的误差较大。
问题2:注射器前端针头部位比活塞的面积小得多,当产生的气体较少时,由于压强作用在很小的面积上,根据物理学知识(F=P·S),推力是比较小的,即活塞移动阻力大、推力小,在这种情况下,根据活塞位置读出气体的体积是很难实现的。由于活塞阻力等因素存在,使生成气体的压力与标准大气压不相等,气体摩尔体积未知,无法将气体体积转化为物质的量,因而不能进一步计算消耗硫酸的量,也就无法计算出浓度变化和反应速率。
问题3:分液漏斗中的硫酸溶液滴进锥形瓶也会占据一定的体积,导致产生的气体体积偏大,产生误差;随着反应的进行,锥形瓶中气体压力增大,硫酸将无法顺利滴入锥形瓶,阻碍了反应的持续进行。
总之,以上这些在实验过程中发现的问题说明课本中的测定锌与稀硫酸反应速率的实验在实际操作中是很难实现的,所以笔者结合前人对该实验装置的改进,进一步创新设计装置以解决在实践中发现的问题。
二、前人对本实验的改进
改进方案1:如图3所示,锥形瓶规格为100 mL,试管规格为10 mm×75 mm。去掉分液漏斗,改双孔橡胶塞为单孔橡胶塞,用小试管盛放硫酸溶液。实验时,在小试管上绑上细线将其放入锥形瓶中,盖上单孔橡胶塞,然后倾斜锥形瓶使硫酸从试管流入锥形瓶(连接导管和注射器的是橡胶软管,以8 cm左右为宜,便于倾斜锥形瓶),使反应发生。
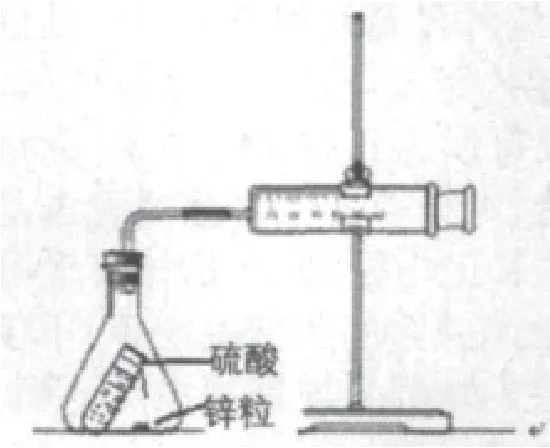
图3 改进方案1的实验装置
改进方案2:(1)取2支20 mL的注射器,拔下活塞,向其中各放入1粒(约0.5 g)锌粒,推进活塞至不能推动为止。(2)针头分别吸入1 mol/L和4 mol/L的硫酸,并立即插入橡胶塞。(3)横放注射器,在5 mL刻度处开始计时,活塞移至15 mL刻度线时停止计时,比较二者收集10 mL氢气所用的时间。
改进方案3:改进装置的实验原理是通过锌粒分别与2种不同浓度的硫酸反应生成10 mL氢气所需要的时间长短判断反应速率与物质的量浓度之间的关系。在实验的过程中,通过分液漏斗向三口烧瓶中滴加适量不同浓度的硫酸,并通过右侧的恒压装置将产生的氢气收集,通过秒表记录反应所需的时间,以此判断影响化学反应速率的因素,改进后的装置如图4所示[1]。
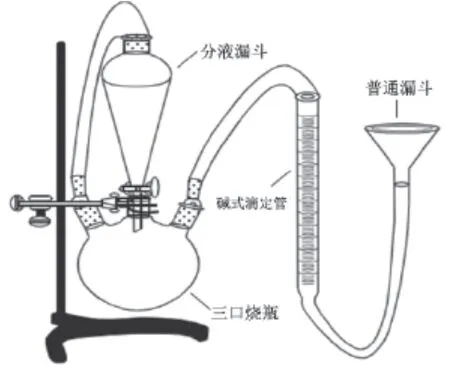
图4 改进方案3的实验装置
以上是笔者在文献中查到的前人对该实验的一些改进方法,每一个改进方案都解决了实验过程中发现的部分问题。例如,第一个和第二个改进方案可以解决实验过程中发现的第三个问题(见前文中问题3),但注射器收集气体时,活塞移动存在阻力问题没有得到解决,气体被压缩,物质的量无法计算;活塞跳跃移动不便计时和读数。第三个改进方案可以解决很多问题(见前文中的问题1和问题2),弊端是液体滴入后占据体积,使收集到的气体体积偏大,且装置复杂,不易操作。笔者查阅和整理了前人的这些改进方案,在教学实践中受到了启示,重新设计测定装置,解决了教学实践中发现的问题。
三、笔者对本实验的改进方案
1.实验过程
(1)取1支碱性滴定管,在10 mL以下的部分再内套1根玻璃管(锌在玻璃管上,当收集到10 mL气体时反应自动停止)。
(2)去掉碱式滴定管下端的乳胶管和玻璃球,用一根长的乳胶管把碱式滴定管和1根长玻璃管连接起来,组成U形连通器,如图5所示。

图5 重新设计改进后的实验装置
(3)在碱式滴定管中加注1 mol/L的硫酸溶液50 mL,调节玻璃管的高度使碱式滴定管中的液面刚好达到0刻度线处。
(4)在碱式滴定管中加入2 g锌粒,迅速塞上塞子,开始计时。随着反应的进行滴定管液面下降,同时调节玻璃管使左右液面相平,直到滴定管液面下降至10 mL刻度线时(液面脱离锌粒反应停止时停止计时),液面脱离锌粒时反应停止,计时结束。测出生成10 mL氢气时所消耗的时间。
(5)将硫酸的浓度换为4 mol/L,重复(3)(4)的操作。测出生成10 mL的氢气时所消耗的时间。
用改进后的装置实验时,现象明显,读数容易,气体摩尔体积常温常压(25 ℃,101 kPa)为24.5 L/mol。进而计算反应速率。缺点是反应时间过长,要在1 mol/L的硫酸溶液中收集到10 mL气体需要13.5 min,因此不能完成教学内容。经多次实践发现,锌不管是和多大浓度的硫酸反应都是先慢后快,原因除了反应放热外,还与锌表面的氧化膜有关。于是把大小相当的2颗锌粒同时放在4 mol/L的硫酸溶液里,待反应产生气泡的速率变快并趋于稳定时,取出锌粒再去完成演示实验。在1 mol/L的硫酸溶液里收集到10 mL氢气需要4'24'',在4 mol/L的硫酸溶液里收集到10 mL氢气时仅需要1'54''。由于实验装置简单,在课堂演示时2组实验同时进行,既可以进行对比,增强学生们感性认识,也缩短了实验时间。
2.数据记录及分析计算(见表1)
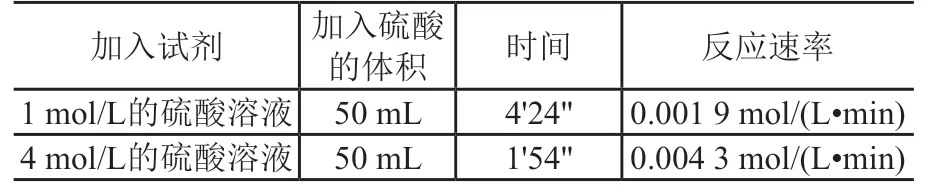
表1 数据记录表
代入数据可以计算出:1 mol/L的硫酸溶液中的速率约为0.001 9 mol/(L·min);4 mol/L的硫酸溶液中的反应速率约为0.004 3 mol/(L·min)。
3.改进实验装置的优点
(1)实验装置简单易于操作,在实验条件差的地区和学校均可以实现。
(2)解决了反应装置太大,生成的气体受压缩而测不到生成气体体积的问题,也保证了测出的气体体积在正常大气压下,方便气体摩尔体积的取值,计算氢气的物质的量和消耗硫酸的物质的量,进而计算反应速率。
(3)消除了注射器活塞的摩擦阻力引起的误差。
(4)消除了硫酸无法顺利滴入和随硫酸溶液的滴入占据体积引起误差的问题。
(5)计时读数方便准确,收集到10 mL气体时,反应物自动分离,反应停止节点清楚,现象明显。
(6)当计时结束后,反应会自动停止,不需要多余的操作,使实验变得简单易行,缩短演示实验的时间,为完成课堂内容赢得时间。
四、结语
笔者对本实验的改进思路已经在教学实践中得到应用。结论表明,比课本中的实验方案更容易操作,希望本文把该方法介绍给更多的教学同仁,让他们在教学实践中检验和完善。
——以“NaOH标准溶液的标定”微课教学为例

