金银花总黄酮对四氯化碳致大鼠肝纤维化的影响及机制
徐晓燕 苗 芳 王晓丹 高永峰 张志远 苏设镇
山东第一医科大学(山东省医学科学院),山东 泰安 271016
金银花为忍冬科植物忍冬(LoniceraejaponicaerFlos)的干燥花蕾或带初开的花,为临床常用中药,具有清热解毒、疏散风热之功效[1]。现代药理研究证明,金银花及活性成分具有优良的抗氧化、自由基清除、抗炎及调节心血管系统等作用[2- 4],但是有关金银花黄酮抗肝纤维化的作用鲜有报道。因此本研究通过四氯化碳(CCl4)复制大鼠肝纤维化模型,研究金银花总黄酮对大鼠肝纤维化的生化指标及形态学的影响,并通过体外培养肝星状细胞(HSC),观察金银花总黄酮对HSC增殖、凋亡的影响,评价金银花总黄酮对肝纤维化的作用,并探讨其作用机制。
1 材料与方法
1.1 仪器与试剂
健康清洁级SD大鼠(200±20)g,购于鲁抗动物中心(动物合格证:2008A010);HSC细胞(细胞株),购自中国医学科学院;金银花中药饮片,购自泰安金泰联医药商行;SOD、GSH- Px、MDA、Hyp测定试剂盒,均为南京建成生物工程研究所产品;噻唑蓝(MTT)购自sigma公司;细胞凋亡测试试剂盒(南京凯基生物技术有限公司);BP211D型分析天平(美国Sar- torius公司);酶标仪(瑞士TECAN公司,M200pro);流式细胞仪(美国BD公司)。
1.2 方法
1.2.1金银花总黄酮的提取、纯化及含量测定 中药饮片金银花使用70%乙醇回流提取3次,得金银花总黄酮粗品。粗品选用AB- 8大孔吸附树脂70%乙醇洗脱,收集洗脱液,干燥得金银花总黄酮。以芦丁为标准品,测得所提取样品中金银花总黄酮的含量为71.28%,备用。
1.2.2动物分组给药及肝纤维化模型的制备 大鼠48只,随机分为对照组,模型组及金银花总黄酮低、高剂量组;其中金银花总黄酮低、高剂量组分别灌胃金银花总黄酮100 mg/kg、200 mg/kg,对照组及模型组灌胃等容量生理盐水,连续6周。给药期间,除对照组外其他各组大鼠皮下注射40%CCl4油溶液1 mL/kg,每周2次,连续注射6周,同时给以10%乙醇代水饮,复制CCl4诱导的大鼠肝纤维化模型;对照组注射等容量大豆油。末次给药 24 h后心脏取血,收集血清检测血清ALT活性和Hyp含量,处死大鼠取肝脏检测肝脏MDA含量和SOD、GSH- Px活性,并进行肝脏组织切片,H- E染色观察病理改变。
1.2.3HSC细胞增殖试验 培养HSC细胞,以MTT比色法检测HSC的增殖。培养的HSC以含小牛血清的DMEM制备为5×104个/mL细胞悬液,接种于96孔板,每孔100 μL,培养24 h后,对含细胞的孔进行分组,每个剂量组5个复孔,分组情况如下:(1)对照组,HSC细胞继续用100 μL DMEM培养基进行培养;(2)药物处理组,弃去原有的培养基后用100 μL相应浓度200、100、50、25 μg/mL的含药培养基继续培养。分组处理后培养48 h,每孔加入MTT(5 g/L)10 μL,孵育4 h,弃上清,每孔加入150 μL DMSO,微型振荡器振荡10 min,于酶标仪490 nm波长下检测吸光度。
1.2.4HSC细胞凋亡试验 培养HSC细胞,以流式细胞仪检测细胞凋亡。细胞以1.5×106/孔的接种量接种于6孔培养板上。药物分组处理后,加入不含EDTA的胰酶消化,培养液终止消化,PBS冲洗2次,收集于流式管中,离心5 min(1 000 r/min),弃去上清液,每管加入PBS将细胞混悬后离心5 min(1 000 r/min),弃上清,每管加入300 μL的Binding Buffer悬浮细胞,加入5 μL的 AnnexinV- FITC混匀放置10 min,加入5 μL的Propidium Iodide,混匀上机检测。

2 结 果
2.1 金银花总黄酮对肝纤维化大鼠血清ALT、Hyp含量的影响
模型组大鼠血清ALT、Hyp显著升高,与对照组比较差异具有统计学意义(P<0.01),而金银花总黄酮低、高剂量组血清ALT、Hyp与模型组相比显著减少,并且具有一定的量效关系,差异有统计学意义(P﹤0.05)。结果见表1。

表1 金银花总黄酮对大鼠血清ALT、Hyp的影响各组n=7)
注:与对照组比较,▲P<0.01;与模型组比较,★P<0.05。
2.2 金银花总黄酮对肝纤维化大鼠肝组织MDA、SOD和GSH- Px的影响
与对照组比较,模型组肝组织中MDA含量增高,SOD和GSH- Px活性下降,差异具有统计学意义(P<0.01);与模型组比较,金银花总黄酮低、高剂量组的MDA含量下降,GSH- Px、SOD活性提高,差异有统计学意义(P<0.05)。具体见表2。
2.3 金银花总黄酮对肝纤维化大鼠肝脏形态学的影响
HE染色发现,对照组大鼠肝脏组织的肝小叶结构完整,肝细胞索由中央静脉向四周排列整齐;模型组汇管区炎性细胞、坏死细胞增多,细胞索排列紊乱,纤维间隔增厚;金银花总黄酮低、高剂量组肝纤维化程度明显减轻,对炎性细胞浸润、胶原纤维的增生以及假小叶的形成等均有明显的改善。具体见图1。

表2 金银花总黄酮对大鼠肝脏MDA、SOD、GSH- px含量的影响各组n=7)
注:与对照组相比,▲P<0.01;与模型组相比,★P<0.05。

A.金银花总黄酮低剂量组;B.金银花总黄酮高剂量组;C.对照组;D.模型组。
2.4 金银花总黄酮对HSC增殖的影响
与对照组比较,药物处理组均能不同程度抑制HSC的增殖,呈明显剂量- 效应关系,见表3。
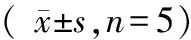
表3 金银花总黄酮对HSC增殖的影响
注:与对照组比较,**P<0.001,*P<0.05。
2.5 金银花总黄酮对HSC细胞凋亡的影响
通过流式细胞仪检测,药物处理组与对照组比较,其中早期凋亡率与晚期凋亡率均高于对照组,并具有明显剂量依赖性,显示金银花总黄酮可明显促进肝星状细胞的凋亡。结果见图2。
3 讨 论
研究表明,肝脏在CCl4刺激下产生大量活性氧自由基,使自由基代谢失去平衡,过多的活性氧自由基会攻击生物膜中的不饱和脂肪酸而发生脂质过氧化,引起血浆ALT活性的增高。因此,ALT的活性是肝细胞损坏的重要指标[5- 6]。由实验结果可以看到,模型组大鼠血清中的ALT活性明显升高,说明CCl4已经造成了肝脏细胞损伤;金银花总黄酮的高、低剂量组的大鼠血清中的ALT活性与模型组的相比显著降低,说明金银花总黄酮的高、低剂量组对由CCl4所引起的大鼠肝损伤具有一定的保护作用。长期的肝细胞损伤、变性、坏死致内皮细胞释放各种细胞因子增加,细胞因子进一步激活静息状态的星状细胞,使之转化为肌成纤维样细胞,其过度增殖,同时大量合成各种细胞外基质,过度沉积从而导致肝纤维化形成。Hyp是构成机体内胶原蛋白的特有成分,临床上血和尿中Hyp 的检测已成为衡量机体胶原组织代谢的重要指标,它能间接反映组织中胶原代谢状况。肝纤维化时由于肝实质内胶原纤维组织明显增多,可导致血和肝组织Hyp 含量升高,因此直接检测Hyp 含量可反映肝纤维化的程度。实验结果表明,模型组大鼠血清中的Hyp明显升高,说明CCl4连续皮下注射可以诱导肝纤维化形成;而金银花总黄酮的高、低剂量组的大鼠血清中的Hyp与模型组的相比显著降低,说明金银花总黄酮的高、低剂量组对由CCl4所诱导的大鼠肝纤维化具有一定的干预作用。

A.对照组未染色;B.对照组;C.金银花总黄酮200μg/mL;D.金银花总黄酮100μg/mL;E.金银花总黄酮50μg/mL;F.金银花总黄酮25μg/mL。
肝损伤时由于肝脏组织抗氧化能力降低,自由基积累,产生过多的脂质过氧化物,MDA的含量不仅能表示肝细胞膜脂质过氧化的强弱,而且可以间接的体现自由基对肝细胞的损害程度[5]。实验结果表明,模型组大鼠肝组织中MDA的含量明显增加,而金银花总黄酮组肝组织中MDA水平明显下降,说明金银花总黄酮能抑制脂质过氧化反应,从而保护肝脏组织免受损伤。肝组织中SOD能阻止其破坏肝细胞,GSH- Px能特异地催化还原性GSH对过氧化氢的还原反应从而保护细胞膜结构与功能的完整性。本实验结果表明,与对照组相比,模型组大鼠肝脏SOD、GSH- Px活性明显降低,而金银花总黄酮组SOD、GSH- Px活性明显升高,表明金银花总黄酮有明显对抗肝组织脂质过氧化反应、保护抗氧化活性的作用。病理学检查是判断肝纤维化程度,评价抗肝纤维化药物疗效的可靠标准。本实验结果表明,病理组织学HE染色发现模型组大鼠肝细胞损伤严重,肝纤维化程度极重, 而金银花总黄酮组可明显改善大鼠肝纤维化程度,并且呈剂量相关关系,表明金银花总黄酮具有明显减轻肝损伤,减少纤维条索生成的作用,对肝纤维化的形成具有一定的干预作用。
肝纤维化是指肝脏内纤维性结缔组织的大量异常增生,是一种“创伤愈合”的慢性渐进的病理过程[6]。多种因素诱发肝细胞损伤,导致肝Kupffer细胞、肝窦状内皮细胞、肝成纤维细胞等其他类型肝细胞以及迁移的炎性细胞活化并释放大量的细胞因子和可溶因子,与此同时这些因子导致肝星状细胞(HSC)活化、分化与增殖,合成大量ECM,并逐渐沉积从而引起肝纤维化[7- 10]。本实验研究发现金银花总黄酮能抑制HSC的增殖,促进HSC凋亡,并呈剂量依赖性,体外实验同样提示金银花总黄酮具有抑制肝纤维化形成的作用。

