壳聚糖改性材料用于海水提铀研究
董 浩, 文 君, 卢喜瑞
(1. 西南科技大学国防科技学院,绵阳 621010; 2. 中国工程物理研究院核物理与化学研究所,绵阳 621900)
1 引 言
铀是核能发电的主要核燃料来源,随着核能的发展,陆矿铀储量估计将在一个世纪内耗尽[1].海水中含有超过45亿吨的铀,几乎是陆矿铀储量的1000倍[2-3],从海水中吸附提取铀被认为是为发展核电提供核燃料的一种可行方案[4].
近几十年来,海水提铀吸附剂发展迅速,根据材料种类可分为:无机材料[5-8]、聚合物复合材料[9-11]、金属-有机框架材料[12-14]等.在这些吸附剂中,偕胺肟基吸附剂因其制备简单、成本低廉、在海水pH值(8.1)下具有与铀配位结合的能力,从而受到广泛关注[15-17].但海水中铀浓度极低(3.3 μg/L),同时还存有大量金属离子尤其是钙、镁和钒影响材料对铀的吸附.海水中钙和镁的浓度比铀高6~7个量级,在吸附过程中会占据偕胺肟基吸附剂上大量的活性位点;偕胺肟基对钒的配位性高于铀,造成大量钒吸附在材料表面上,且难以洗脱去除;因此提高偕胺肟基吸附剂对铀的吸附选择性是一项有意义的研究工作[18].最近He等[19]报道了一种对铀具有高吸附选择性的铀酰结合蛋白,规避了偕胺肟基吸附钒的影响.Wu等[20]报道了一种通过辐照接枝乙二胺来制备的新型胺肟基UHMWPE纤维吸附材料,该材料对铀的吸附选择性明显高于钒. Hua等人[21]报道了一种表面离子印迹聚丙烯无纺布用于铀的吸附,其对铀的吸附选择性得到显著提升.尽管这些方法有望应用于海水提铀,但这些吸附剂的制备过程较为复杂,并且忽略了海水中大量存在的Ca2+、Mg2+对吸附的影响.因此,开发一种制备简单,并且在高浓度钙、镁和近似浓度钒环境下对铀具有高吸附选择性的吸附剂,仍然是一个重要的挑战.
甲壳素及其脱乙酰衍生物壳聚糖是可从甲壳类动物中提取的天然生物吸附剂,具有良好的稳定性、配位性和生物相容性,在吸附金属离子方面具有良好的应用前景[22].其中,甲壳素及壳聚糖对铀具有较好的吸附性能,在铀的吸附领域也受到了广泛关注[23].为解决甲壳素和壳聚糖吸附选择性较差的问题,通过化学改性的方法,修改材料表面的功能基团,可以提高其对铀的吸附选择性[24-26].本实验通过在壳聚糖上交联接枝偕胺肟基和1-二甲胺基烯丙基膦酸(DMAAPA),合成了一种新型壳聚糖改性材料(CTS-AM-AO-DA)并对该材料进行模拟海水等多种体系的吸附试验,探究pH、盐分以及竞争离子对吸附性能的影响.
2 实 验
2.1 试 剂
材料制备所需要的壳聚糖(CTS)、丙烯腈(AN)、丙烯酰胺(AM)、NaHSO3、(NH4)2S2O8、乙酸、戊二醛、乙醇、盐酸羟胺、甲醇和配置吸附溶液所用的NaHCO3、NaCl、UO2(NO3)2·6H2O、CaCl2、MgCl2、Na3VO4·12H2O、NaOH和HNO3均购自阿拉丁试剂,1-二甲胺基烯丙基膦酸(DMAAPA)购自天成试剂.校准ICP所采用的1000 μg/mL铀、钒、钙和镁金属离子标准溶液购自西格玛奥德里奇试剂.所有原料均为化学纯级别或以上.
2.2 制 备
通过三步化学合成制备出CTS-AM-AO-DA材料,合成路线如图1所示.
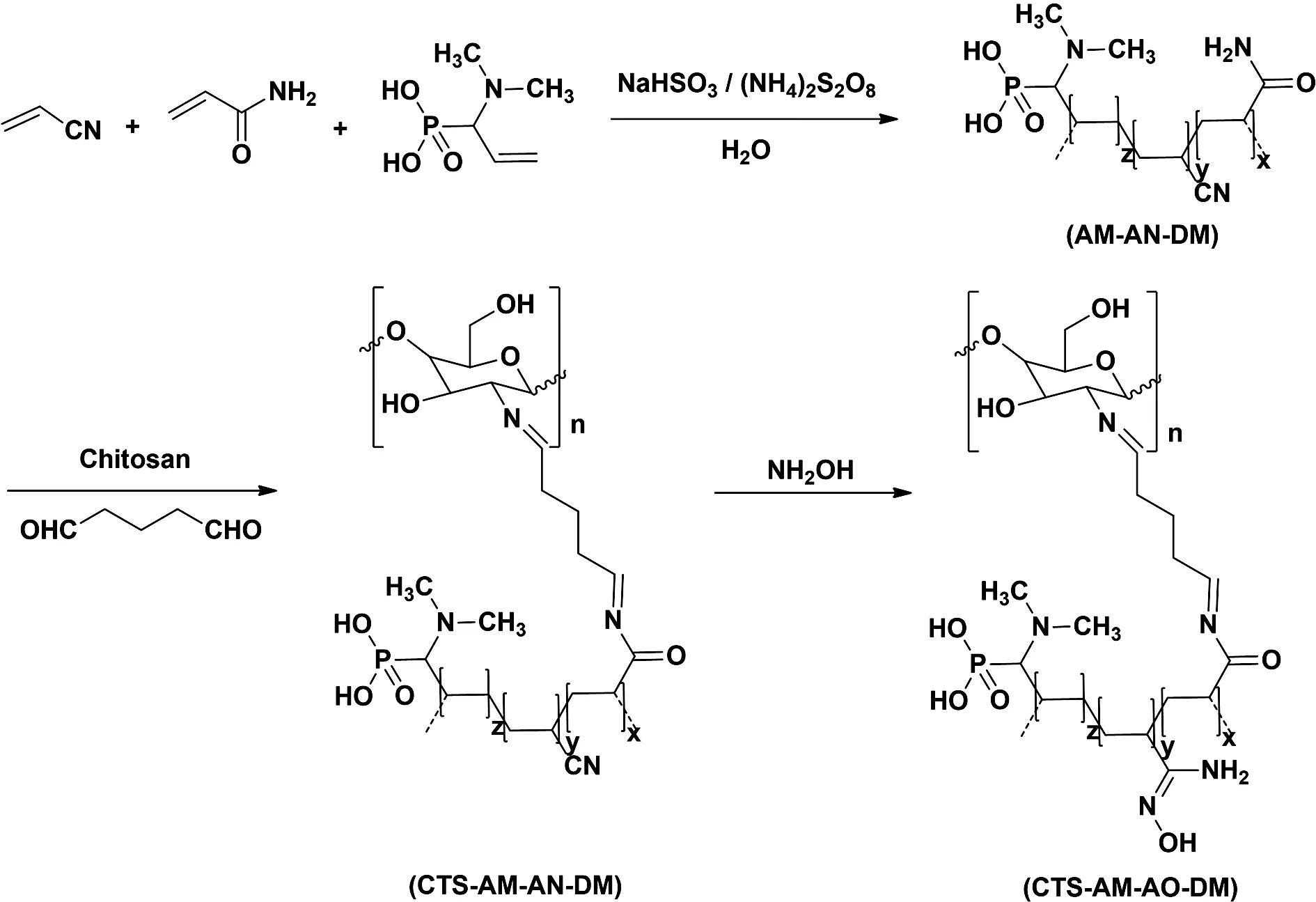
图1 CTS-AM-AO-DM的合成Fig.1 Synthesis of CTS-AM-AO-DM
AM-AN-DM的合成: 将9 g丙烯酰胺、1 g丙烯腈和0.5 g DMAAPA投入圆底烧瓶内,溶于30 mL去离子水中.溶液在氮气氛围下进行磁力搅拌,并于50 ℃加热0.5 h.随后向烧瓶中加入20.6 mg NaHSO3和45.6 mg (NH4)2S2O8继续加热12 h,使混合物充分聚合.使用乙醇将反应完成后的产物洗涤出白色固体,40 ℃真空干燥后得到AM-AN-DM.
CTS-AM-AN-DM的合成: 将2 g壳聚糖溶解于圆底烧瓶中60 mL、1 wt%的乙酸溶液,加入5 g制备的AM-AN-DM并进行升温.温度达到50 ℃时加入0.5 mL戊二醛并恒温反应8 h,使CTS与AM-AN-DM形成交联.反应后的沉淀物使用乙醇洗涤并40 ℃真空干燥后,得到CTS-AM-AN-DM.
CTS-AM-AO-DM的合成: 将CTS-AM-AN-DM置于含10 wt%盐酸羟胺的甲醇/水(50% w/w)溶液中,80 ℃下加热24 h,使CTS-AM-AN-DM上的腈基转换为偕胺肟基.同样将沉淀物用乙醇洗涤并干燥后,得到CTS-AM-AO-DM.
2.3 表 征
使用美国赛默飞世尔公司的Nicolet iS 10傅立叶变换红外光谱仪(FT-IR),通过 KBr固体压片法收集CTS-AM-AO-DA材料制备过程中聚合物在4 000~600 cm-1区间的FT-IR光谱.使用德国卡尔蔡司公司的Super 55扫描电子显微镜(SEM)观察材料的形貌.使用美国康塔公司的Quadrasorb SI 比表面积分析仪获得材料的Brunauer-Emmett-Teller(BET)比表面积信息.使用美国珀金埃尔默公司的Optima 2100DV电感耦合等离子体发射光谱仪(ICP-OES)测定溶液中的离子浓度.
2.4 吸附实验
称取一定质量的CTS-AM-AO-DA作为吸附剂投入到装有模拟海水的广口玻璃瓶中,将玻璃瓶置于振荡器中25 ℃条件下震荡吸附24 h,以达到吸附平衡.以1 000 μg/mL金属离子标准溶液加入5 wt%的稀硝酸配置出5种浓度范围为0~10 μg/mL的校准标液,对ICP-OES进行校准得到线性校准曲线,之后对吸附前和吸附平衡后的溶液进行测量分析.公式1和2分别为离子在吸附剂上的平衡吸附容量qe(mg/g)和吸附率SE:
(1)
(2)
式中V(L)为溶液体积,m(g)为吸附剂质量,C0和Ce(mg/L)分别为吸附前和吸附后溶液中的离子浓度.
研究时间对吸附过程的影响以及吸附动力学所使用的模拟海水制备方法为:向1 L去离子水中加入8 mg UO2(NO3)2·6H2O、193 mg NaHCO3和25.6 g NaCl,混合均匀后调整pH=8.1.通过向铀溶液中加入NaOH和HNO3调整pH为2.0~9.0,研究溶液pH对CTS-AM-AO-DA吸附性能的影响.0~0.5 mol/L的NaCl作为盐分添加至铀溶液中,研究盐分对材料吸附性能的影响.向模拟海水中加入CaCl2、MgCl2、UO2(NO3)2·6H2O和Na3VO4·12H2O,使混合溶液中含有与真实海水浓度相同的钙(411 μg/mL)和镁(1 290 μg/mL),同时为了便于测试,将溶液中的铀和钒的浓度分别提高到20和12.1 μg/mL,对制备的混合溶液进行吸附实验,并探究材料的吸附选择性.所有实验数据均为三次测量的平均值,数据的相对误差小于5%.
3 结果与讨论
3. 1 CTS-AM-AO-DM的表征
利用FT-IR光谱表征制备过程中三种聚合物的化学结构变化,结果如图2所示.图2(a)中2 242 cm-1处的特征峰对应着丙烯腈结构上C≡N的拉伸振动;1 690和1 620 cm-1处的特征峰对应着丙烯酰胺结构上C=O和-NH2的拉伸振动;1 317和1 042 cm-1处的特征峰对应着膦酸基团结构上P=O和C-N的拉伸振动,同时出现的特征峰表明AM-AN-DM成功聚合.图2(b)的谱图显示:在AM-AN-DM的特征峰出现的同时,1 072、2 862和3 355 cm-1处出现新的特征峰,对应着壳聚糖结构的拉伸振动,壳聚糖与AM-AN-DM形成稳定的交联状态.图1(c)中2 242cm-1处对应C≡N拉伸振动的特征峰消失的同时,在933和1 653 cm-1处出现了两个新的特征峰,说明材料上的腈基完全转化为偕胺肟基.壳聚糖表面上存有偕胺肟基和膦酸基团意味着壳聚糖改性材料CTS-AM-AO-DM的成功合成.

图2 制备过程中聚合物的FT-IR光谱:(a)AM-AN-DM;(b)CTS-AM-AN-DM;(c)CTS-AM-AO-DM
Fig.2 FT-IR spectra of polymers in preparation: (a) AM-AN-DM; (b) CTS-AM-AN-DM; (c) CTS-AM-AO-DM
使用SEM对CTS-AM-AO-DM以及在铀溶液吸附后的材料形貌进行表征.如图3所示:合成的CTS-AM-AO-DM呈现出没有空隙的颗粒状聚集形态,粒径约为200 nm,依旧保持着与壳聚糖类似的微观形貌.使用比表面积分析仪测试,CTS-AM-AO-DM的比表面积SBET=9.135 m2/g,高比表面积意味着材料在溶液中与金属离子接触的活性位点更多,从而具有更快的吸附速率.CTS-AM-AO-DM在铀溶液中吸附后,微观形貌没有发生明显变化,吸附过程没有对材料表面进行破坏,表现出优异的稳定性.

图3 CTS-AM-AO-DM的SEM图像:(a)铀吸附前;(b)铀吸附后Fig.3 SEM images of CTS-AM-AO-DM: (a) before uranium adsorption; (b) after uranium adsorption
3.2 CTS-AM-AO-DM的吸附动力学
将10 mg CTS-AM-AO-DM投至500 mL模拟海水中,25 ℃下震荡吸附,一定时间取样测试铀吸附容量,对得到的数据进行吸附动力学研究.如图4所示,在吸附过程的前240 min,CTS-AM-AO-DM的吸附速率较快,240 min时的吸附容量即可达100 mg/g以上,之后吸附容量随时间的延长缓慢增加,24 h时达到吸附平衡,此时的平衡吸附容量为223 mg/g.为了研究吸附动力学机理,采用准一级动力学线性方程(3)和准二级动力学线性方程(4)拟合吸附过程:
In(qe-qt)=Inqe-k1t
(3)
(4)
式中qt(mg/g)为时间t的吸附容量,qe(mg/g)为平衡吸附容量,k1(h-1)为准一级动力学的吸附速率常数,k2(g/mg/h)为准二级动力学的吸附速率常数.

图4 吸附时间对CTS-AM-AO-DM吸附铀的影响
Fig.4 Effect of contact time on the uranium sorption by CTS-AM-AO-DM
表1CTS-AM-AO-DM准一级和准二级动力学模型的动力学参数
Tab.1Kineticparametersofquasi-first-orderandquasi-second-orderkineticmodelsforCTS-AM-AO-DM

quasi-first-order modelquasi-second-order modelk1(h-1)qe/ (mg/g)R2k2/(mg/g/h)qe/(mg/g)R20.31203.70.940.001 7232.30.98
CTS-AM-AO-DM的动力学参数如表1所示,相对较大的相关系数(R2=0.98)说明准二级动力学线性方程对吸附过程的拟合程度更高,活性位点均匀分布在材料表面上,从而形成单层吸附,此时的饱和吸附容量理论值为232.3 mg/g,与吸附实验的结果相近.
3.3 pH对CTS-AM-AO-DM吸附铀的影响
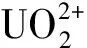
图5 溶液pH对CTS-AM-AO-DM吸附铀的影响
Fig.5 Effect of solution pH on the adsorption of uranium by CTS-AM-AO-DM
3.4 盐分对CTS-AM-AO-DM吸附铀的影响
海水中存在的大量盐分是影响材料铀吸附性能的重要环境因素,研究盐分(NaCl)对材料吸附性能的影响至关重要.分别将5 mg CTS-AM-AO-DM投至30 mL、浓度为20 μg/mL、pH=8.0、NaCl浓度为0.01~0.5 mol/L的铀溶液中,在25 ℃下震荡吸附24 h,以观察盐分浓度对材料吸附率的影响.如图6所示, NaCl的浓度在0.01~0.5 mol/L范围内,材料对的铀吸附率始终保持在99%以上. 盐分对CTS-AM-AO-DM吸收铀的性能没有显著影响,这与其吸附机理主要为内表面络合,而非球外表面络合或离子交换过程有关.海水中的NaCl浓度为0.44 mol/L,即使在类似海水盐度的溶液中,CTS-AM-AO-DM依旧保持着较佳的吸附性能,表现出良好的耐盐性.
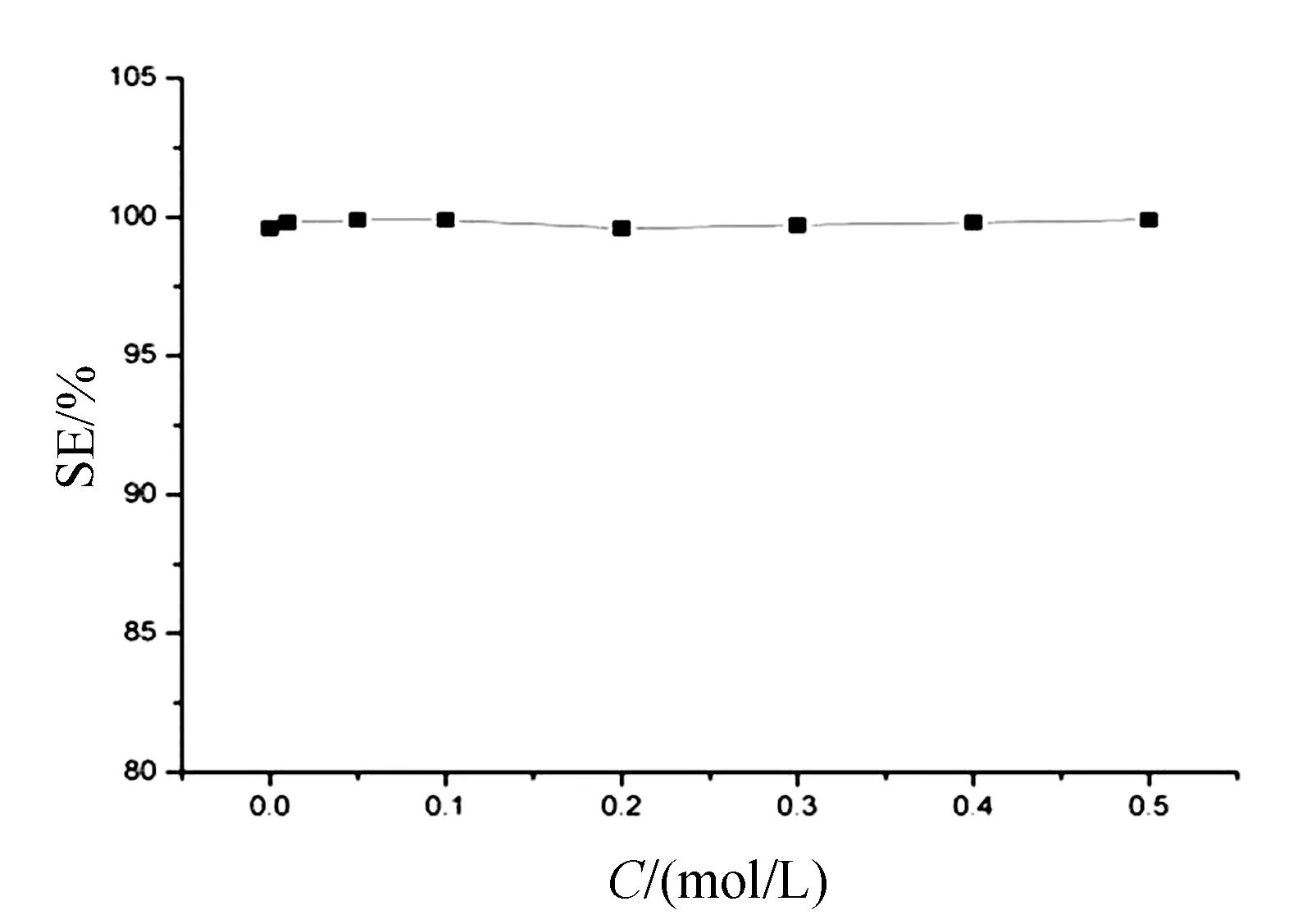
图6 不同浓度NaCl的加入对CTS-AM-AO-DM吸附铀的影响
Fig.6 The adsorption efficiency of uranium in the presence of NaCl with different concentrations
3.5 竞争离子对CTS-AM-AO-DM吸附U(VI)的影响
从以往的报道来看,胺肟基吸附材料在海水中吸附铀的同时,海水中的钙、镁和钒是其主要的竞争离子,研究竞争离子对CTS-AM-AO-DM吸附铀的影响很有必要.将10 mg CTS-AM-AO-DM投置200 mL混合溶液中,在25 ℃下震荡吸附24 h以达吸附平衡.结果如图7所示,CTS-AM-AO-DM对铀的平衡吸附容量为115.6 mg/g,明显大于钒的吸附容量(65.1 mg/g),表出极高的吸附选择性,材料中的膦酸可以与铀形成良好的配位,从而降低了钒的吸附量.CTS-AM-AO-DM对钙和镁的吸附容量分别为 8.1和11.6 mg/g,与铀相比吸附容量较低,这与材料表面上不含有亲水性的羧酸基团有关. 竞争离子对吸附性能的影响较小,CTS-AM-AO-DM上的壳聚糖、偕胺肟基和膦酸基团的共同作用极大提高了材料对铀的吸附选择性.

图7 CTS-AM-AO-DM对铀的吸附选择性
Fig.7 Selective uranium adsorption on CTS- AM-AO-DM
1) 通过交联的方法可以将AN、AM和DMAAPA接枝在壳聚糖表面上,进行胺肟化处理后,得到对铀具有良好吸附性能的壳聚糖改性材料.
2) 壳聚糖改性材料在配置的模拟海水中的平衡吸附容量达到223 mg/g,使用准二级动力学线性方程可以更好的拟合其吸附过程.
3) 在弱碱性(pH=7.0~9.0)铀溶液中,壳聚糖改性材料始终保持着高吸附率,非常适合真实海水的pH环境;即使铀溶液中添加0.5 mol/L的NaCl,依然对材料的吸附率没有明显影响,表现出良好的耐盐性.
4) 在掺加钙、镁、钒和铀的混合溶液中,壳聚糖改性材料对钙、镁的吸附量极低,钒的吸附量与铀相比也明显较少,该材料展现出对铀优异的吸附选择性.

