柑橘溃疡病菌胞外蛋白水解酶对其致病力的作用
徐鑫焱, 李艳娇, 户 勋, 邹华松
(福建农林大学植物保护学院闽台作物有害生物生态防控国家重点实验室,福建 福州 350002)
胞外水解酶是植物病原细菌的重要致病因子,其通过病原细菌的Ⅱ型分泌系统泌出胞外后,对寄主组织进行降解,促进病害的发生[1-3].胞外蛋白水解酶是植物病原细菌胞外水解酶的一种,能够降解寄主植物细胞壁,协助病原菌完成寄生,因此,蛋白水解酶活性对细菌菌株的致病力有重要作用[4-7].甘蓝黑腐病菌(Xanthomonascampestrispv.campestris)的蛋白酶缺失突变体在芜菁叶片上的致病力下降,病情指数仅为野生型的1/4[6].水稻条斑病菌(X.oryzaepv.oryzicola)RS105菌株具有较强的胞外蛋白水解酶活性,基因组中含有2个胞外蛋白水解酶基因ecpA和ecpB,ecpA突变后蛋白水解酶活性完全丧失,致病力减弱[8].
柑橘黄单胞柑橘亚种(X.citrisubsp.citri,Xcc)是引起柑橘溃疡病的亚洲种,其致病力最强,分布也最为广泛[9].在Xcc306菌株中,将Ⅱ型分泌系统的xpsD基因突变,胞外纤维素酶、蛋白水解酶和淀粉酶活性均降低[10-11].以中国菌株Xcc29-1为出发菌,得到的xpsD突变体胞外纤维素酶、蛋白水解酶和淀粉酶活性也降低[12].在对Xcc29-1菌株纤维素酶基因进行研究的过程中,发现BglC3和EngXCA都具有降解硝酸纤维素的能力,但是仅BglC3能被Xcc29-1分泌到细胞外;将BglC3编码基因突变后,Xcc29-1胞外纤维素酶的活性完全丧失,在柑橘上的致病力减弱[13].有关Xcc菌株蛋白水解酶功能的研究很少.研究显示,Xcc306菌株的胞外蛋白酶基因XAC0929突变后,细胞运动能力及生物膜形成能力都下降,但是其对致病力的影响还不清楚[14].
本研究根据柑橘溃疡病菌Xcc29-1的基因组信息,鉴定其含有的胞外蛋白水解酶基因,并构建胞外蛋白水解酶缺失菌株,研究胞外蛋白水解酶对致病力的影响,旨在为揭示Xcc的致病机理提供依据.
1 材料与方法
1.1 菌株和质粒
本研究所用的菌株和质粒见表1.大肠杆菌DH5α和BL21(DE3)在LB培养基中于37 ℃下培养.Xcc野生型菌株29-1及突变体在牛肉浸膏培养液NB或固体培养基NA(含有1.5%琼脂粉)中于28 ℃下培养[15].本研究所用的抗生素为卡那霉素(kanamycin, Km)20 μg·mL-1、壮观霉素(spectinomycin, Sp)20 μg·mL-1.
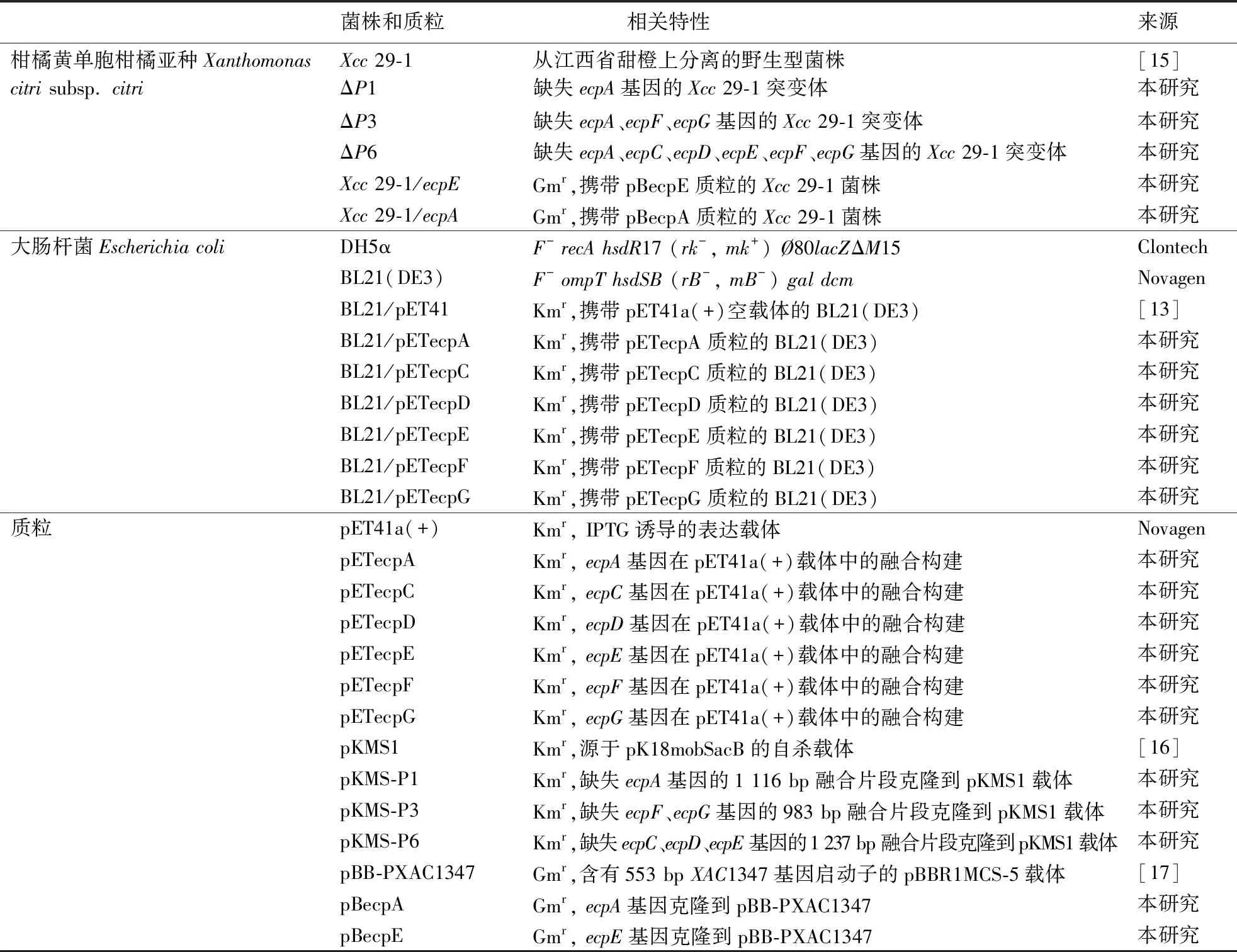
表1 本研究所用的菌株和质粒Table 1 Bacterial strains and plasmids used in this study
1.2 Xcc 29-1胞外蛋白水解酶基因鉴定
将Xcc29-1基因组中(GenBank登录号PRJNA193774)注释为蛋白水解酶的6个基因,克隆到原核表达载体pET41a(+),克隆所用的特异性引物见表2.PCR反应条件:95 ℃预变性5 min;95 ℃变性35 s,55 ℃退火40 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min.将6个构建的载体转化到大肠杆菌BL21(DE3)后,在含有5%脱脂奶粉的LB平板上检测胞外蛋白酶活性,制备平板前加入终浓度为1.0 mmol·L-1的IPTG.参照Zou et al[8]的方法,将培养的大肠杆菌制备成D600 nm=0.5的菌悬液,吸取2 μL滴加到平板表面,在超净工作台上吹干后置于37 ℃培养2 d.菌落周围的水解圈大小即可反映胞外蛋白水解酶活性.测量每个水解圈直径,并与pET41a(+)空载体进行比较.

表2 用于分子克隆的引物1)Table 2 Primers used for molecular cloning
1)下划线表示引物5′端的酶切位点.
1.3 Xcc 29-1胞外蛋白水解酶缺失突变体构建
在自杀载体pKMS1中构建了3个重组质粒pKMS-P1、pKMS-P3和pKMS-P6,分别用于对ecpA、ecpF和ecpG以及ecpC、ecpD、ecpE进行分步缺失.根据Xcc29-1的基因组信息设计特异性引物(表2),先扩增突变基因的上游和下游片段,通过重叠PCR融合2个片段后,再克隆到自杀载体pKMS1(表1).将pKMS-P1电转进入野生型Xcc29-1菌株,在含Km的NA平板(不含蔗糖的NA)上筛选发生第1次同源交换的重组子;在含10%蔗糖的NA平板上筛选发生第2次同源交换的重组子;将重组子在含蔗糖的NA和含有Km的NA平板上培养.在含蔗糖的NA平板上生长正常但在含有Km的NA平板上不生长的即为发生了2次同源交换的缺失突变体.用扩增上游片段的正向引物ecpA.1.F和扩增下游片段的反向引物ecpA.2.R进行菌落PCR,确定目标基因ecpA被从Xcc29-1中敲除,得到的突变体命名为ΔP1.按照同样的操作步骤,将pKMS-P2电转进入ΔP1,对ecpF和ecpG2个基因进行缺失突变,得到缺失3个编码基因的突变体ΔP3;将pKMS-P3电转进入ΔP3,对ecpC、ecpD、ecpE3个基因进行缺失突变,得到胞外蛋白水解酶活性完全丧失的ΔP6.
1.4 胞外蛋白水解酶过表达菌株构建
设计特异性引物(表2)扩增ecpA和ecpE的编码序列,克隆到载体pBB-PXAC1347的XhoⅠ-HindⅢ位点.pBB-PXAC1347是在粘粒载体pBBR1MCS-5的KpnⅠ-XhoⅠ位点克隆了553 bpXAC347基因的启动子[17],得到的重组载体pBecpA和pBecpE分别电转进入野生型Xcc29-1.
1.5 生物膜测定
在NB液体培养基中将Xcc蛋白酶缺失突变菌株ΔP6培养至D600 nm=1.5左右,用新鲜的NB液体培养基将培养液调整为D600 nm=0.5的菌悬液.取3 mL菌悬液加入25 mL玻璃试管中,在28 ℃静置培养3 d.缓缓倒掉NB培养液,取4 mL无菌水沿着试管壁轻轻加入管底,缓慢旋转试管漂洗浮游的Xcc细胞.取4 mL结晶紫染液染色15 min后,用4 mL无菌水轻轻漂洗2次,去除多余的结晶紫染液,并观察附着在试管壁上的Xcc细胞.漂洗过后的试管置于室温风干,加入500 μL无水乙醇,轻轻摇晃将试管内的结晶紫洗脱干净,测定所得溶液的D595 nm,以此确定生物膜的形成能力[18].
1.6 致病力和生长速度测定
将Xcc29-1菌株在NB液体培养基中培养至D600 nm=1.5左右,离心收集菌体,用无菌水重新悬浮菌体,制备成D600 nm=0.3的菌悬液(108CFU·mL-1),按10倍比例稀释得到107和106CFU·mL-1的菌悬液.针刺创伤接种:用针头在柑橘叶片上刺5个伤口,呈“梅花状”,滴加50 μL菌悬液后,迅速用一片保鲜膜覆盖接种部位以保湿,1 d后揭走保鲜膜.注射接种:用无针头注射器将制备的菌悬液打入柑橘叶片.注射和针刺接种后持续观察病害的发生情况,并分别在第5天和第10天拍照记录.
按照注射接种方法将D600 nm=0.3的菌悬液接种至柑橘叶片.注射完成后,即刻用圆形打孔器在注射区域打下2 cm2叶片,放入已灭菌的1.5 mL离心管中.经无菌水漂洗两遍后,加入500 μL无菌水,捣碎叶片.采用10倍梯度稀释方法,将菌悬液稀释至合适浓度,取100 μL每个稀释浓度的菌悬液涂布NA平板,于28 ℃恒温培养箱中倒置培养.待长出单菌落后,计数平板上的菌落数量;此后,分别第2、4和6天取样,计数菌落数量.叶片中细菌数量按照每平方厘米所含有的细菌总量计算,并以其log10的值作图.
1.7 荧光定量RT-PCR(qRT-PCR)

表3 用于定量PCR分析的引物Table 3 Primers used for qRT-PCR analyses
试验所用引物见表3.将Xcc29-1菌株在NB液体培养基中培养至D600 nm=1.5左右时,离心收集菌体,用Trizol(Ambion,15596-026)提取总RNA.制备D600 nm=0.3的菌悬液并注射接种至柑橘叶片,3 d后采集注射叶片,经液氮速冻磨碎后用Trizol(Ambion,15596-026)提取总RNA.在分光光度计上测定D260 nm/D280 nm值,检测总RNA样品的质量.DNaseⅠ消化总RNA中残留的基因组DNA后,用AMV反转录酶(TaKaRa)进行反转录,在CFX Connect real-time system(Biorad)上用iTaq Universal SYBR Green Supermix(Bio-rad)进行定量分析,gyrA基因当作内参基因.反应程序:95 ℃预变性30 s;95 ℃变性5 s,58 ℃延伸30 s,40个循环.相对表达量统计分析在软件CFX Maestro(Biorad)中完成.
2 结果与分析
2.1 Xcc 29-1胞外蛋白酶编码基因的鉴定
Xcc29-1的基因组序列含有1个染色体和3个质粒,注释为蛋白酶的6个基因全部位于染色体上.XAC29_04720、XAC29_04725和XAC29_04730在染色体上紧密相邻,位于染色体1 093 947~1 099 382 bp的位置;XAC29_14090的编码序列大小为1 098 bp,编码产物是水稻条斑病菌胞外蛋白酶EcpA的同源物,在染色体上位于3 250 939~3 252 036 bp的位置,附近没有注释为蛋白酶的基因;XAC29_14430和XAC29_14440基因位于染色体3 335 232~3 339 574 bp的位置(图1A).在Xcc29-1中没有发现ecpB的同源基因.除了已经明确XAC29_14090为ecpA基因外,按照染色体上的排列顺序,将XAC29_04720、XAC29_04725、XAC29_04730、XAC29_14430和XAC29_14440分别命名为ecpC、ecpD、ecpE、ecpF和ecpG(图1A).胞外蛋白水解酶通过Ⅱ型分泌系统分泌到细胞外,因为BL21(DE3)菌株含有一个完整的Ⅱ型分泌系统,所以可以作为鉴定胞外水解酶的宿主.本研究利用原核表达系统在BL21(DE3)菌株中对Xcc29-1的6个蛋白水解酶的活性进行鉴定.在含有5%脱脂奶粉的LB固体平板上, 6个重组载体所产生的水解圈直径均比pET41a(+)空载体增加了1倍左右,表明这6个基因具有胞外蛋白水解酶活性(图1B、1C).
2.2 Xcc 29-1胞外蛋白酶缺失突变体的构建
利用自杀载体分3次将6个编码基因全部从野生型菌株中敲除:第1次敲除1 098 bp的ecpA基因,第2次敲除ecpF和ecpG基因,第3次敲除ecpC、ecpD和ecpE基因.在连续敲除过程中,第1次和第2次敲除都能够让胞外蛋白水解酶活性稍微减弱(图2A),这表明Xcc29-1含有多个胞外蛋白水解酶基因.最后,用3对引物(ecpA.1.F/ecpA.2.R、ecpF.1.F/ecpG.2.R和ecpC.1.F/ecpE.2.R)对胞外蛋白水解酶基因缺失突变体ΔP6进行菌落PCR扩增,所得到的产物大小分别为1 116、983和1 273 bp,回收PCR产物测序,确定ΔP6的基因组中缺失ecpA、ecpC、ecpD、ecpE、ecpF和ecpG共6个基因(图2B).
2.3 蛋白酶缺失突变体ΔP6的致病力
在针刺创伤接种5 d后,浓度为108CFU·mL-1的ΔP6菌悬液诱导伤口部位出现溃疡病斑,病斑出现的时间与野生型没有区别,但溃疡病斑发展速度较野生型慢;接种浓度为107和106CFU·mL-1的ΔP6菌悬液时,溃疡病斑出现的时间均比野生型晚1 d;接种10 d后3个接种浓度的伤口部位都出现木栓化隆起,但隆起程度都比接种相应浓度的野生型菌株低(图3).在注射接种试验中,接种部位出现溃疡病斑的时间比针刺创伤接种早2 d,在第3 天即可观察到水渍状症状,接种5 d后可以清晰地看到溃疡症状(图3).在相同的接种浓度下,突变菌株ΔP6形成的溃疡症状比野生型菌株弱,表明突变菌株ΔP6的致病力变弱.
2.4 蛋白酶缺失突变体ΔP6形成生物膜的能力
将培养好的ΔP6菌液在玻璃试管中静置培养3 d后,在气液交界面能够观察到附着在试管壁上的细胞,但附着能力比野生型弱.清洗没有附着的游离细胞后,经结晶紫染色能清晰看出ΔP6形成的生物膜较少(图4A).定量测定显示,ΔP6附着在管壁的生物膜比野生型低30%(图4B).因此,胞外蛋白酶缺失降低了Xcc29-1形成生物膜的能力.
2.5 过表达蛋白酶形成的水渍状溃疡斑
过表达ecpA和ecpE基因的Xcc29-1的胞外蛋白水解酶活性都增强(图5A、5B).采用高浓度108CFU·mL-1菌悬液注射接种离体柑橘叶片后,溃疡症状出现的时间未比野生型提前,同在第3天出现水渍状病斑;但在症状发展过程中,过表达菌株形成的溃疡斑水渍状比野生型明显.接种5 d后,野生型菌株诱导的溃疡斑会隆起硬化,呈深绿色,而过表达菌株诱导的病斑呈浅绿色(图5C),这可能是由于蛋白酶对寄主细胞壁的降解作用加剧了植物组织的解离.此外,过表达菌株在柑橘叶片中的繁殖速度加快,而突变体ΔP6在柑橘叶片中的繁殖速度变慢(图5D).
2.6 胞外蛋白水解酶基因在柑橘叶片上的表达
利用qRT-PCR检测了6个编码基因在丰富培养基NB和柑橘叶片中的表达情况.与NB培养条件相比,6个基因的转录水平均在柑橘叶片中增强,其中,ecpA的表达水平增强了6倍多,ecpE基因的增强幅度最大,接近80倍(图6).
3 讨论
在自然发病时,溃疡病的典型症状是形成木栓化突起,伴随有细胞死亡[9];人工注射接种柑橘溃疡病菌后最先出现的可观察症状是水渍状,随着接种部位的细胞膨大和细胞分裂,细胞间隙逐渐丧失,使得细胞壁紧密靠拢,最后形成隆起[13].已有研究表明,植物病原细菌产生的蛋白酶具有组织浸离作用,从Erwiniacarotovora中纯化的蛋白酶还能诱导黄瓜细胞的死亡[19-20].本研究中,采用针刺创伤接种时,Xcc蛋白酶缺失突变体ΔP6在伤口位置形成的木栓化隆起变弱;在注射接种中,形成的水渍状程度也减弱;而过表达菌株的接种会使得注射区域的水渍状表型更明显.因此,Xcc的蛋白酶对溃疡症状的形成有重要作用.
生物膜是细菌产生的一种包围菌体的复杂结构,含有胞外多糖、纤维蛋白、脂蛋白和DNA等多种成分[21].生物膜的形成,使得细菌获得一个天然屏障,阻碍来自寄主植物的抗菌物质,抵抗紫外照射、pH和渗透压变化等多种逆境,也有利于病原细菌在寄主表面的附着,帮助其成功侵染植物[22].Xcc的生物膜在侵染早期可以帮助细菌在寄主表面存活,有利于细菌的侵染和定殖,从而增强其在柑橘寄主上的致病力[23].在基因组学水平上从Xcc306菌株中鉴定出至少92个基因参与生物膜的形成,包括蛋白酶ecpD(XAC0929)基因[14].本研究将Xcc29-1的胞外蛋白酶基因全部敲除以后,突变体形成生物膜的能力明显下降,这与Ⅱ型分泌系统xpsD和xcsD基因突变导致生物膜形成能力下降的结果[24]一致.但Xcc合成的蛋白酶为什么不会对形成生物膜的蛋白组分进行降解,反而会促进生物膜的形成,值得进一步探讨.
虽然胞外蛋白水解酶是植物病原细菌的一个重要致病因子,但是不同种甚至不同生理小种之间胞外蛋白水解酶活性存在差异.一方面,不同病原物所含有的水解酶编码基因数量不同.例如:水稻细菌性条斑病菌S105中只含有1个具有胞外蛋白水解酶活性的基因ecpA[8];而本研究中的柑橘溃疡病菌Xcc29-1菌株则含有6个编码基因.另一方面,不同病原物中同源基因的序列存在多样性.如水稻白叶枯病菌(X.oryzaepv.oryzae)PXO99A中的ecpA基因在第846个碱基位置多出5个核苷酸,造成移码阅读,使得PXO99A没有胞外蛋白水解酶活性[8].
从Xcc29-1的Ⅱ型分泌系统突变后的致病表型推测,单个蛋白水解酶对致病力的影响有限[25].因此,本研究没有详细分析单个蛋白酶缺失对致病力的影响.实验室先前对胞外纤维素酶的研究发现,Xcc29-1对纤维素酶的泌出具有特异性[13];而Xcc29-1对蛋白酶的泌出是否具有特异性尚需进一步验证.

