羊耳菊提取物主要活性成分在大鼠体内的组织分布研究
吕 婷,杨淑婷,陆 苑,巩仔鹏,李勇军,曹 闯,王永林 *
1贵州医科大学 贵州省药物制剂重点实验室/省部共建药用植物功效与利用国家重点实验室;2贵州医科大学 民族药与中药开发应用教育部工程研究中心;3贵州医科大学 药学院,贵阳 550004
羊耳菊为菊科植物羊耳菊(InulacappaDC.)的新鲜或干燥全草。主治疏风散热,解毒消肿。用于感冒发热,咽喉肿痛,风湿疼痛,痈疮疔毒,乳痈[1]。国内已有文献报道了羊耳菊药材的主要成分是黄酮类、酚酸类、香豆素和挥发油等[2- 5],对羊耳菊提取物的抗菌抗炎活性的研究发现,羊耳菊提取物能够有效的抑制金黄色葡萄球菌,并有效抑制细胞释放NO产生抗炎作用[6,7]。课题组前期对羊耳菊进行了大量研究,确定羊耳菊活性部位为60%乙醇提取,用60%乙醇经D101型大孔树脂吸附洗脱得到;通过相似度评价系统确定了多批提取物中7个峰面积比较大的共有峰,分别为酚酸类4,5- 二咖啡酰基奎宁酸、新绿原酸、绿原酸、3,4- 二咖啡酰基奎宁酸、1,3- 二咖啡酰基奎宁酸、隐绿原酸,以及黄酮类木犀草苷,并对羊耳菊提取物不同模型的肠吸收以及代谢物的分析进行了研究[9- 11]。
药物经胃肠道被吸收进入机体后,通过循环系统送达各个组织器官,药物组织分布的特点除了与药物本身的理化性质有关,还与药物和组织的亲和力等因素有密切的关系。因此,了解药物在组织的分布对新药的开发有重要意义[8]。国内外已有文献报道过绿原酸、木樨草甘等在体内的组织分布情况[12,13],其主要分布组织和达到峰值的时间并不相同。本实验在建立UPLC- MS /MS 同时测定大鼠组织中7个代表成分含量的基础上,研究大鼠灌胃羊耳菊提取物后这7个代表成分(化学结构如图1所示)在大鼠体内的组织分布,探讨羊耳菊提取物在大鼠体内的分布特征,为羊耳菊提取物的深度开发和临床准确、安全及合理用药提供参考。
1 材料
1.1 仪器
超高液相色谱- 三重四级杆质谱联用仪(美国Waters公司);MTN- 2800D型氮吹浓缩装置(天津奥特塞恩斯仪器有限公司);Allegra 64R低温高速离心机(美国Beckman Coulter公司);可调高速匀浆机(FSH- 2A普瑞斯机械有限公司)。
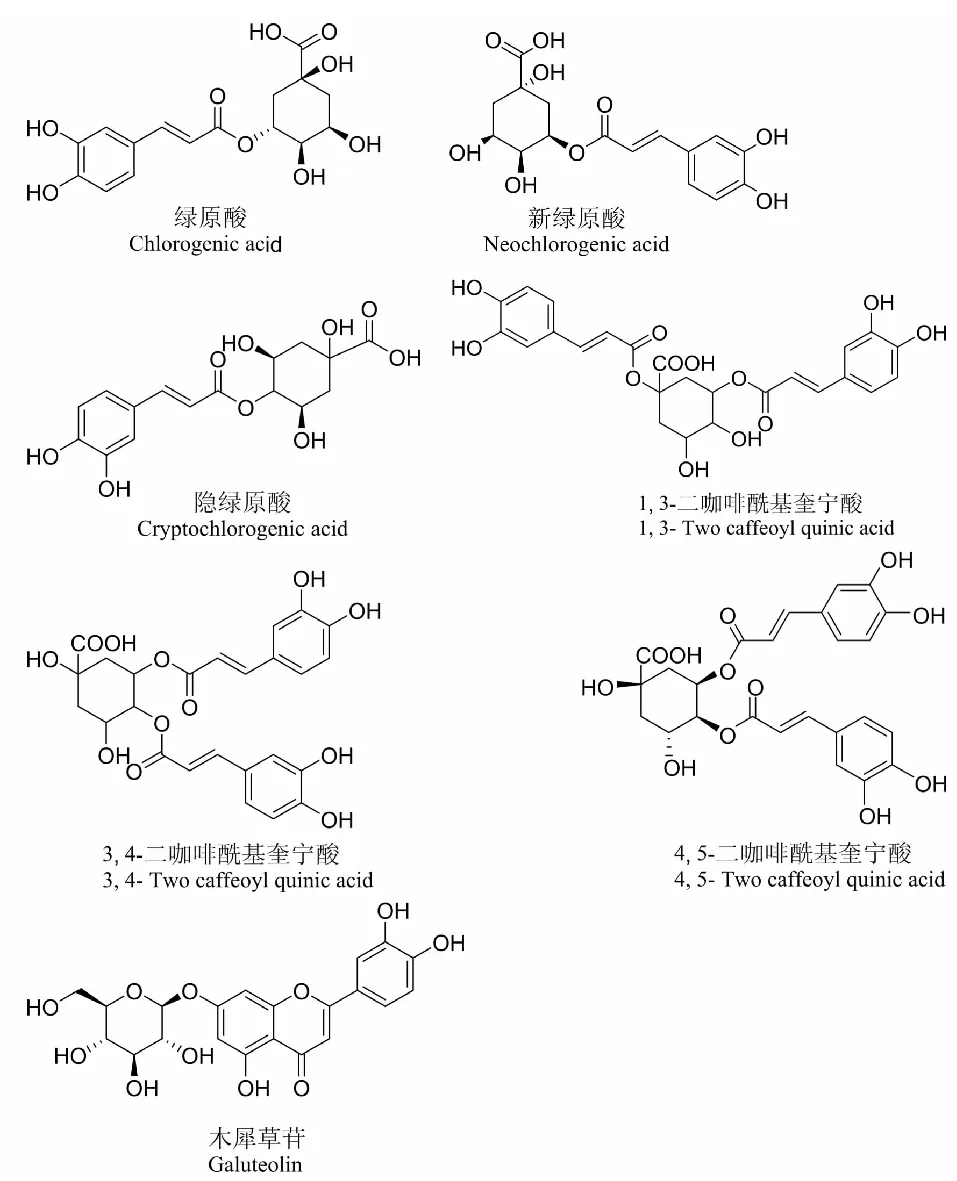
图1 七个指标成分的化学结构Fig.1 Chemical structures of seven index components
1.2 药物与试剂
葛根素、木犀草苷、绿原酸(批号:110752- 201514、111720- 201408、110753- 201415)购于中国食品药品检定研究院,新绿原酸、隐绿原酸、1,3- 二咖啡酰基奎宁酸、3,4- 二咖啡酰基奎宁酸和4,5- 二咖啡酰基奎宁酸(批号:X20- 20141012、Y58- 20141012、1384- 101215、1384- 101215、1384- 101215)均购于中药固体制剂制造技术国家工程研究中心;羊耳菊活性部位(自制,批号:20150316);Cyclosporin A(Biotopped,批号:201412);羊耳菊药材购自贵州龙里县,由贵州医科大学药学院生药学教研室龙庆德副教授鉴定为菊科植物羊耳菊Inulacappa(Buch.Ham.exD.Don)DC.的干燥全草。
1.3 动物
健康SD大鼠24只,♀♂兼用,体质量为250±20 g,由重庆腾鑫生物技术有限公司提供,合格证号:SCXK(渝)2015- 0001。
2 方法
2.1 色谱条件
色谱柱:Acquity UPLC BEH C18(2.1×50 mm,1.7 μm);进样量:2 μL;柱温:45 ℃;流动相A:0.1%甲酸乙腈;流动相B:0.1%甲酸水;流速:0.25 mL/min;梯度洗脱程序:0 min~0.5 min用5% A;0.5 min~1 min用5%~15%A;1 min~3.8 min用15%~18%A;3.8 ~4.0 min用18%~90%A;4.0~5.0 min用90%~5%A。
2.2 质谱条件
电喷雾电离源(ESI);去溶剂气(氮气800 L/h),去溶剂气温度(550 ℃),碰撞气(氩气,50 L/hr),扫描方式为多反应离子监测模式(MRM),检测离子为4,5- 二咖啡酰基奎宁酸m/z515.29~173.08,新绿原酸m/z353.15~191.03,绿原酸m/z353.17~191.04,3,4- 二咖啡酰基奎宁酸m/z515.27~353.15,1,3- 二咖啡酰基奎宁酸m/z515.29~353.16,隐绿原酸m/z353.21~173.08,木樨草甘m/z447.29~2875.02,内标物葛根素m/z417.16~297.07,锥孔电压分别为35、25、25、25、35、35、25、30 V,碰撞电压分别为25、15、15、15、17、17、15、15 eV。
2.3 溶液的配制
内标溶液:精密称取葛根素5.7 mg,置于5 mL棕色容量瓶中,加甲醇溶解并稀释至刻度,得浓度为1.14 mg/mL的葛根素储备液。精密吸取适量储备液逐级稀释至浓度为4 μg/mL的内标溶液。
对照品溶液:分别精密称取4,5- 二咖啡酰基奎宁酸(5.08 mg)、新绿原酸(5.37 mg)、绿原酸(5.17 mg)、3,4- 二咖啡酰基奎宁酸(5.11 mg)、1,3- 二咖啡酰基奎宁酸(5.10 mg)、隐绿原酸(5.10 mg)对照品,分别置于5 mL棕色容量瓶中,加甲醇分别溶解并稀释至刻度;另精密称取木犀草苷(5.11 mg)对照品,置于5 mL棕色容量瓶中,加75%乙醇溶解并稀释至刻度。分别得到浓度为1.02 mg/mL(4,5- 二咖啡酰基奎宁酸)、1.07 mg/mL(新绿原酸)、1.03 mg/mL(绿原酸)、1.02 mg/mL(3,4- 二咖啡酰基奎宁酸)、1.02 mg/mL(1,3- 二咖啡酰基奎宁酸)、1.02 mg/mL(隐绿原酸)、1.03 mg/mL(木犀草苷)的对照品储备液。置于冰箱- 20 ℃保存,备用。分别精密吸取7种对照品储备液适量,用甲醇逐级稀释至系列浓度的标准溶液。
2.4 组织样品收集
健康SD大鼠24只,雄性,体重(230±20)g,给药前12小时禁食,自由饮水。随机分为4组(空白对照组、0.5 h组、1.5 h组、5 h组,每组6只),按照10 mL/kg灌服羊耳菊有效组分提取物(给药剂量为100 g/kg生药量)分别于次日灌胃给以羊耳菊提取物前、给药后0.5、1.5、5 h取出各脏器组织,相应的心、肝、脾、肺、肾、小肠、脑、骨骼肌、胃,用0.9% NaCl溶液洗去表面浮血,滤纸吸干,精密称取各组织0.5 g,并用生理盐水制成25%匀浆,组织匀浆液超声5 min后,5 000 rpm离心10 min,分离上清液于- 80℃冰箱储存,待处理。
2.5 组织样品处理
取上述组织匀浆上层液300 μL,置于1.5 mL离心管中,加入20%甲酸水60 μL,涡混,加入内标溶液20 μL(葛根素4.56 μg/mL),涡混后加入900 μL甲醇沉淀蛋白,涡混5 min,60 HZ超声5 min,10 000 rpm离心6 min,取上清液用氮吹仪在40 ℃下吹干,残渣用300 μL 50% 甲醇水复溶,涡混3 min,超声3 min,10 000 rpm离心10 min,取上清液进UPLC- MS/MS分析。
3 结果
3.1 方法学验证
方法学结果表明,以小肠组织为例,典型色谱结果见图2,组织中所含内源性物质不干扰被测物和内标物的测定,分离度高,被测物峰型好,提示该方法专属性良好;7种指标成分在相应的线性范围内线性关系良好,相关系数r均大于0.99,各成分的定量限分别为4,5- 二咖啡酰基奎宁酸17.21 ng/mL、新绿原酸18.19 ng/mL、绿原酸17.51 ng/mL、3,4- 二咖啡酰基奎宁酸17.31 ng/mL、1,3- 二咖啡酰基奎宁酸17.27 ng/mL、隐绿原酸17.27 ng/mL、木犀草苷17.31 ng/mL;各成分的检出限分为4,5- 二咖啡酰基奎宁酸5.74 ng/mL、新绿原酸6.06 ng/mL、绿原酸5.84 ng/mL、3,4- 二咖啡酰基奎宁酸5.77 ng/mL、1,3- 二咖啡酰基奎宁酸5.76 ng/mL、隐绿原酸5.76 ng/mL、木犀草苷5.77 ng/mL;在各组织匀浆液中的日内和日间精密度RSD值均小于15%,准确度范围为90%~110%,提示该方法准确度、精密度良好,符合生物样品分析方法要求;各组织中提取回收率良好,不存在明显的基质效应,均符合生物样品分析方法要求;各组织样品在自动进样器中放置6 h和反复冻融3次后,样品中7个成分的峰面积偏差均在15%以内,表明各组织匀浆液中待测物在自动进样器中放置6 h和反复冻融3次后的稳定性良好。
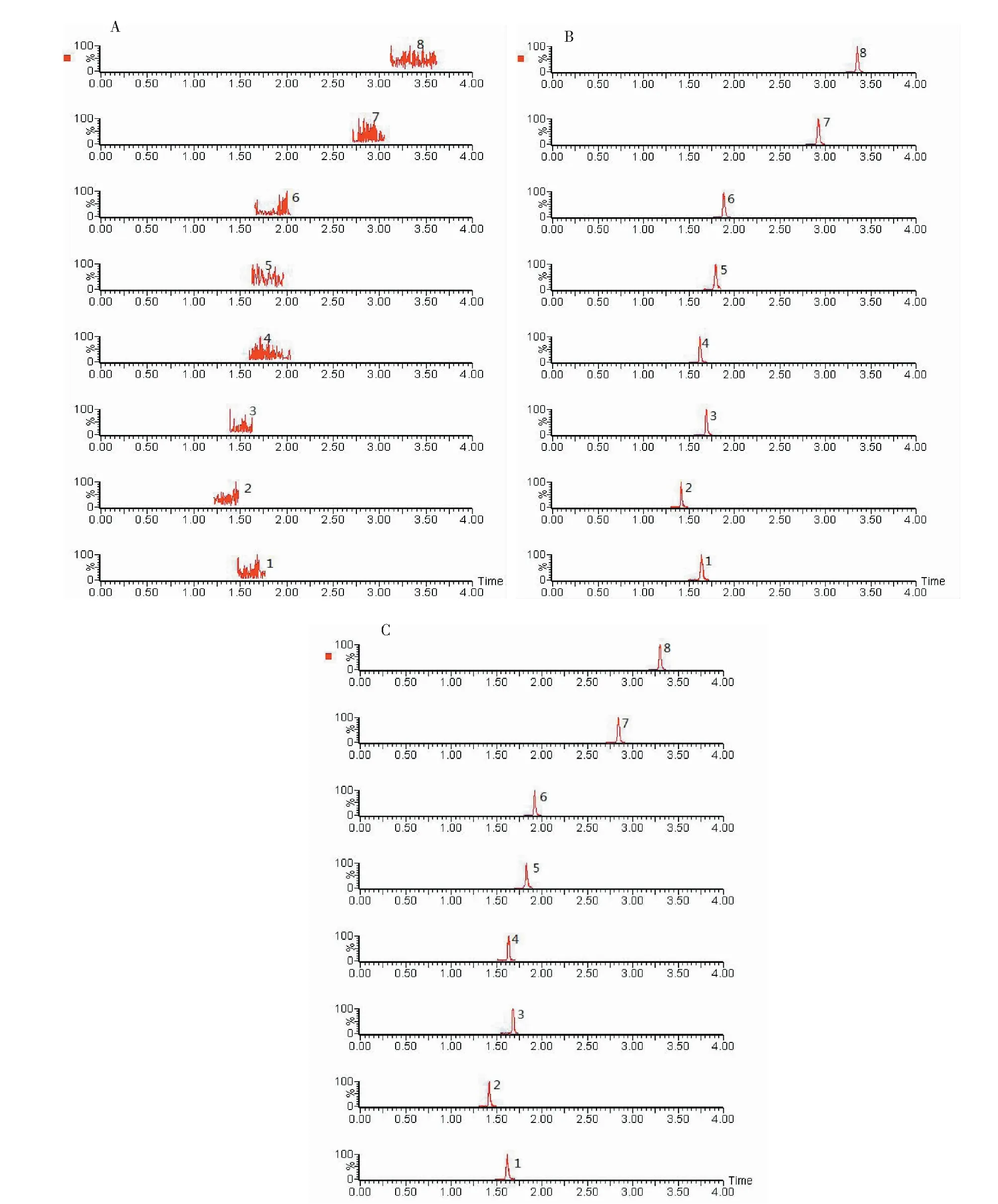
图2 典型UPLC- MS/MS图谱Fig.2 Typical UPLC- MS/MS chromatogram 注:A.空白小肠样品;B.空白小肠加对照品溶液;C.0.5h小肠样品;1.绿原酸,2.新绿原酸,3.隐绿原酸,4.葛根素,5.1,3- 二咖啡酰基奎宁酸,6.木犀草苷,7.3,4- 二咖啡酰基奎宁酸,8.4,5- 二咖啡酰基奎宁酸。Note:A.blank small intestine sample;B.blank small intestine plus control solution;C.small intestine sample under 0.5h;1.chlorogenic acid,2.neochlorogenic acid,3.cryptochlorogenic acid,4.puerarin,5.1,3- two caffeoyl quinic acid,6.galuteolin,7.3,4- two caffeoyl quinic acid,8.4,5- two caffeoyl quinic acid.
3.2 组织分布实验结果
按照“2.5”项下处理各组织样品,照“2.2”项下分析条件进样测定并计算给药后大鼠心脏、肝脏、脾脏、肺脏、肾、脑、小肠、肌肉和胃组织中7种成分的浓度,结果以每1 g 组织含有被测成分的量(ng)表示。
3.2.1 羊耳菊活性部位中新绿原酸的组织分布
羊耳菊活性部位中新绿原酸的组织分布结果见表1所示:新绿原酸不同时间下在心、肝、脾、肺、肾、小肠、肌、胃中均有分布,其中在胃肠道分布较多,其他组织较少,脑组织未检测到。不同组织中的含量(ng/g)在0.5 h时分别为小肠>胃>肾>肌>肺>脾>心>肝;在1.5 h时分别为胃>小肠>肾>肌>脾>心>肺>肝;在5 h时分别为胃>肾>肌>脾>心>肺。
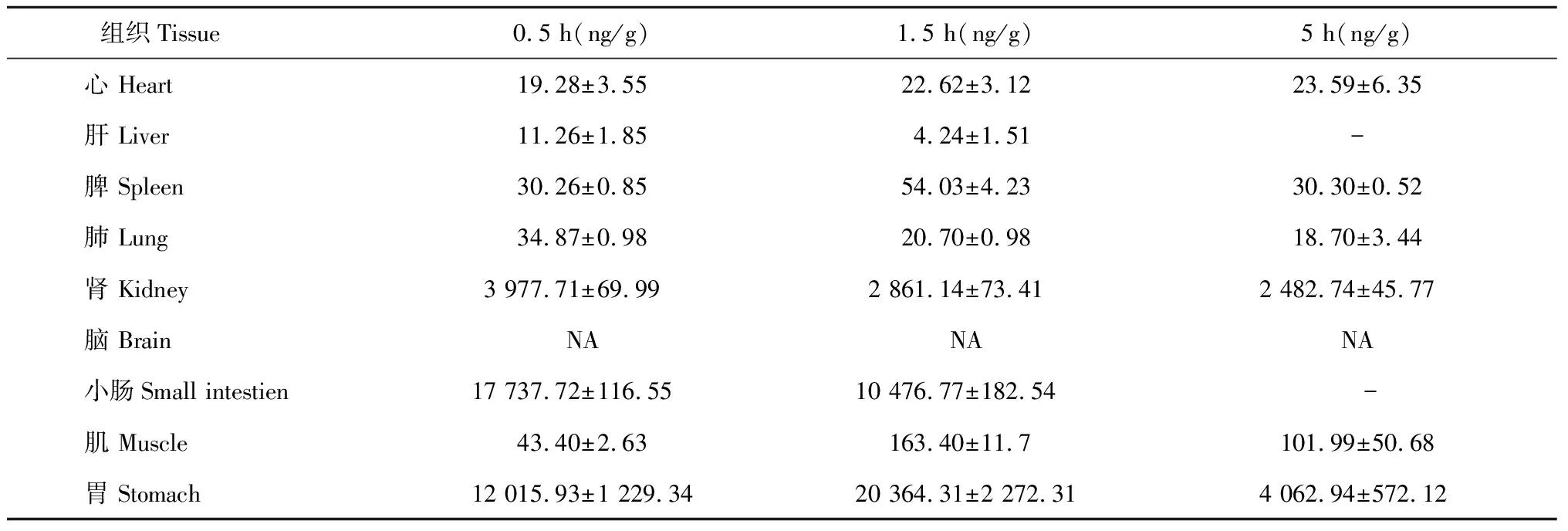
表1 不同时间下新绿原酸在各组织中的分布(Mean±SD,n = 6)
注:“NA”表示低于检出限,“- ”表示低于检测限。
Note:“NA” is below LLOD,“- ” is below LLOQ.
3.2.2 羊耳菊活性部位中绿原酸的组织分布
羊耳菊活性部位中绿原酸的组织分布结果见表2所示:绿原酸不同时间下在心、肝、脾、肺、肾、小肠、肌、胃中均有分布,其中在胃肠道分布较多,其他组织较少,脑组织中未检测到。不同组织中的含量(ng/g)在0.5 h时分别为小肠>胃>肾>心>肌>脾>肺;在1.5 h时分别为胃>小肠>肾>肌>肝>脾>心>肺;在5 h时分别为胃>肾>肌>脾>肺。
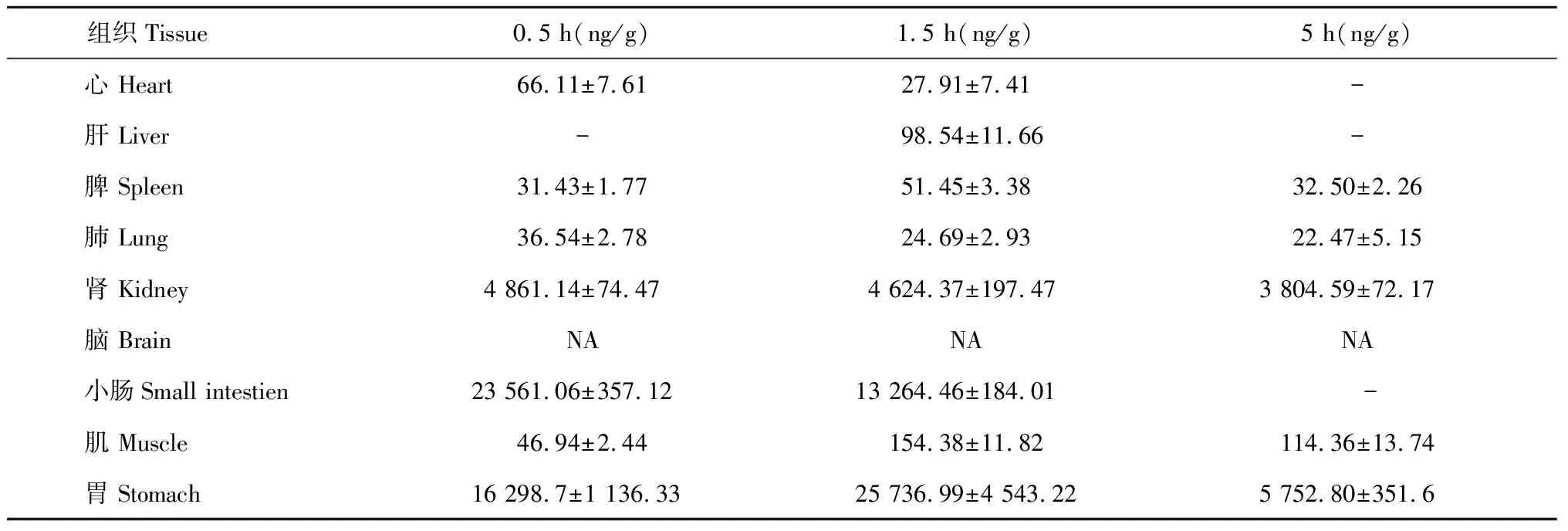
表2 不同时间下绿原酸在各组织中的分布(Mean±SD,n= 6)
注:“NA”表示低于检出限,“- ”表示低于检测限。
Note:“NA” is below LLOD,“- ” is below LLOQ.
3.2.3 羊耳菊活性部位中隐绿原酸的组织分布
羊耳菊活性部位中隐绿原酸的组织分布结果见表3所示:隐绿原酸不同时间下在心、肝、脾、肺、肾、小肠、肌、胃中均有分布,其中在胃肠道分布较多,其他组织较少,脑组织中未检测到。不同组织中的含量(ng/g)在0.5 h时分别为小肠>胃>肾>脾>肝>肺>肌>心;在1.5 h时分别为胃>小肠>肾>肝>肌>脾>肺>心;在5 h时分别为胃>肾>肌>脾>肺>肝。
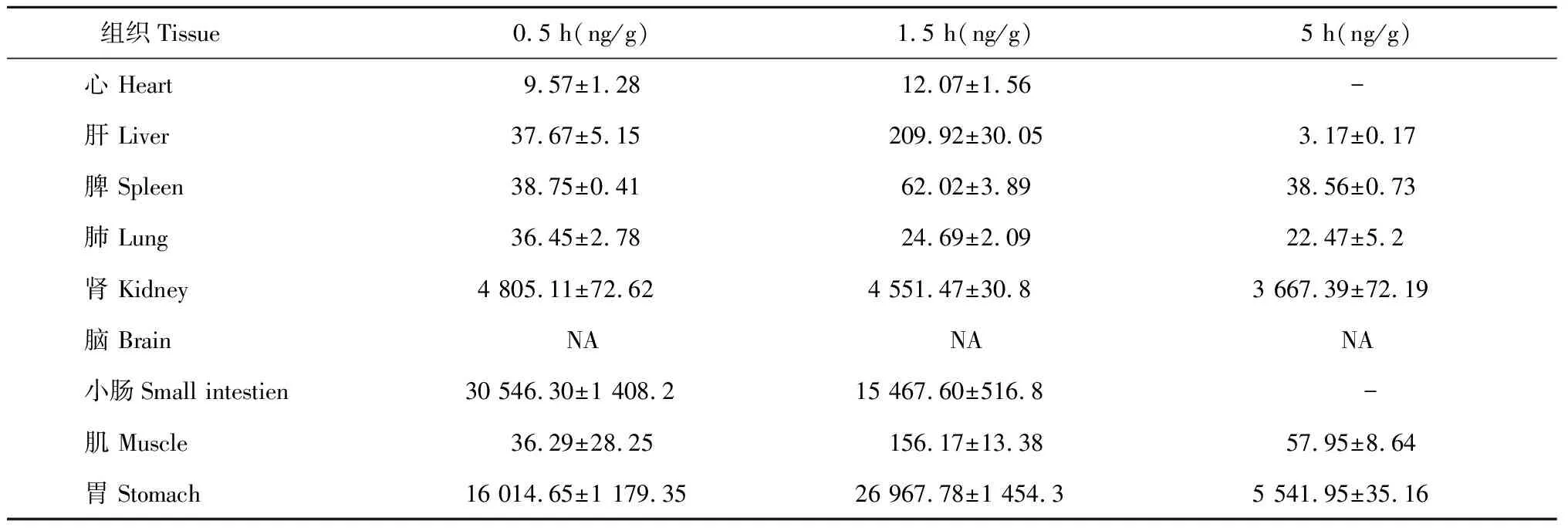
表3 不同时间隐绿原酸在各组织中的分布(Mean±SD,n = 6)
注:“NA”表示低于检出限,“- ”表示低于检测限。
Note:“NA” is below LLOD,“- ” is below LLOQ.
3.2.4 羊耳菊活性部位中1,3- 二咖啡酰基奎宁酸的组织分布
羊耳菊活性部位中1,3- 二咖啡酰基奎宁酸的组织分布结果见表4所示:1,3- 二咖啡酰基奎宁酸不同时间下在心、肝、脾、肺、肾、小肠、肌、胃中均有分布,其中在胃肠道分布较多,其他组织较少,脑组织中未检测到。不同组织中的含量(ng/g)在0.5 h时分别为小肠>胃>肾>心>肝>肌>脾>肺;在1.5 h时分别为胃>小肠>肾>肝>肌>脾>心>肺;在5 h时分别为胃>肾>肌>脾>肺>心。
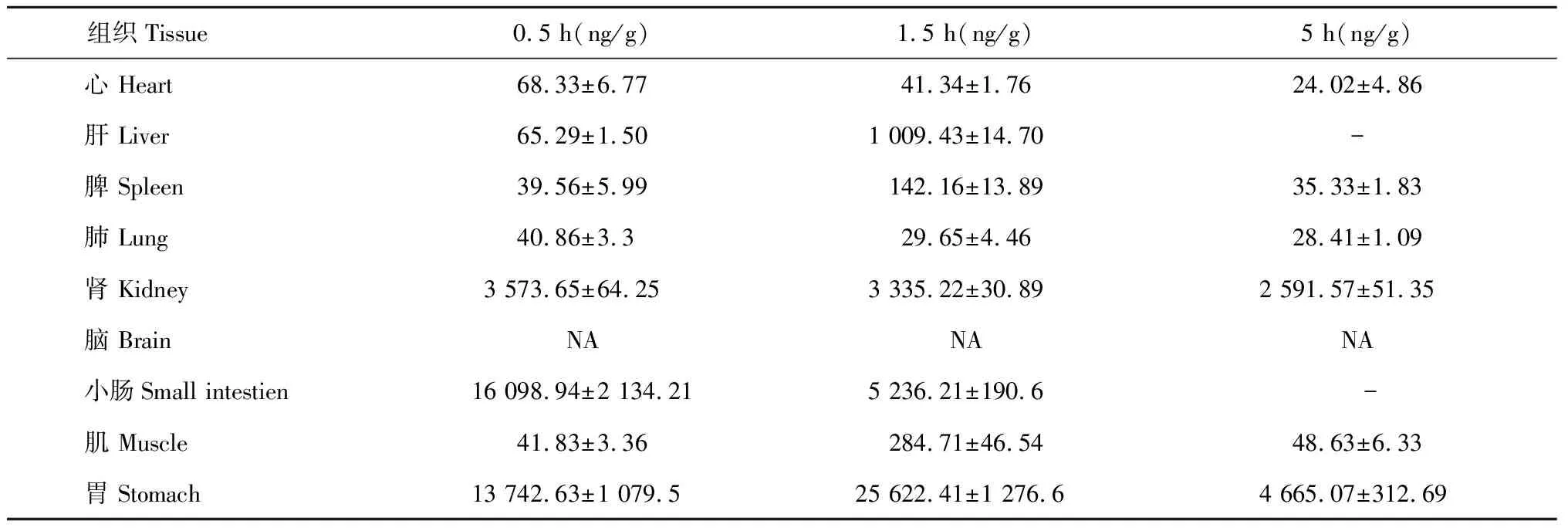
表4 不同时间下1,3- 二咖啡酰基奎宁酸在各组织中的分布(Mean±SD,n = 6)
注:“NA”表示低于检出限,“- ”表示低于检测限。
Note:“NA” is below LLOD,“- ” is below LLOQ.
3.2.5 羊耳菊活性部位中3,4- 二咖啡酰基奎宁酸的组织分布
羊耳菊活性部位中3,4- 二咖啡酰基奎宁酸的组织分布结果见表5所示:3,4- 二咖啡酰基奎宁酸不同时间下在心、肝、脾、肺、肾、小肠、肌、胃中均有分布,其中在胃肠道分布较多,其他组织较少,脑组织中未检测到。不同组织中的含量(ng/g)在0.5 h时分别为小肠>胃>肾>肌>肝>脾>心>肺;在1.5 h时分别为胃>肾>小肠>肝>肌>脾>心>肺;在5 h时分别为胃>肾>肌>心>肺>脾。
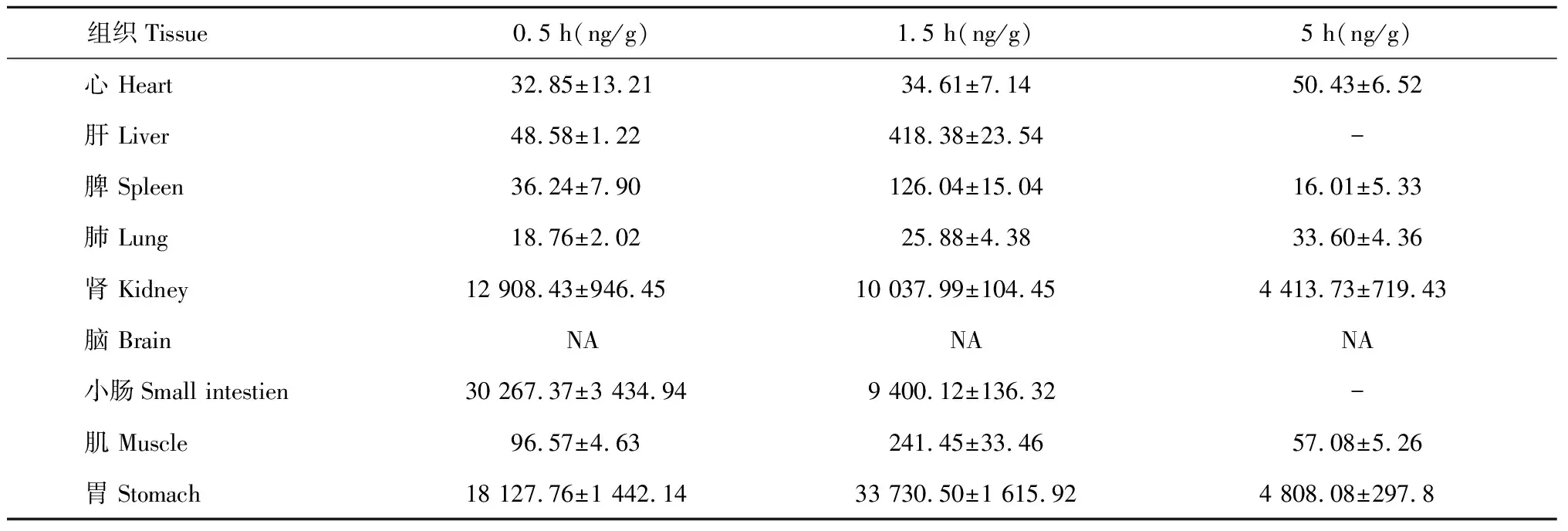
表5 不同时间下3,4- 二咖啡酰基奎宁酸在各组织中的分布(Mean±SD,n = 6)
注:“NA”表示低于检出限,“- ”表示低于检测限。
Note:“NA” is below LLOD,“- ” is below LLOQ.
3.2.6 羊耳菊活性部位中4,5- 二咖啡酰基奎宁酸的组织分布
羊耳菊活性部位中4,5- 二咖啡酰基奎宁酸的组织分布结果见表6所示:4,5- 二咖啡酰基奎宁酸不同时间下在心、肝、脾、肺、肾、小肠、肌、胃中均有分布,其中在胃肠道分布较多,其他组织较少,脑组织中未检测到。不同组织中的含量(ng/g)在0.5 h时分别为小肠>胃>肾>心>肝>肌>脾;在1.5 h时分别为胃>肾>肝>心>肌>脾>肺>小肠;在5 h时分别为肾>胃>心>肌>肺>肝。
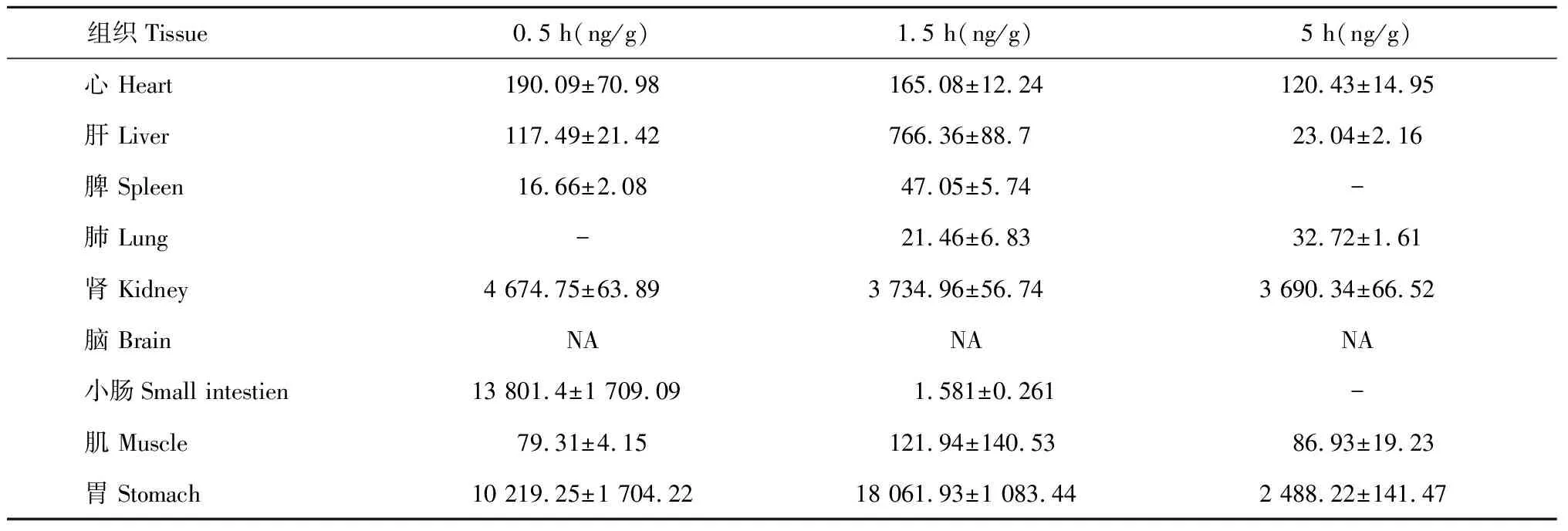
表6 不同时间4,5- 二咖啡酰基奎宁酸在各组织中的分布(Mean±SD,n = 6)
注:“NA”表示低于检出限,“- ”表示低于检测限。
Note:“NA” is below LLOD,“- ” is below LLOQ.
3.2.7 羊耳菊活性部位中木犀草苷的组织分布
羊耳菊活性部位中木犀草苷的组织分布结果见表7所示:木犀草苷不同时间下在心、肝、脾、肺、肾、肌、胃中均有分布,其中在胃分布较多,其他组织较少,小肠与脑组织中未检测到。不同组织中的含量(ng/g)在0.5 h时分别为胃>小肠>心>肾>肝>脾;在1.5 h时分别为胃>肝>心>脾>肾>小肠>肺;在5 h时分别为心>肾>胃>脾>肺。

表7 不同时间木犀草苷在各组织中的分布(Mean±SD,n = 6)
续表7(Continued Tab.7)
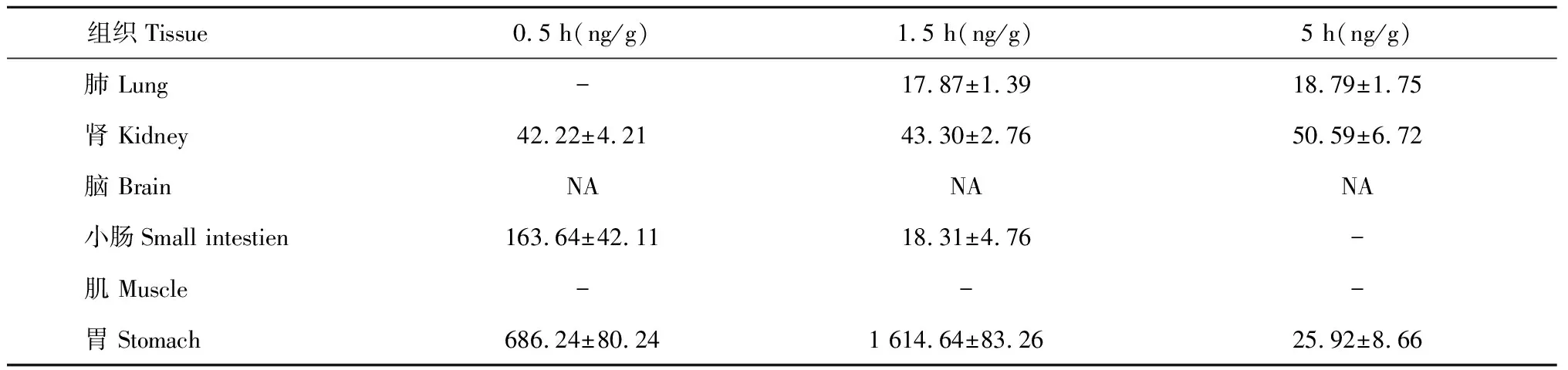
组织Tissue 0.5 h(ng/g)1.5 h(ng/g)5 h(ng/g)肺 Lung-17.87±1.3918.79±1.75肾 Kidney42.22±4.2143.30±2.7650.59±6.72脑 BrainNANANA小肠Small intestien163.64±42.1118.31±4.76-肌 Muscle---胃 Stomach686.24±80.241 614.64±83.2625.92±8.66
注:“NA”表示低于检出限,“- ”表示低于检测限。
Note:“NA” is below LLOD,“- ” is below LLOQ.
实验结果表明,大鼠灌胃给以羊耳菊活性部位提取物后,7种成分的吸收、分布、清除较为迅速,各指标成分在体内无蓄积情况。在给药30 min内,均在小肠内迅速达到峰浓度,给药1.5 h后,7种成分均在脾、胃等组织分布较快。
4 讨论
本研究采用UPLC- MS/MS建立了同时测定羊耳菊活性部位中7种指标成分(新绿原酸、绿原酸、隐绿原酸、1,3- 二咖啡酰基奎宁酸、3,4- 二咖啡酰基奎宁酸、4,5- 二咖啡酰基奎宁酸、木犀草苷)在大鼠体内组织分布的分析方法,经方法学验证,该方法简便快速,专属性强,灵敏度高,分析效率高,适合高通量的生物样品分析。
据报道,绿原酸及其类似物的吸收主要在小肠和结肠,在微生物的作用下转化成多种代谢产物[14]。在本实验中,0.5 h时绿原酸、新绿原酸,隐绿原酸、1,3- 二咖啡酰基奎宁酸、3,4- 二咖啡酰基奎宁酸和4,5- 二咖啡酰基奎宁酸在小肠的浓度最高,证明口服羊耳菊提取物后,6种成分的主要吸收部位在小肠。1.5 h时,小肠内的浓度明显降低,这可能是因为绿原酸类活性物质容易被肠道菌群水解,发生酯基位置异构和脱羟基等反应[15],从而导致此类化合物的浓度明显降低。而在5 h时,6种成分在小肠的含量均低于定量限,证明此时6种成分在小肠内几乎消除完毕。与此同时,实验室进行了羊耳菊灌胃后的药动学实验,后主要的药动学数据如表8所示。
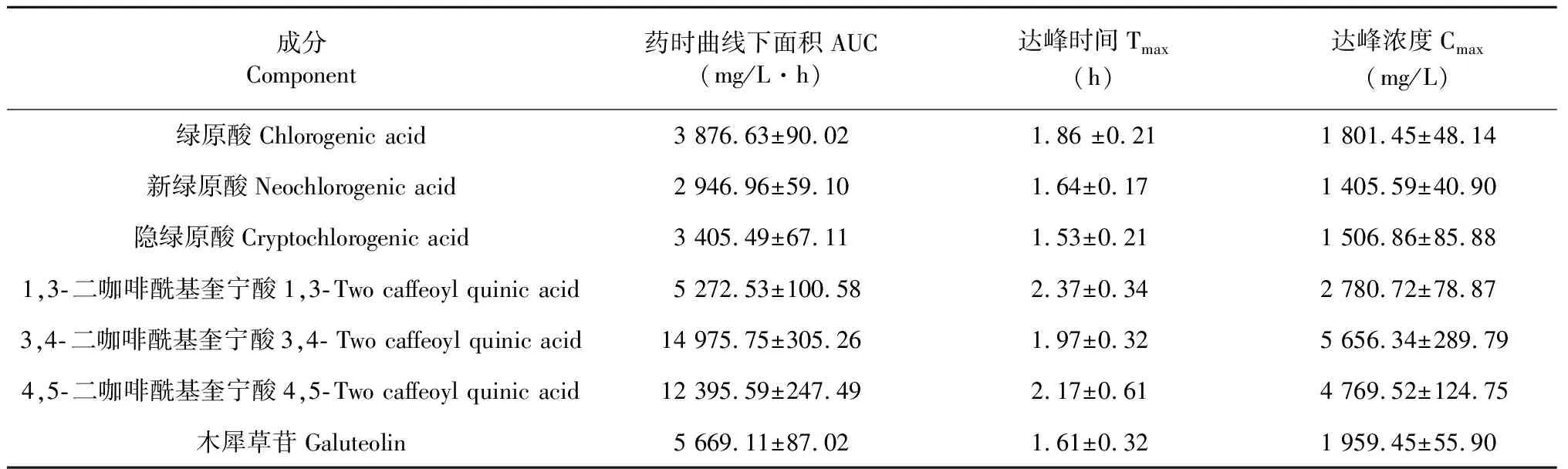
表8 7种成分在正常大鼠血浆中的主要药动学数据(Mean±SD,n = 6)
由实验结果可知,7种成分主要分布在胃、小肠和肾组织中,对肾脏表现出较强的亲和力,推测肾脏可能是羊耳菊提取物的主要排泄器官之一;木犀草苷在肌肉组织中含量较低,说明其吸收入血后迅速分布于其他组织,对肌肉组织亲和力较差;同时脑组织中未检测到该7种成分,但已有文献[12,13]报道过绿原酸和木樨草甘能够入脑,本次实验在脑组织中未检测出该7种成分,原因是含量低于最低定量限,无法做定量分析;同时,本次实验中,绿原酸、新绿原酸,隐绿原酸、1,3- 二咖啡酰基奎宁酸、3,4- 二咖啡酰基奎宁酸和4,5- 二咖啡酰基奎宁酸6个酚酸类成分除小肠与胃两个吸收部位外,主要分布组织为肾脏,这与文献[16,17]报道的一致;6种酚酸类成分在0.5 h时在肾脏浓度达到峰值,之后的浓度逐渐减少,这说明酚酸类成分自尿液中排泄比较迅速[18],在肾脏内不易蓄积。由此可知,羊耳菊中酚酸类、黄酮类成分在大鼠体内的主要分布器官具有一定相似性,同时又存在差异,一定程度上体现了中药多成分、多靶点的作用特点,为进一步研究开发和临床应用提高依据。然而,本实验最后一个取样点时,新绿原酸在心脏组织、3,4- 二咖啡酰基奎宁酸在心脏和肺组织、4,5- 二咖啡酰基奎宁酸在肺组织、木犀草苷在肺和肾组织分别达到了5 h内的浓度峰值,因此无法预测其后续变化趋势。下一步实验将针对这四种成分,延长取样时间点,测定其在相应组织中的浓度,以期明确该成分在组织中的后续变化,为羊耳菊的临床合理使用提供参考。

