2株副溶血弧菌不同盐度下致病性和毒力基因差异分析
黄 倞,王 元,马清扬,英 娜,赵 姝,吴 越,房文红
(1.中国水产科学研究院东海水产研究所,农业部东海渔业资源开发利用重点实验室,上海 200090;2.上海海洋大学水产与生命学院,上海 201306)
凡纳滨对虾(Litopenaeus vannamei)对盐度适应能力强,不仅可以在海水中养殖,经淡化后也可以在淡水中养殖[1],2017年我国淡水养殖凡纳滨对虾产量达到59.1万 t,占其养殖总产量35.5%。然而随着养殖规模的扩大,病害成为制约凡纳滨对虾养殖的重要因素之一,其中由副溶血弧菌(Vibrio parahaemolyticus)引起的急性肝胰腺坏死症,给对虾养殖造成巨大的经济损失[2]。副溶血弧菌是一种广泛存在于海水、半咸水环境中的革兰氏阴性嗜盐菌,不仅感染鱼虾贝等水生动物[3],给水产养殖造成极大损失,而且也是重要的食源性病原菌,可导致腹泻、呕吐等急性肠胃炎[4]。副溶血弧菌可产生耐热性直接溶血素(TDH)、TDH相关溶血素(TRH)和不耐热性溶血素(TLH)3种重要溶血素,其在感染致病过程中发挥重要作用[5]。研究发现,Ⅲ型分泌系统(T3SS)和Ⅵ型分泌系统(T6SS)是与副溶血弧菌致病性密切相关的毒力因子[6-7]。T3SS主要由蛋白复合物形成跨膜分泌管道,似针状结构刺入宿主细胞将效应蛋白直接注入细胞质中,发挥细胞毒性[7]。副溶血弧菌两条染色体上各有一套T3SS系统,在染色体Ⅰ上的命名为T3SS1,在染色体Ⅱ上的命名为T3SS2。T3SS1系统由结构蛋白 (如 VscA1-VscY1、VcrD1、VcrG1、VcrR1、VcrV1)和效应蛋白 (VopQ、VopR、VopS和VPA0450等)构成,主要发挥对宿主细胞的细胞毒性、介导宿主细胞自噬凋亡等作用[8-9]。T3SS2在染色体II的毒力岛上,由类似T3SS1的结构蛋白和7个效应蛋白(VopA/P、VopL、VopC、VopT、VopV、VopZ和VPA1380)构成,主要引起细菌肠毒性和一定的细胞毒性[10-11]、致病性副溶血弧菌不仅出现在海水养殖动物中,在淡水养殖的凡纳滨对虾也有检出[12],但针对不同盐度环境中的副溶血弧菌毒力的研究鲜有报道。本研究选取了2株不同盐度养殖环境中分离的副溶血弧菌,比较2株副溶血弧菌在不同盐度下的致病性、毒力基因携带情况,探索了盐度对它们的毒力基因表达的影响,以期为不同盐度下副溶血弧菌毒力机制研究提供理论依据。
1 材料与方法
1.1 菌株来源
实验用副溶血弧菌海水菌株383分离自海南琼海海水养殖发病凡纳滨对虾,淡水菌株V9分离自上海奉贤淡水养殖发病凡纳滨对虾,鉴定后保藏于本实验室。细菌分离采用TCBS选择性培养基,采用gyrB[13]和 16SrDNA[13]基因对分离细菌进行分子鉴定,生化鉴定结果参照《常见细菌系统鉴定手册》。
1.2 实验试剂
TCBS培养基购自青岛海博公司;胰蛋白胨和酵母提取物购自Oxoid公司;细菌DNA和RNA提取试剂盒分别购自上海生工生物工程股份有限公司和天根公司;逆转录试剂盒和荧光定量PCR试剂盒购自Takara公司;非发酵G-杆菌鉴定试剂盒购自梅里埃公司。基因测序由上海瑞迪生物公司完成。
LB液体培养基配方:称取胰蛋白胨10 g,酵母提取物5 g,加纯水定容至1 L,氯化钠随盐度变化计算添加量。
1.3 不同盐度下弧菌生长速率实验
从TCBS平板挑取菌落,用无菌生理盐水制成菌悬液。移取菌悬液分别接入液体培养基,使2株弧菌悬浊度相近,液体培养基盐度分别为2、10、20、30、40、50、60、70和80,设2个平行。于 28℃、转速 180 r·min-1下培养。取 0、4、12、24、48 h的菌液在酶标仪(Spark 10 m,Tecan)上测定OD600时的吸光值。
1.4 弧菌感染实验
实验在东海所实验基地进行,感染用凡纳滨对虾为实验基地养殖,体长5~7 cm,体质量4~5 g。实验在30 L塑料桶里进行,每个桶放养对虾10尾,海水盐度22,水温控制在24~26℃,充气增氧,投喂适量颗粒饲料,经3 d适应养殖后用于感染实验。
菌株383和菌株V9分别接种于盐度25和2的液体培养基中,28℃恒温培养16 h,配置5个细菌攻毒浓度梯度,采用肌肉注射方式进行攻毒,注射量50μL·尾-1,对照组注射生理盐水和煮沸灭活的菌体。攻毒组与对照组各设置2个平行组,每天记录死亡量,连续观察4 d。半致死浓度计算采用 Bliss法[34]。
1.5 弧菌毒力基因检测
采用 PCR(Mastercycler pro,Eppendorf)对 2株副溶血弧菌的毒力基因进行检测。检测的毒力 基 因 有tdh[14]、trh[14]、tlh[15]、T3SS1[16]、T3SS2[16]、pirA[17]、pirB[17]、orf8[18]、toxR/S[19],其方法和引物参照相应毒力基因的文献,引物由上海生工生物工程股份有限公司合成。
采用荧光定量 PCR(QuantStudio,ABI)检测vcrD1[20]、vopS[20]、vopD1[20]和pirA[17]基因 表 达量,内参基因为pvuA[21],定量PCR引物由上海生工生物工程股份有限公司合成。
1.6 盐度对副溶血弧菌T3SS1毒力基因表达的影响
1.6.1 弧菌培养
将2株副溶血弧菌分别接种于LB液体培养基中,28℃摇床过夜培养,将过夜培养的细菌以1%的比例分别接种于盐度2、10、20和30的LB液体培养基,于180 r·min-1摇床培养。根据生长曲线估计培养时间,在OD600达到0.6时,取菌液4℃离心取沉淀。每个试验组各设2个平行。
1.6.2 总 RNA提取与反转录
总RNA提取:使用TIANGEN细菌RNA提取试剂盒提取副溶血弧菌总RNA,操作在紫外线灭菌的独立RNA实验室中进行。采用1%琼脂糖凝胶电泳检测总RNA的完整性,同时用微量紫外分光光度计(ND5000,百泰克)测定RNA浓度。
反转录:采用DNA水解酶去除总RNA中残留的DNA;采用Takara反转录试剂盒将RNA反转录成单链cDNA,反转录产物cDNA分装后置于-80℃保存。
1.6.3 荧光定量PCR反应体系与条件
反应体系为10μL,其中cDNA 2μL,2×TB Green Premix ExTaqⅡ 5μL,ROX Reference DyeⅡ(50×)0.2μL,10μmol·L-1上下游引物各0.4μL,无菌双蒸水 3μL。反应条件:95℃ 3 min,预变性:95℃ 10 s,55℃ 30 s,72℃ 30 s,40个循环,72℃实时检测荧光信号,同时进行ROX值校正。最后进行RT-PCR溶解曲线分析。
2 结果与分析
2.1 盐度对两株副溶血弧菌生长速率的影响
分析2株弧菌在不同盐度培养基下的生长速率(图1),可以看出:海水菌株383在低盐度下(培养基盐度≤30时)生长速率快,培养12 h即接近生长稳定期;高盐度(盐度>30)时,其生长速率下降,24~48 h达到生长稳定期。淡水菌株V9除盐度80外,在其他盐度下都是在24 h达到生长稳定期。海水菌株383可以在盐度高达80的培养基中生长,而淡水菌株V9在此盐度下几乎不生长;2株弧菌生长达到生长稳定期时,淡水菌株V9浓度明显高于海水菌株383。
2.2 弧菌回感实验结果
感染发病的凡纳滨对虾肝胰腺颜色变淡呈浅白色,萎缩变小,边缘模糊。2株副溶血弧菌感染凡纳滨对虾48 h死亡情况见图2,经计算,海水菌株383和淡水菌株V9的48 h半致死浓度(LD50)分别为1.73×103cfu·mL-1和1.32×105cfu·mL-1,由此可见海水菌株383的毒力明显高于淡水菌株V9。在本实验中,注射灭活菌液和生理盐水对照组未见对虾死亡。
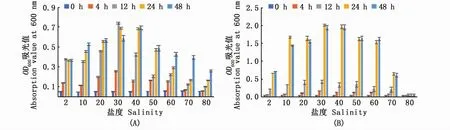
图1 副溶血弧菌在不同盐度下生长速率(n=2)Fig.1 Growth rate of Vibrio parahaemolyticus at different salinities
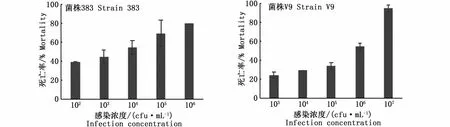
图2 副溶血弧菌肌肉注射感染凡纳滨对虾48 h死亡率(n=2)Fig.2 48 h mortality rate of Litopenaeus vannamei infected by Vibrio parahaemolyticus after intramuscular injection
2.3 弧菌毒力基因携带情况
采用PCR方法对2株副溶血弧菌分别进行tlh、tdh、trh、T3SS1、T3SS2、pirA、pirB、toxR/S、orf8基因检测,检测结果见表1。2株副溶血弧菌tlh、T3SS1、pirA和pirB为阳性,tdh、trh、T3SS2、toxR/S和orf8为阴性。
2.4 盐度对2株弧菌毒力基因表达的影响
对检测结果为阳性的T3SS1基因和pirA基因进行盐度影响的基因表达分析。
不同盐度对2株副溶血弧菌4个毒力基因表达的影响见图3。从4个毒力基因来看,vcrD1表达量较高,其次是pirA,vopD1表达量最低。进一步分析,不同菌株以及盐度对毒力基因表达有较大的影响。海水菌株383的pirA在不同盐度均有表达,在盐度20时表达量最高;而淡水菌株V9的pirA仅在盐度2时有表达,其表达量分别为菌株383在盐度2和盐度20下的54.7%和9.3%。2株菌株vopD1基因在不同盐度下都有表达,均在盐度2时表达量最高。淡水菌株V9的vopS基因在不同盐度都有表达,而海水菌株383在盐度10、20和30有表达,其表达量均低于淡水菌株。在盐度20时海水菌株383的vcrD1基因超高表达,是其他盐度的8.5~17.5倍;淡水菌株V9在盐度2时有表达,在其他盐度下表达量较低。从2个菌株来看,差别最大的毒力基因是pirA和vcrD1。
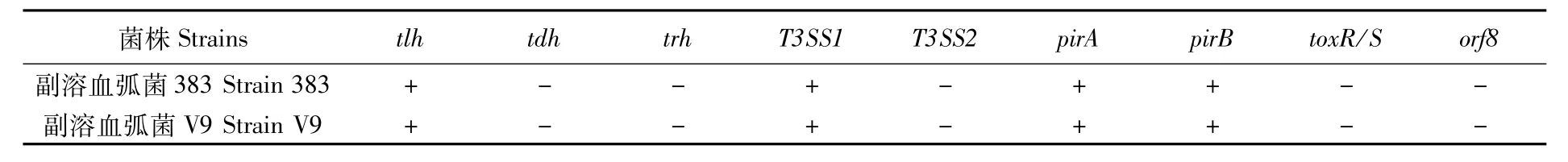
表1 2株副溶血弧菌毒力基因检测结果Tab.1 Detection results of virulence genes of two strains of Vibrio parahaemolyticus
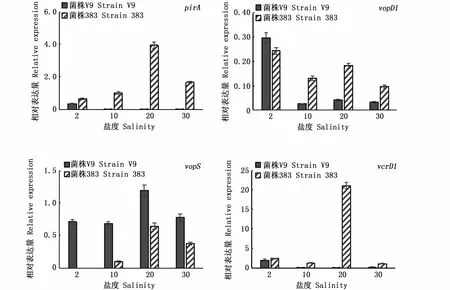
图3 不同盐度下2株副溶血弧菌毒力基因表达量(n=2)Fig.3 Expression of several virulence genes in Vibrio parahaemolyticus at different salinities
3 讨论
3.1 淡水养殖凡纳滨对虾为副溶血弧菌进入淡水环境带来风险
副溶血弧菌为嗜盐菌,多出现在海水和半咸水环境,在淡水及淡水产品中检出率较低[12]。为了提高淡水养殖凡纳滨对虾成活率,在虾苗放养前往往向淡水中添加海水盐提高水的盐度,因此部分弧菌能得以生存且存在致病性[23]。本研究中的淡水菌株正是从该养殖方式下的一例病虾内分离获得的病原菌。从本研究结果来看,淡水菌株适应了低盐度环境后在低盐度下生长速率快于海水菌株,同时对高盐度的耐受力有所下降。由此可见,淡水中养殖对虾为副溶血弧菌侵入淡水养殖品种提供了输入途径,咸化的淡水为副溶血弧菌提供了生存条件。淡水养殖海水对虾,可以导致病原向新的水体输入,应引起一定的重视。
3.2 盐度影响副溶血弧菌毒力基因的表达
环境因素如温度、盐度、酸碱度等都会影响毒力基因的表达,且不同的环境条件对不同毒力基因表达的影响是不一致的[20,23-24]。弧菌是条件致病菌,在外界环境条件稳定时一般不会引起发病,但一些环境因子的改变,例如温度、盐度等均可以调控其致病性相关蛋白的表达,从而影响细菌的致病性[23-25]。溶藻弧菌(V.alginolyticus)在温度28℃、盐度20、培养基初始pH为7时,其T3SS转运蛋白VscO基因表达量最高[25]。迟缓爱德华菌在25℃时分泌的EvpA、EvpC、EseB和EseD蛋白明显多于37℃时;注射感染37℃培养的迟缓爱德华菌,90%的线足鲈(Trichogaster trichopterus)成活,而注射25℃培养的迟缓爱德华菌,则有70%线足鲈死亡[26]。虽然该菌在37℃条件下生长快,但其T3SS输送器蛋白表达较低;在28℃条件下T3SS输送器蛋白表达最高,而在20℃条件下则没有检测到T3SS输送器蛋白的表达。同等温度下,中性和碱性环境比酸性环境更适合细菌生长和T3SS输送器蛋白的表达[27]。本研究中,盐度对副溶血弧菌pirA基因和T3SS1内膜蛋白vcrD1基因表达有较大的影响,不仅存在菌株间的差异,而且同一菌株的不同毒力基因受到的影响也是不同的。盐度对副溶血弧菌毒力基因表达的影响机制还有待进一步研究,以为揭示副溶血弧菌致病机制提供理论依据。
3.3 副溶血弧菌海水菌株和淡水菌株的毒力分析
pirA和pirB最早是在副溶血弧菌中发现的、由质粒介导的重要毒力因子[28],由其引起的急性肝胰腺坏死病(acute hepatopancreatic necrosis disease,AHPND)对全球的对虾产业造成了巨大的损失[28]。患病对虾肝胰腺颜色变淡呈淡白色,部分患病对虾肝胰腺明显萎缩,质地变硬,肠胃变空。2018年有报道,pirA和pirB毒力基因出现在多种弧菌中,均能引起对虾AHPND[29]。
T3SS作为副溶血弧菌的主要毒力因子之一,通过传递与致病有关的毒性因子来发挥病原菌的毒性,而盐度是影响细菌基因表达以及其他生命活动的关键生态因子。副溶血弧菌T3SS1主要是对宿主细胞产生细胞毒性,介导宿主细胞的自体吞噬作用,最后导致细胞死亡。T3SS1在感染过程中与宿主细胞的凋亡有关,对多种细胞系如 HeLa细胞、Raw细胞均具有细胞毒性[1,30]。T3SS2又分为T3SS2α和T3SS2β两种,且两者不能存在于同一株菌中[31];T3SS2β仅存在于 KP+分离株中,与兔回肠袢结扎实验模型中的肠毒性有关[32]。本文2株副溶血弧菌只检测到T3SS1,未能检测到T3SS2。
vcrD1编码的内膜蛋白是组成T3SS1分泌装置基体的一部分,在此基础上针管状结构蛋白才能继续生长。vopD1编码的转运蛋白能在宿主细胞膜表面形成孔洞,效应蛋白沿该通道进入宿主细胞,具有HeLa细胞毒性和接触溶血活性,转运蛋白vopD1高表达有利于T3SS分泌通道的完善,释放分泌蛋白,表现细菌毒性[33]。vopS编码的效应蛋白可导致细胞变圆并通过抑制RhoB家族的鸟苷三磷酸酶导致肌动蛋白细胞骨架崩溃,并且vopS可以阻止Rho家族的鸟苷三磷酸酶与下游的效应蛋白反应,抑制感染细胞内肌动蛋白的重排[34]。
比较分析本研究中2菌株的毒力与pirA、T3SS1效应蛋白基因表达量之间的关系,发现两株菌的pirA和vcrD1表达量相差10倍左右,结合半致死浓度(LD50),两菌株的LD50相差近2个数量级。因此认为,2株副溶血弧菌的毒力强弱可能与pirA和vcrD1的表达量有关。

