正交实验法优选酒洗红花的炮制工艺*
刘彩凤,梁 军,钟琳瑛,张 琦,田湾湾,刘冬涵,白 洁,杜守颖,何枢衡
(1.北京中医药大学中药学院,北京 100029;2.亿帆医药股份有限公司,临安 311300)
红花为菊科植物红花(Carthamus tinctorius L.)的干燥花。夏季花由黄变红时采摘,阴干或晒干;性味辛温,归心、肝经,用于经闭,痛经,恶露不行,癥瘕痞块,胸痹心痛[1];其入药历史悠久,文献记载丰富,是中国的传统及临床常用药材,其炮制品酒红花在历史上也有沿用。最早东汉张仲景的《金匮要略》中记载红花为“红蓝花酒方”,将红蓝花与白酒一起放入锅中,煎减至半,红蓝花即红花[2]。明代《明医》里记载红花为酒洗红花[3]。清代吴仪洛所编写的《本草从新》记载红花为酒红花:“酒喷微焙”[4]。清代柴得华《妇科冰鉴》里“桃红四物汤”这一处方又沿用酒洗红花[5]。红花的酒制品各代不一,且酒洗红花的炮制方法无详细记载,在各版药典及地方炮制规范中也无收录,因此,酒洗红花的研究目前较欠缺。
酒洗这一炮制方法是历代所沿用的一种中药酒制法,一般认为药物经酒洗后,部分可渗入其组织内部,发挥缓性、增效等作用,大黄经酒洗后,可借酒之热,调和大黄之寒[6],地黄经酒洗后,防治寒凉伤胃气[3],也有部分药物经酒洗后可治妇人血气走作疼痛、月水不调及破血通经,如当归、红花,但是对红花来说,目前并没有文献对其酒炮制品的药效和成分进行研究。酒洗最早见于汉代张仲景《伤寒论》大黄“去皮,清酒洗”,用于调胃承气汤中,并且认为“酒洗入阳明经”[7],后来酒洗炮制方法一直沿用,如从唐代、宋代、元代、明代及清代均出现酒洗当归,且现行《上海市中药炮制规范》记载当归酒洗方法为“取当归,喷洒黄酒,拌匀,使之吸尽,晒或低温干燥”。因此,综合地方炮制当归的酒洗方法及《本草从新》中酒红花的炮制方法,作为酒洗红花的炮制依据,文章就对酒洗红花炮制工艺、其酒洗前后含量差异和水煎液指纹图谱进行了一些实验研究,以期对关于酒洗红花研究提供一些科学借鉴。
1 仪器与试药
Thermo Fisher U3000 高效液相色谱仪[DAD 检测器,CM 7.2 色谱工作站,赛默飞世尔科技(中国)有限公司];屹立QE-200 高速万能粉碎机;BSA 224S 电子分析天平[赛多利斯科学仪器(北京)有限公司];JM-B10002 电子天平(余姚市及纪铭称重校验设备有限公司);BT 125D 电子分析天平[赛多利斯科学仪器(北京)有限公司];HH-6 型电热恒温水浴锅(北京科伟永兴仪器有限公司);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司)。
羟基红花黄色素A(hydroxysafflor yellow A,HSYA,批号11637-201810,购自中国食品药品检定研究院);山奈素(批号110861-201611,购自中国食品药品检定研究院);水为娃哈哈纯净水,乙腈、甲醇为色谱纯(美国Thermo Fisher Scientific 公司),其余试剂均为分析纯;黄酒(塔牌绍兴花雕酒,浙江省粮油食品进出口股份有限公司)。
红花购于北京鹤延龄药业发展有限公司。
2 方法与结果
2.1 指标成分的含量测定
2.1.1 色谱条件 HSYA:色谱柱Shim-pack GIST C18(250 mm×4.6 mm,5 μm);流动相:乙腈-甲醇-0.02%磷酸(5∶20∶75);检测波长403 nm;流速1 mL/min 柱温:30 ℃;进样体积10 μL。
山奈素:Shim-pack GIST C18(250 mm×4.6 mm,5 μm);流动相:甲醇-0.1%磷酸(65∶35);检测波长367 nm;流速1 mL/min;柱温:30 ℃;进样体积10 μL。
2.1.2 对照品溶液的制备方法 HSYA:精密称取HSYA 对照品适量,加25%甲醇制成质量浓度为0.626 g/L 的对照品母液。见图1。
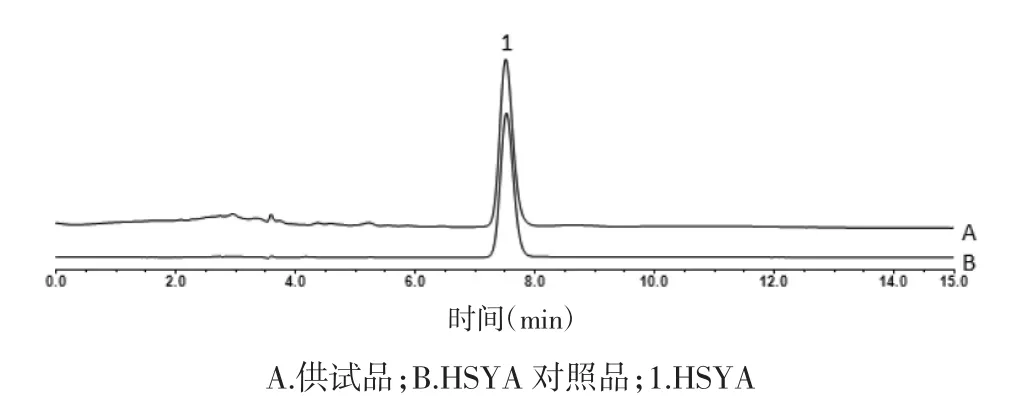
图1 供试品和HSYA 对照品高效液相色谱(HPLC)图
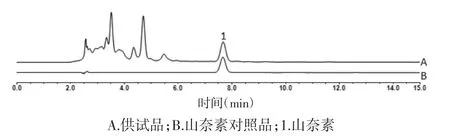
图2 供试品和山奈素对照品高效液相色谱(HPLC)图
山奈素:精密称取山奈素对照品适量,加甲醇制成质量浓度为0.545 g/L 的对照品母液。见图2。
2.1.3 供试品溶液的制备方法 HSYA:取红花粉末(过3 号筛)约0.4 g,精密称定,置具塞锥形瓶中,精密加入25%甲醇50 mL,称定质量,超声处理(功率300 W,频率50 kHZ)40 min,放冷,再称定质量,用25%甲醇补足减失的质量,摇匀,滤过,取续滤液,即得。
山奈素:取红花粉末(过3 号筛)约0.5 g,精密称定,置具塞锥形瓶中,精密加人甲醇25 mL 称定质量,加热回流30 min,放冷,再称定质量,用甲醇补足减失的质量,摇匀,滤过,精密量取续滤液15 mL,置平底烧瓶中,加盐酸溶液(15—37)5 mL,摇匀,置水浴中加热水解30 min,立即冷却,转移至25 mL 量瓶中,用甲醇稀释至刻度,摇匀,滤过,取续滤液,即得。
HSYA:精密吸取HSYA 对照品母液适量,将母液逐级稀释为0.250,0.125,0.063,0.031,0.006 g/L的对照品溶液,进样10 μL,测定。以对照品溶液浓度为横坐标,峰面积为纵坐标进行线性回归,得回归方程为:Y=0.519 8X+1.726 7,R2=0.999 6;结果表明,HSYA 在0.006~0.626 g/L 范围内线性关系良好。
山奈素:精密吸取山奈素对照品母液适量,将母液逐级稀释为0.218,0.109,0.054,0.027,0.005 g/L对照品溶液,进样10 μL,测定。以对照品溶液浓度为横坐标,峰面积为纵坐标进行线性回归,得回归方程为:Y=0.719 1X+1.242 6,R2=0.999 9;结果表明,山奈素在0.005~0.545 g/L 范围内线性关系良好。
2.1.5 精密度实验 分别精密吸取对照品溶液,连续进6 次,进样10 μL,测定对照品溶液中的峰面积值,HSYA 的RSD=0.23%,山奈素RSD=0.32%,结果表明仪器精密度良好。
2.1.6 稳定性实验 取同一份供试品溶液,分别于0,2,4,8,12,24 h 测定,根据峰面积计算HSYA RSD=0.56%,山奈素RSD=1.53%,结果表明供试品溶液中HSYA 和山奈素在24 h 内基本稳定。
2.1.7 重复性试验 精密称取同一批样品6 份,按照“2.1.3”项下方法制得6 份供试品溶液,进样10 μL,记录峰面积,计算含量,HSYA 的RSD=0.32%,山奈素RSD=1.88%,表明这两种方法的重复性良好。
2.1.8 加样回收率试验 精密称取同一批样品6 份,分别精密加入一定量的对照品溶液,按照“2.1.3”项下方法操作得到加样供试品溶液,按上述条件测定,HSYA 方法的平均回收率为97.70%,RSD=0.67%,结果见表1。山奈素方法的平均回收率为97.14%,RSD=2.29%,结果见表2。
3 正交设计优选酒洗红花炮制工艺
3.1 因素水平设计和酒洗方法 本实验以HSYA、山奈素为考察指标,采用正交实验设计法对影响红花酒洗工艺的加酒量、浸吸时间、烘干温度3 因素进行考察,选用了L9(34)正交表安排实验,因素与水平表见表3。
酒洗方法:取净红花,加黄酒喷匀后,浸吸一定时间,以相应的温度烘干至干燥为度。
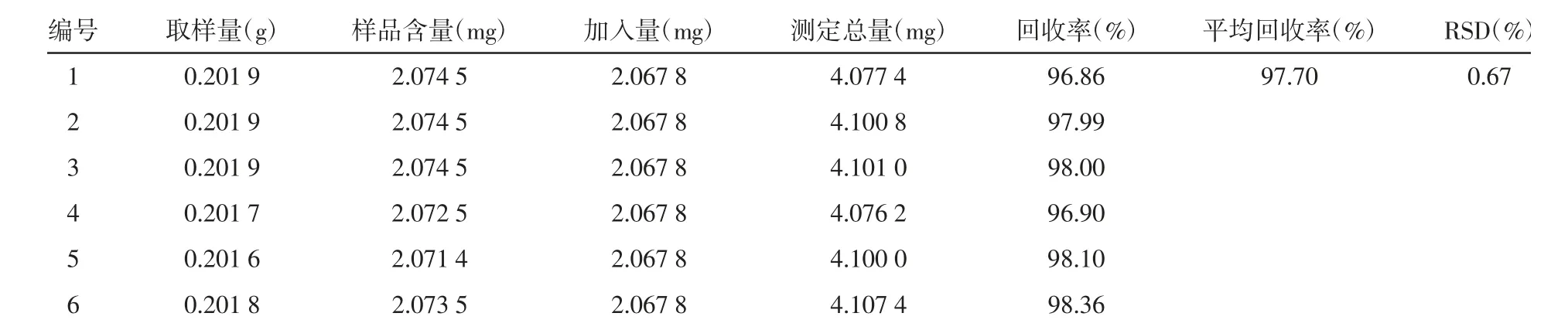
表1 HSYA 加样回收实验结果
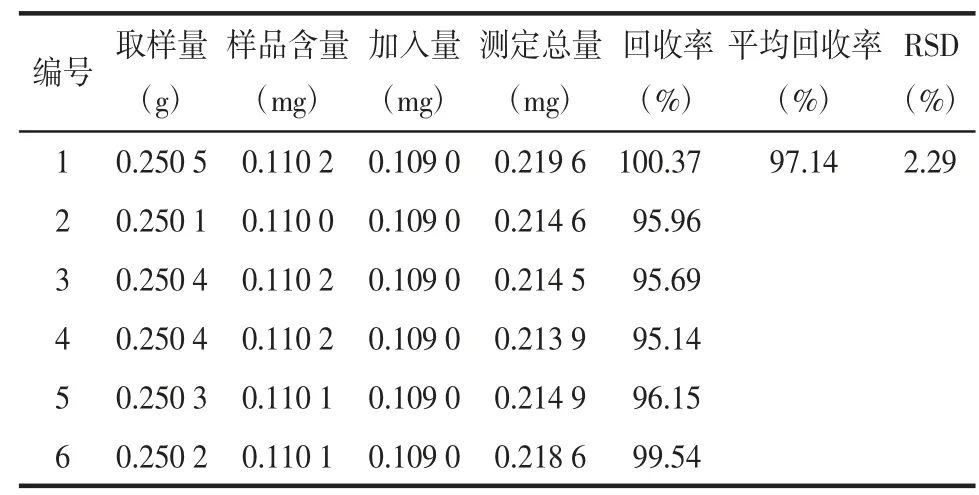
表2 山奈素加样回收实验结果
3.2 样品测定及结果分析 样品测定:精密吸取1~9 号供试品溶液各10 μL,按上述色谱条件测定HSYA、山奈素的含量,以HSYA 和山奈素的综合评分为评价指标。综合评分[8]=(HSYA 含量/最高含量)×60+(山奈素/最高含量)×40。结果见表4 和表5。
结果分析:由直观分析可知,各因素对酒洗红花炮制工艺的影响顺序为A>C>B,方差分析结果发现因素A、C 有显著性差异,B 无显著性差异,其中A1>A2>A3,C3>C2>C1,综合直观分析及方差分析,选取酒洗红花炮制工艺A1B1C1和A1B1C3,即加酒量为50%,浸吸时间30 min,烘干温度40 ℃和加酒量为50%,浸吸时间30min,烘干温度80 ℃进行验证,A1B1C1与A1B1C3中HSYA 和山奈素的含量见表6。
对A1B1C1和A1B1C3中HSYA、山奈素的含量进行统计分析,HSYA P>0.05,山奈素P>0.05,表明HSYA 和山奈素在上述两种工艺条件下,并无显著性差异。依据药典对药材炮制的规定及节约节能的前提下,选取酒洗红花最佳炮制工艺为A1B1C1,即加酒量为50%,浸吸时间30 min,烘干温度40 ℃。
表4 正交实验结果(n=2)

表5 综合评分的方差分析表

表6 验证实验(n=2)%
4 红花酒洗前后的比较研究
4.1 红花酒洗前后的含量比较 将3 批红花按照最优酒洗工艺进行炮制,按“2.1.3”项下供试品溶液方法制备供试品溶液,并分别按“2.1.1”项下色谱条件测定,计算含量,结果见表7。
由上表可知酒洗后,炮制品HSYA 与山奈素的含量较生品稍有偏低,但差异不大。
4.2 红花酒洗前后指纹图谱比较
4.2.1 色谱条件 色谱柱:InertSustainSwiftTMC185 μm(4.6 mm×250 mm);流动相:乙腈-0.1%磷酸溶液;检测波长:230 nm;柱温:30 ℃;流速:1.0 mL/min;进样量:15 μL。
4.2.2 供试品溶液制备 分别取红花生品和炮制品4 g,依照《医疗机构中药煎药室管理规范》煎煮,分两次煎煮,第1 次加水350 mL 煎煮45 min,第2 次加水300 mL 煎煮35 min,用300 目尼龙纱网布过滤,合并两次滤液,定容至500 mL,吸取适量水煎液离心(10 000 r/min,10 min),取上清液,过0.45 μm滤膜,即得。
4.2.3 指纹图谱比较结果 对比红花酒洗前后的HPLC 指纹图谱,见图3。结果显示,炮制后指纹图谱中特征峰数目并无明显变化。为了更直观比较酒洗前后各成分含量的变化,筛选出峰面积≥2 的17 个峰,以5 号HSYA 峰为参照,取其峰面积为1,计算红花炮制前后共有峰的相对峰面积,并将其以柱形图的形式表示,结果见图4。由图看出,在230 nm 的波长下,1~6 号峰在酒洗前后峰面积变化不大;7 号峰在酒洗后峰面积反而明显增加,8~17 号峰在酒洗后峰面积下降,其中以11、13、15 和16 号峰降低明显。
5 讨论
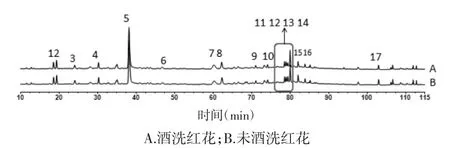
图3 红花酒洗前后水煎液指纹图谱
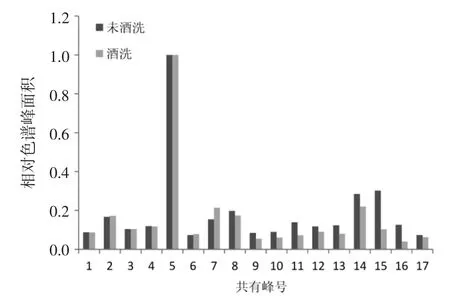
图4 生品和制品共有峰相对色谱峰面积比较

表7 3 批不同产地红花药材炮制品含量测定结果 %
酒洗红花系古文献记载的一种炮制方法,且酒制法在中药炮制中为一种常用方法。红花中含有黄酮类化合物、挥发油、红花多糖、脂肪酸等化学成分,其中红色素和黄色素是查尔酮类化合物,是红花中含有的最主要的化学成分之一,具有改善心肌供血、扩张血管、抗凝血和抗血栓等功效[9-11]。本实验遵循于此,按照酒洗炮制方法,筛选出红花的最佳酒洗工艺为辅料黄酒50%,浸吸时间30min,烘干温度40℃,其中温度符合2015 版《中国药典》对于药材炮制烘干温度的规定。
红花在上述最佳条件酒洗之后,进行多批次含量测定研究,结果显示,HSYA 和山奈素含量较生品低,但含量差异均不大。查阅文献得知[12-17],这种变化可能与两种成分的热稳定性有关,HSYA 是热不稳定性性成分,遇热易分解,山奈素热不稳定性相对HSYA 较好,但在40℃的烘干温度下,两者的变化均不明显。同时,对红花的生品和炮制品进行水煎液指纹图谱比较研究,其水煎液的制备依照《医疗机构中药煎药室管理规范》煎煮,该工艺经前期摸索,煎煮参数稳定可行,且由于水煎液体积大,即使在煎煮中有微小误差,不足以对其水煎液成分的含量产生影响,同时,通过多波长筛选,在230 nm下,红花水煎液的指纹图谱整体峰多、响应值高,尤其小极性成分的响应值整体高于其它波长下,因此,基于此对其进行比较研究,发现红花在酒洗之后,大部分色谱峰峰面积有不同程度的降低,以小极性成分较明显,可能在酒洗的过程中,小极性成分更易溶解在酒中,造成含量损失。虽然红花经酒洗后成分发生变化,但对其药效问题,如可治疗妇人月水不调等,还需进一步深入研究。药效的物质基础是成分,对于指标性成分而言,酒洗炮制后HSYA 和山奈素的含量略有不同程度的降低,这两种成分是药典对红花的指控指标,酒洗炮制后,药效是否有改变还需药理实验验证,应根据药效结果合理的选择酒洗炮制品的指标,从而证明酒洗红花临床应用的合理性。

