实时无标记细胞分析(RTCA)与CCK-8方法条件下LPS对奶牛乳腺上皮细胞增殖的比较分析
吕亚南,赵俭,姚竞杰,安志兴,郭利亚,张晓建
(河南科技学院动物科技学院,新乡 453003)
乳腺炎是泌乳牛乳房容易发生的一种持续性炎症性疾病。革兰氏阴性菌的大肠杆菌是引起奶牛乳腺炎的主要致病菌之一。脂多糖(Lipopolysaccharide,LPS)来源于大肠杆菌的外膜,可刺激乳腺上皮细胞(MAC-T)分泌多种炎症因子、趋化因子等,适合用于炎症状态下MAC-T功能的研究。革兰氏阴性菌的脂多糖在许多其他疾病过程中也表现出相当多样的致病或调节作用,一直是人们关注的焦点。
实时无标记细胞功能分析(real time cell analysis,RTCA),是利用RTCA仪器,采用非侵入性、基于阻抗的实时细胞生物传感器系统,通过镀金传感器电极的电子电阻读数(该电极位于E-Plate16板的底部),对细胞进行不间断、无标记和实时分析[1]。据文献报道,1984年研究人员首次将电子阻抗传感器用于细胞过程的实时检测[2]。微电子芯片测得的电阻抗反映了细胞的生长、伸展、形态变化、死亡和贴壁等一系列生理状态。在电极上细胞较多的情况下,CI值较高。而且阻抗的变化,还与细胞黏附在电极上的宽度、数量和质量有关。RTCA的CI测量可用于细胞群落变化的全面实时监测,具有高度的一致性和可重复性。通过使用这种方法,可以实时监测细胞,并使用CI值作为确定细胞增殖率、细胞毒性效应和迁移能力的指标,而不会中断数据收集或造成外部误差。
此外,在RTCA系统运行期间,可在任何时间间隔进行终点分析,相比显微镜和分子分析等方法具有一定优势[3]。本文利用RTCA S16系统与传统的CCK-8法对LPS诱导MAC-T增殖情况进行监测分析,比较两种方法对奶牛乳腺上皮细胞增殖的影响,以期从中找到最适的方法。
1 材料与方法
1.1 材料
1.1.1 主要试剂
奶牛乳腺上皮细胞(MAC-T)由西北农林科技大学动物医学院惠赠;DMEM/F12培养基购自美国Hyclone 公司;胎牛血清购自以色列Bioind公司;青链霉素混合液、1xPBS均购自新乡智宝生物科技有限公司;脂多糖(LPS)购自美国Sigma公司;Cell Counting Kit-8试剂盒购自北京Solarbio公司;其他化学试剂购自北京Solarbio公司和上海生工生物有限公司。
1.1.2 主要仪器
超净工作台,由苏净集团安泰公司生产;CO2细胞培养箱,由上海三发仪器有限公司生产;全波长多功能酶标仪,由美国Thermo Scientific公司生产;低温冰箱,由青岛海尔股份有限公司生产;电热恒温水浴锅,由上海一恒科学仪器有限公司生产;倒置显微镜,由德国Carl Zeiss AG公司生产;xCELLigence RTCA S16,由艾森生物(杭州)有限公司生产。
1.2 方法
1.2.1 细胞培养
MAC-T在含有10%胎牛血清、1%青链霉素混合液的DMEM/F12培养基中培养,并置于含有5%CO2的37℃培养箱中进行培养。待细胞覆盖瓶底 85%左右时进行传达,传至第3代后可用试验。
1.2.2 CCK-8法测定细胞活力
CCK-8法是利用加入的WST-8[化学名:2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐]被细胞中的脱氢酶还原为一种高度水溶性的黄色甲臜染料来测定细胞数量。此时用酶标仪测定450nm波长处的OD值,在一定细胞数的范围内,生成的甲瓒产物的数量与活细胞数量成正比,测定的OD值越大,活细胞数则越多。
实验时设置调零孔、对照孔(3个重复)、LPS孔(每组3个重复)。调零孔不加细胞;对照孔加细胞的培养基中不含LPS;LPS孔加含不同浓度的LPS处理液。将1×104/mL MAC-T接种于96板各孔中,待细胞生长汇合度达到60%~75%时,弃去完全培养基,并用PBS冲洗两次,使用无血清DMEM/F12培养基代替旧培养基进行6h左右的饥饿培养。之后使用不同浓度的 LPS(0、5、10、20ng/μL)处理液与乳腺上皮细胞分别孵育3h和6h,弃去培养液,用37℃预热的PBS缓冲液清洗上皮细胞2次,加入无血清 DMEM/F-12 的培养液90μL+10μLCCK-8溶液,将96孔板置于培养箱内孵育4h,用酶标仪测定在450nm处各孔的A值,并计算不同浓度LPS刺激不同时间对MAC-T生长的影响。
细胞活力(%)=[A(LPS)-A(空白)] / [A(O LPS)-A(空白)]×100%
1.2.3 RTCA 法测定细胞增殖
在细胞接种前,向E-Plate板的每个微孔中加入50μL培养基,并在10min内将E-Plate板放入RTCA内进行背景阻抗值检测。将1×104/mL MAC-T接种于RTCA 的E-Plate 16板各孔中,将E-Plate板置于室温下孵育30min,使初始细胞黏附于每个孔的底部。此后,将E-Plate 板安装在RTCA上,置于37℃、5%CO2培养箱中。待细胞生长至对数期时,吸去完全培养基,并用PBS冲洗两次,使用无血清DMEM/F12培养基代替旧培养基进行6h左右的饥饿培养,之后每组分别加入不同浓度的LPS(0、5、10、20ng/μL)处理液,每组3个重复。显示仪器正常工作的对照组的E-Plate的微孔中只含有培养基不含细胞。全程每15min测量一次阻抗值,直至试验结束。
1.3 统计学方法
采用 SPSS 17.0软件进行统计学分析,所有数据表示为平均值±标准差(SD)。采用单因素方差分析对试验结果进行多重比较。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 CCK-8方法条件下不同LPS浓度对奶牛乳腺上皮细胞(MAC-T)增殖的影响
CCK-8检测结果显示,LPS作用3h和6h后对奶牛乳腺上皮细胞(MAC-T)均有抑制作用。同一作用时间随着LPS浓度增加,MAC-T的活力逐步下降。5ng/μL处理 MAC-T 3h、6h,对MAC-T活力没有明显影响(P>0.05),当浓度达到10ng/μL 时会明显抑制细胞活力(3h:P<0.05,6h:P<0.01),当浓度达到20ng/μL时能显著降低细胞活力(3h:P<0.01,6h:P<0.01),表明LPS对MAC-T增殖的影响依赖其浓度和作用时间(图1和图2)。

图1 不同浓度LPS作用不同时间对MAC-T活力的影响
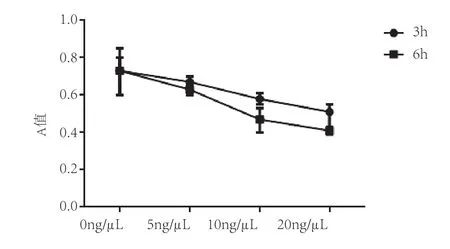
图2 不同浓度LPS作用不同时间对MAC-T生长的影响
2.2 RTCA条件下不同浓度LPS对奶牛乳腺上皮细胞(MAC-T)生长的影响
RTCA结果显示,在72h的实时监测中,与不加LPS的对照组相比,不同浓度的LPS组均对MAC-T生长有抑制作用。5ng/μL和10ng/μL对MAC-T生长有轻微的抑制作用,但不同浓度对细胞生长无明显影响。20ng/μL浓度的LPS对细胞生长有明显抑制作用。在起始阶段加入LPS时(<1h),细胞出现应激反应,表现在细胞CI值降低,但随着孵育时间的延长,细胞曲线趋于平稳,更准确地代表了细胞真实的生长状态。CI值可随时间和剂量而变化,在试验期间产生时间依赖性和剂量依赖性阻抗曲线。与对照组(LPS 0ng/μL)相比,高浓度LPS(20ng/μL)处理的MAC-T,其CI值明显降低,表明高浓度LPS对MAC-T具有毒性作用,可明显抑制MAC-T增殖(图3)。
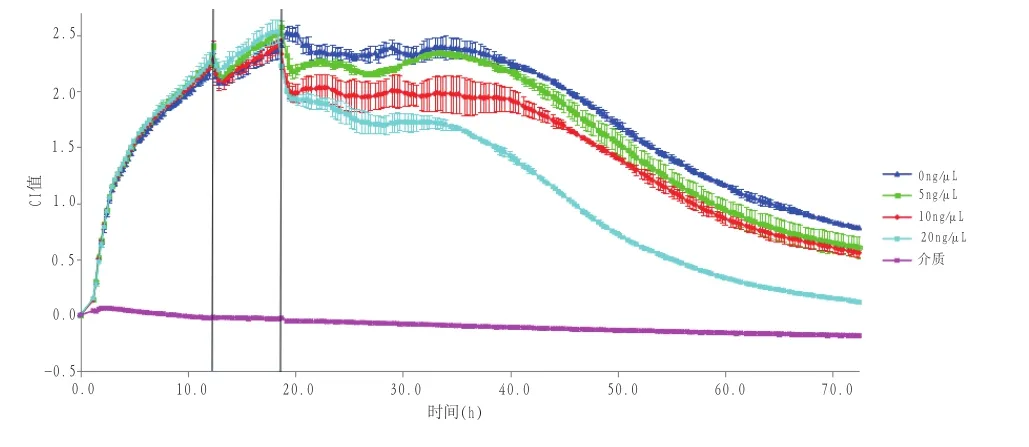
图3 RTCA监测LPS对MAC-T生长的影响
3 讨论
RTCA系统分析方法具有许多优点,在接近细胞生理状态的条件下进行实时检测,能实现全过程自动检测、连续检测的动态化信息数据采集,具有较高的准确性、重复性,能提供较大的动态检测范围和较高的信息含量[4]。相比较CCK-8方法,RTCA法操作简便并且试验方法简单,实验参数相对较小,可进行快速数据处理。有研究者用RTCA与传统的荧光细胞活性分析法和计算每个孔的人工细胞实际数量两种方法检测细胞生长率,结果显示RTCA监测效果更有优势和效率[5]。此外,有学者用RTCA考察最佳细胞培养条件和分析的重复性,得到了预期较好的结果[6]。也有研究表明,RTCA可用于评估某些药物的临床前心脏安全性,并可以一种方便的方式提供相对较高的浓度,以筛选药物的潜在心脏毒性[7]。Kustermann等使用RTCA,通过记录化合物对细胞作用的时间动力学来测量细胞毒性药物引起的细胞抑制,这表明基于阻抗的实时细胞分析可作为一种方便的筛选工具用于进一步的表征体外毒性观察[8]。另外,细胞指数的下降不仅是由于细胞毒性,也可能是其他混杂因素存在造成的。因此,RTCA可以追踪整个试验期间的细胞生长情况,与基于终点的方法CCK-8等相比,使用RTCA更容易注意到细胞生长的抑制,在细胞抑制剂研究中尤其有效[9,10]。本试验基于细胞阻抗检测细胞活力,与CCK-8方法结果一致,在对两种方法进行比较的同时,也对LPS对MAC-T活力进行双重验证,在最大LPS浓度20ng/μL时,奶牛乳腺上皮细胞的活力表现为最低,两种方法的有效性统一,证明了RTCA方法的可行性较好。
乳牛乳腺炎对奶牛业危害很大,大肠杆菌、金黄色葡萄球菌和链球菌是引起奶牛乳腺炎的病原体,其中,以大肠杆菌为代表的革兰氏阴性菌占很大比例。LPS作为革兰氏阴性菌的细胞壁外膜的主要成分,常被用作诱导奶牛乳腺炎的刺激物。本研究发现不同浓度LPS对MAC-T作用不同时间后,随着浓度的增加和时间的延长,MAC-T活力呈现依赖性逐渐降低。本研究对比发现了LPS对MAC-T生长增殖的影响,但试验条件仅能够简单反映炎症条件下的MAC-T增殖状态,而是否能建立LPS诱导MAC-T的炎症模型,还需进一步经ELISA和qPCR给予验证。
4 结论
本研究利用RTCA与CCK-8两种方法分析LPS对奶牛乳腺上皮细胞增殖的影响,发现RTCA方法可有效地弥补CCK-8方法测定细胞增殖的局限性,用于实时性测试细胞增殖的效果更好,可作为研究细胞增殖的较好方法使用。

