MPO作为奶牛隐性乳房炎诊断指标的研究
牛国庆,武果桃,任杰
(1.太原市小店区畜禽繁育工作站,太原 030032;2.山西省农业科学院畜牧兽医研究所,太原 030032)
目前,乳房炎仍然是影响奶牛生产效益的主要负面因素之一[1],不仅降低奶牛生产性能,严重时可导致奶牛淘汰。据报道,国内奶牛乳房炎的发病率大约是20%~70%,每年造成的直接经济损失超过21亿人民币。相对于临床型乳房炎,奶牛隐性乳房炎流行面广,为临床型乳房炎的15~40倍[2],约占乳房炎的90%[3~5],不但引起产奶量降低(可降低4%~10%),还影响乳品质量及奶牛繁殖[6,7]。奶牛隐性乳房炎因无临床症状,不易发现而容易被忽视,如不积极采取措施易转变为临床型乳房炎。因此,研究一种方便快捷、特异性好、可推广使用的检测方法,对隐性乳房炎患牛做出早期诊断并加以预防,对减少奶牛业经济损失具有重要意义[8]。
国内外奶牛隐性乳房炎的检测方法有体细胞数(SCC)检测法、手握式导电仪检测法、凝固酶试验(TCT)、单克隆抗体的免疫方法、DNA指纹图技术检测法、PCR检测法等,这些方法大多需在专业实验室才能完成,而且在临床应用时不能够快速、简便地做出诊断。目前应用先进的ELISA试剂盒来检测奶牛隐性乳房炎是一个快速简便的诊断思路。本试验基于ELISA的诊断方法,研究髓过氧化物酶作为奶牛隐性乳房炎诊断指标的早期监测效果。
髓过氧化物酶(myeloperoxidase,MPO)是PMN、单核细胞、巨噬细胞释放的嗜天青颗粒的主要成分[9,10],并在炎症过程中扮演着吞噬和溶菌的重要角色。MPO是乳房炎的指示性酶类物质,其在哺乳动物体内抵抗微生物的作用已得到证实。瑞典的国家兽医研究所于1994年制备了奶牛MPO的单克隆抗体,建立了针对牛乳中MPO的MPO-ELISA方法。本试验旨在研究奶牛隐性乳房炎发生时MPO与SCC及病原微生物的相关性,将MPO作为奶牛隐性乳房炎的指示性物质,通过ELISA方法分析乳汁中MPO的量,以确定奶牛是否患隐性乳房炎[11]。通过MPO的研究对奶牛隐性乳房炎的检测将上升到分子水平。目前,国内还未见关于奶牛乳房炎的MPO研究报道。
1 材料与方法
1.1 试验动物
太原市小店区某规模奶牛场隐性乳房炎泌乳奶牛200头。
1.2 测试试剂及仪器
牛髓过氧化物酶(MPO)酶联免疫分析(ELISA)试剂盒。
酶标仪:芬兰(Labsystems Multiskan MS),仪器型号:35 2型;洗板机:芬兰(T h e r m o Labsystems),仪器型号:AC8;离心机:微量高速离心机(国产),仪器型号:TG16W;培养箱:隔水式恒温培养箱(国产),仪器型号:GNP-9080。德国进口的FOSS5000红外线牛奶成分分析仪和FOSS5000体细胞测定仪。
1.3 试验方法
1.3.1 奶样采集
所有奶样来自某规模化奶牛场的荷斯坦牛。奶样采集用消毒取样瓶,用取样器无菌采取奶样,每头采集2份,每份10mL。其中1份用于体细胞计数或CMT测定,另1份-4℃~-20℃保存送测试中心用于MPOELISA测定。
1.3.2 MPO-ELISA检测方法
应用双抗体夹心法测定样本牛奶中的髓过氧化物酶(MPO)水平。用纯化的MPO抗体包被微孔板,制成固相抗体,向包被单抗的微孔中加入MPO,再与HRP标记的MPO抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB显色。TMB在HRP酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的MPO呈正相关。用酶标仪在450nm波长下测定吸光度(OD值),通过标准曲线计算样品中MPO的含量。
1.3.3 MPO、SCC相关性分析方法
利用德国进口的FOSS5000红外线牛奶成分分析仪和FOSS5000体细胞测定仪分析乳成分及SCC,每小时可分析奶样150份。得出数据后导入DHI软件系统中进行数据处理,形成DHI报告后与理想的DHI参数进行对比分析,然后进行MPO与SCC检测结果的相关性分析。
1.3.4 MPO、CMT相关性分析方法
选疑似隐性乳房炎泌乳奶牛60头,共233个乳区乳样,进行CMT检测,并进行MPO与CMT检测结果相关性分析。
隐性乳房炎CMT法结果表示方式:阴性(-)表示为0,可疑(±)表示为1,弱阳性(+)表示为2,阳性(++)表示为3,强阳性(+++)表示为4。
操作步骤:在酶标包被板上设标准品孔10孔,在第一、第二孔中分别加标准品100μL,再加标准品稀释液50μL,混匀;然后从第一孔、第二孔中各取100μL分别加到第三孔和第四孔,再在第三、第四孔分别加标准品稀释液50μL,混匀;然后在第三孔和第四孔中先各取50μL 弃掉,再各取50μL分别加到第五、第六孔中,再在第五、第六孔中分别加标准品稀释液50μL,混匀;混匀后从第五、第六孔中各取50μL分别加到第七、第八孔中,再在第七、第八孔中分别加标准品稀释液50μL,混匀后从第七、第八孔中分别取50μL加到第九、第十孔中,再在第九、第十孔分别加标准品稀释液50μL,混匀后从第九、第十孔中各取50μL弃掉。(稀释后各孔加样量都为50μL,浓度分别为120U/L、80U/L、40U/L、20U/L、10U/L)。分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔。
在酶标包被板上待测样品孔中先加样品稀释液40μL,然后再加待测样品10μL(样品最终稀释度为5倍)。将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀;用封板膜封板后置37℃温育30min;将30倍(48T的20倍)浓缩洗涤液用蒸馏水30倍(48T的20倍)稀释后备用;小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30s后弃去,如此重复5次,拍干;每孔加入酶标试剂50μL,空白孔除外;用封板膜封板后置37℃再温育30min;再洗涤;每孔先加入显色剂 A 50μL,再加入显色剂 B 50μL,轻轻震荡混匀,37℃避光显色15min;每孔加终止液50μL,终止反应(此时蓝色立转黄色);空白孔调零,以450nm波长依序测量各孔的吸光度(OD值)。测定应在加终止液后15min以内进行。计算方法:以标准物的浓度为横坐标,OD值为纵坐标,在坐标纸上绘出标准曲线,根据样品的OD值由标准曲线查出相应的浓度;再乘以稀释倍数;或用标准物的浓度与OD值计算出标准曲线的直线回归方程式,将样品的OD值代入方程式,计算出样品浓度,再乘以稀释倍数,即为样品的实际浓度。
1.4 统计方法
采用SPSS12统计软件分析处理数据。多个样本均数的比较用单因素方差分析,检验结果P<0.05为差异有统计学意义。
2 结果与分析
2.1 奶样中MPO-ELISA的测定范围和特异性
MPO标准品按浓度梯度进行稀释(见表1),以标准物的浓度为横坐标,OD450nm作为纵坐标绘制标准曲线(图1)。
由图1可知,拟合直线回归方程为:Y=-1.9535+72.7047X(r=0.9987),浓度与吸光值拟合度较优,表明该方法检测α1-AGP的含量比较可信。
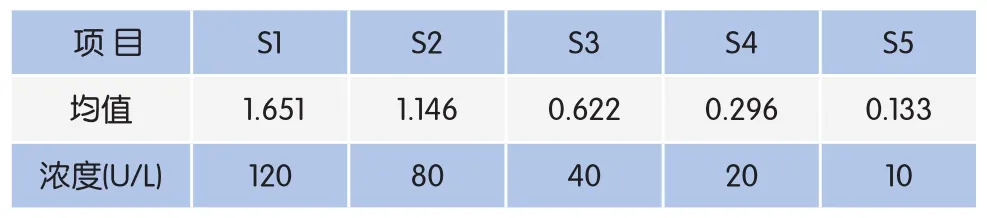
表1 MPO标准品浓度梯度
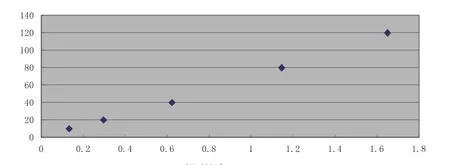
图1 奶样中MPO-ELISA
2.2 奶样中MPO与SCC相关性标准曲线

图2 奶样中MPO、SCC相关性试验结果

表2 奶样中MPO、SCC相关性结果
图2、表2结果表明:在不同体细胞数(SCC)的奶样中,随着SCC的增高,MPO含量也增多,奶样中SCC、MPO含量有一定正相关关系(r=0.257)。鉴于奶液中的SCC、MPO指标在一定范围内相关,且具有很规律的正相关性,SCC可作为隐性乳房炎诊断指标之一,所以奶样中MPO含量也可作为隐性乳房炎的诊断依据。
2.3 奶样中MPO与CMT的相关性

图3 MPO与CMT结果相关性分析图

表3 MPO与CMT结果相关性分析表
图3、表3结果表明:在不同MPO奶样中,随着MPO含量的增高,CMT检测结果也部分由阴性到强阳性,奶样中MPO与CMT相关系数r=0.546,二者显著相关,尤其在阳性(++)至强阳性(+++)区间内MPO与CMT极显著相关,部分由阴性到阳性范围内MPO与CMT相关性差,还有待进一步研究。
3 结论与讨论
奶牛隐性乳房炎因不表现临床症状,在生产中不易被发现。但隐性乳房炎会降低乳腺腺泡腔的容积,降低产奶量,从而影响终生产奶量[12,13]。隐性乳房炎如没有得到较好地处理,很容易转变为临床型乳房炎,使牛因乳房炎淘汰的几率增加[14,15],造成严重的经济损失。
MPO系统是牛乳中内源性抗菌系统之一,但还未得到应有重视。奶牛患乳房炎时趋动到炎症感染部位的PMN会释放吞噬颗粒酶MPO,可以通过检测奶牛乳腺炎时的MPO含量和活性对奶牛隐性乳房炎做出早期诊断。研究表明,用MPO-ELISA检测牛奶中的MPO是一个方便可行的诊断早期乳房炎的方法,MPO的水平是一个很好的指标。
本试验结果表明:隐性乳房炎发生时,奶样中MPO与SCC有一定正相关关系,相关系数r=0.257,呈显著正相关;奶样中MPO与CMT相关系数为r=0.546,二者显著相关。说明MPO在乳房炎奶汁中具有很高特异性,MPO含量的高低可作为隐性乳房炎的诊断依据。
在临床兽医学领域,针对目前我国奶牛隐性乳房炎的高发病率和诊断技术相对落后的现状,根据MPO在隐性乳房炎奶牛乳汁中具有高特异性和可检测性的特点[16],通过制备奶牛McAb,建立MPO-ELISA检测试剂盒和检测试纸条,直接检测奶样进行早期快速诊断方法是完全可行的,对此瑞典的Cooray R做过精确的评估,对141份奶样的体细胞数和ELISA检测MPO浓度得出的相关系数值为0.91。奶中MPO的ELISA结果显示具有很高的敏感性和特异性,敏感性的变异总和为10%,结果较为理想,因此可以根据牛乳中MPO水平建立奶牛隐性乳房炎的诊断指标。此外,将上述检测方法应用于其他哺乳动物的炎症性疾病检测中[17],相信也将同样会具有广阔的空间和发展前景。

