MicroRNA-136-5p靶向STAT3调控对脊髓损伤大鼠炎症因子的影响*
吴楠,王涛,马剑雄,吕工一,马信龙
(1.天津医院 脊柱外科,天津 300211;2.天津市中西医结合骨科研究所,天津 300050;3.天津医院 骨外科,天津 300211)
脊髓损伤是临床上一种较为常见的运动系统创伤,对患者的中枢神经产生损害,导致患者发生不同程度的肢体瘫痪或者丧失劳动能力。近年来脊髓损伤的发生率逐年提高[1]。脊髓损伤包括原发性和继发性损伤,其中原发性损伤为不可逆的损伤,继发性损伤是在原发性损伤发生后逐渐形成的损伤,伴随着自由基损伤、炎症反应、细胞凋亡等基因表达和细胞代谢的改变,继发性损伤对人体产生的危害甚至会大于原发性损伤[2]。有研究表明[3],脊髓损伤发生后体内基因的改变参与病理变化过程。microRNA(miRNA)属于生物体内较短的非编码单链小分子RNA,生物信息预测miRNA可至少对人类30%的蛋白质编码基因的表达进行调控,miRNA的发现为临床上多种疾病的治疗及机制研究提供了新的方向。研究显示[4]miRNA可通过调控信号转导和转录激活子3(STAT3)通路,参与多种疾病的调控,其中STAT3属于JAK-STAT信号通路中的核转录因子,当其被激活变为磷酸化STAT3(p-STAT3)后,一方面参与细胞的增殖、凋亡过程,另一方面可对免疫进行调节,在脊髓损伤疾病的发生、发展中有较重要的作用。目前对miR-136-5p靶向STAT3调控对脊髓损伤大鼠炎症因子的影响研究较少,本文就该课题进行研究,为临床上脊髓损伤的治疗提供新方向。
1 材料与方法
1.1 实验动物
选取60只SD健康大鼠,由济南朋悦实验动物繁育有限公司提供,月龄3~6个月,平均(4.2±0.5)个月,体重 200~250 g,平均(224.6±6.5)g。所有大鼠养殖于干净笼子里,室温(22.1±1.8)℃,相对湿度35%~40%,每天光照12 h,喂饮纯净水,饲养时间为1周。本实验获得天津医院医学伦理委员会批准。
1.2 主要试剂
miRNA-136-5p载体购自北京合生基因科技有限公司,大鼠脊髓神经元细胞购自武汉普诺赛生命科技有限公司,小鼠抗大鼠白细胞介素-6(Interleukin-6,IL-6)、白细胞介素-21(IL-21)、白细胞介素-23(IL-23)、白细胞介素-17(IL-17)抗体购自北京义翘神州科技有限公司,兔抗小鼠STAT3、p-STAT3抗体购自深圳欣博盛生物科技有限公司,兔抗大鼠肿瘤坏死因子 -α(tumor necrosis factor-α,TNF-α)抗体、HE 染色剂、磷酸盐缓冲液(phosphate buffered saline,PBS)购自武汉博士德生物工程有限公司。
1.3 方法
1.3.1 慢病毒载体构建 miR-136-5p 表达抑制的慢病毒载体构建及大鼠miR-136-5p的序列查找和设计由广州易锦公司完成。重组的LV-miR-136-5p和LV-sponge(抑制载体)慢病毒表达载体由广州易锦公司合成,并经测序验证。行慢病毒滴度检测,制备完成后重组慢病毒置入-80℃冰箱冷冻保存。
1.3.2 分组及模型复制 将60 只大鼠按照完全随机法分为对照组、脊髓损伤组、沉默组及过表达组,每组15只。脊髓损伤组、沉默组、过表达组大鼠复制脊髓损伤模型,对照组在模型复制期间不做任何处理。原发性脊髓损伤模型复制方法[5]:使用3%戊巴比妥钠注射于大鼠腹腔做麻醉处理,剂量为30 mg/kg,暴露出大鼠T12~L1节段硬脊膜,在离大鼠脊髓10 cm高度处以自由落体方式使用5 g冲击杆沿垂直冲击通道对大鼠T13节段以下脊髓进行打击,大鼠立刻出现尾巴、躯干痉挛性摆动及双下肢回缩样扑动,且大鼠苏醒后出现弛缓性瘫痪、排尿功能障碍。模型复制成功后,将10 μl miR-136-5p慢病毒悬液(病毒滴度为108TU/ml)在无菌环境下注射于沉默组、过表达组大鼠脊髓损伤区。对照组、脊髓损伤组大鼠注射等量的生理盐水。
1.3.3 运动功能、脊髓神经功能评价 使用 Beattie、Bresnahan、Basso(BBB)评分对4组大鼠运动功能进行评价,评定前排空大鼠膀胱,上午10:00由3位实验人员通过双盲法进行,取平均值。评价内容包括关节运动、运动协调、行走、躯干稳定性,满分21分,分数越高说明大鼠运动功能越正常,21分表示大鼠运动功能正常。使用联合行为评分法(combined behavioral score,CBS)对4组大鼠脊髓神经功能进行评价,评价内容包括大鼠运动功能分级、脚趾触地反应能力分级、端正体位反射、回缩反应能力分级、伸展能力分级、游泳实验、斜板实验等,满分为100分,分数越高说明大鼠脊髓神经功能障碍越严重,100分表示大鼠后肢功能完全丧失,0分表示大鼠脊髓神经功能正常。
1.3.4 组织切片及染色 4 组大鼠全身麻醉处理后,采用断头法处死,在无菌、低温条件下取大鼠损伤节段脊髓组织,对照组大鼠取与其他3组大鼠相对应节段的脊髓组织,大鼠肾组织在4%多聚甲醛中浸泡、固定,4℃环境下保存,使用二甲苯进行常规脱蜡处理2次,5 min/次,然后在梯度酒精下脱水处理3 min,自来水冲洗1次;使用苏木精染色5 min,自来水冲洗1次;使用浓度为1%的盐酸酒精分化处理30 s,在0.2%氨水中返蓝处理2 min,自来水冲洗1次;0.5%浓度伊红染色10 min,自来水冲洗1次;使用乙醇梯度脱水处理,常温下使用15% EDTA脱钙,脱水后进行石蜡包埋,制作3 μm厚的组织切片,最后用中性树胶进行封片,光学显微镜下观察大鼠脊髓的病理改变。
1.3.5 酶联免疫吸附试验检测 IL-6、IL-21、IL-23表达水平 大鼠模型复制前和复制2 h后取股静脉血2 ml,保存。将采集到的标本用50 mmol碳酸盐包被缓冲液进行抗原溶解,浓度为10~20 μg/ml,按100 μl/孔加入96孔酶标板中,4℃过夜保存。第2天舍弃包被液,磷酸盐吐温缓冲液(PBST)洗涤3次,每孔中加入1%的BSA 150 μl,在37℃环境中封闭1 h。PBST洗涤3次,每孔中加入100 μl不同倍比稀释度的血清,加入对照样品,37℃孵育2 h。采用PBST洗涤5次,加入100 μl稀释后的HRP标记的二抗,37℃孵育1 h。PBST洗涤5次,显色剂显色20 min后,在酶标仪上读取A405吸收值。
1.3.6 Western blotting检测脊髓组织 STAT3、p-STAT3蛋白相对表达量 将采集到的标本用PBS清洗3遍以上,分离PBS,加入IP细胞裂解液,裂解35 min,提取总蛋白,蛋白质定量(BCA法)检测蛋白浓度。取20 μg/孔蛋白质,通过10%的SDS-PAGE进行电泳,加入适量浓缩的SDS-PAGE蛋白缓冲液15 min;100 V,电泳10 min,结束之后,将电转膜浸泡在10%的牛奶中,37℃环境下的摇床上封闭1.5 h;与一抗结合,加入TBST稀释,按1∶1 000稀释一抗Tubuli(n内参照),4℃孵育过夜保存;第2天用TBST缓冲液清洗,与二抗结合在室温下孵育1 h,再次用TBST缓冲液反复清洗。最后加入显影剂将其浸在底物溶液中显色,严格按照显影定影试剂盒说明书进行操作。
1.3.7 实时荧光定量聚合酶连反应检测 IL-17 mRNA表达水平 在无菌环境下取大鼠脊髓组织,使用Trizol法提取组织RNA,总反应体系20 μl,42℃水浴60 min,70℃、5 min终止反应,逆转录合成第一链cDNA。取1 μl逆转录产物cDNA作为反应模板,总反应体系为20 μl,IL-7正向引物序列:5'-GTGTC TCTGATGCTGTTG-3';反向引物序列:5'-AACGGTTG AGGTAGTCTG-3',产物大小为452 bp。退火温度为57℃,95℃预变性 5 min,60℃退火 30 s,72℃延伸40 s,共35个循环,72℃继续延伸 10 min。取 6 μl PCR产物在琼脂糖凝胶上电泳,在凝胶成像系统下观察并采集图片,用Image J软件对图像进行灰度分析。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组比较采用单因素方差分析,进一步两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠运动功能、脊髓神经功能评分比较
4组大鼠BBB评分比较,差异有统计学意义(P<0.05),脊髓损伤组、沉默组、过表达组大鼠BBB评分低于对照组(P<0.05),沉默组大鼠BBB评分高于脊髓损伤组、过表达组(P<0.05);4组大鼠CBS评分比较,差异有统计学意义(P<0.05),脊髓损伤组、沉默组、过表达组大鼠CBS评分高于对照组(P<0.05);沉默组大鼠CBS评分低于脊髓损伤组、过表达组(P<0.05)。见表1。
2.2 4组大鼠脊髓的病理组织学变化
对照组大鼠无脊髓损伤,神经细胞形态正常,胶质细胞分布均匀;脊髓损伤组、沉默组、过表达组大鼠存在明显的脊髓损伤,损伤部位结构丧失,仅有少量的神经细胞数目,存在细胞浸润;过表达组大鼠脊髓损伤较沉默组大鼠严重,神经细胞形态异常,胶质细胞大量增生。见图1。
表1 4组大鼠运动功能、脊髓神经功能评分比较(n =15,±s)

表1 4组大鼠运动功能、脊髓神经功能评分比较(n =15,±s)
注:①与对照组比较,P <0.05;②与沉默组比较,P <0.05。
组别 BBB评分 CBS评分对照组21.00±0.00 0.00±0.00脊髓损伤组2.67±0.25①② 89.65±3.56①②沉默组3.26±0.38① 65.32±1.67①过表达组2.01±0.12①② 95.68±4.62①②F值 13.827 6.006 P值 0.001 0.001
2.3 4组大鼠脊髓组织IL-6、IL-21、IL-23表达水平比较
4组大鼠脊髓组织IL-6、IL-21、IL-23表达水平的比较,差异有统计学意义(P<0.05),脊髓损伤组、沉默组、过表达组大鼠脊髓组织中IL-6、IL-21、IL-23表达水平高于对照组(P<0.05),沉默组大鼠脊髓组织IL-6、IL-21、IL-23表达水平低于脊髓损伤组、过表达组(P<0.05)。见表2。
2.4 4组大鼠脊髓组织STAT3、p-STAT3蛋白相对表达量、IL-17 mRNA表达水平比较
4组大鼠脊髓组织STAT3、p-STAT3蛋白相对表达量、IL-17 mRNA表达水平比较,差异有统计学意义(P<0.05),沉默组大鼠脊髓组织STAT3、p-STAT3蛋白相对表达量、IL-17 mRNA表达水平均低于对照组、脊髓损伤组及过表达组(P<0.05)。见表3和图2。

图1 4组大鼠病理组织学切片图(HE×200)
表2 4组大鼠脊髓组织IL-6、IL-21、IL-23表达水平比较 (n =15,pg/ml,±s)
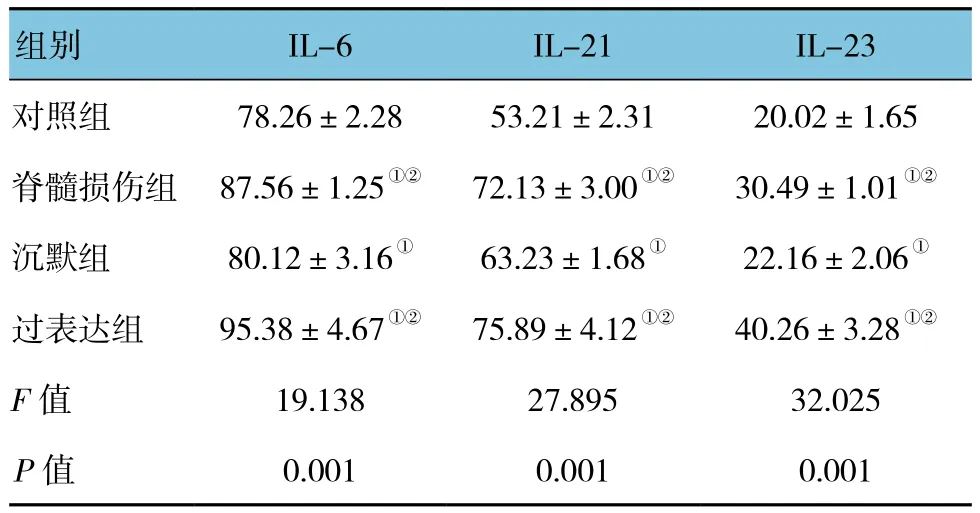
表2 4组大鼠脊髓组织IL-6、IL-21、IL-23表达水平比较 (n =15,pg/ml,±s)
注:①与对照组比较,P <0.05;②与沉默组比较,P <0.05。
组别 IL-6 IL-21 IL-23对照组78.26±2.28 53.21±2.31 20.02±1.65脊髓损伤组87.56±1.25①② 72.13±3.00①② 30.49±1.01①②沉默组80.12±3.16① 63.23±1.68① 22.16±2.06①过表达组95.38±4.67①② 75.89±4.12①② 40.26±3.28①②F值 19.138 27.895 32.025 P值 0.001 0.001 0.001
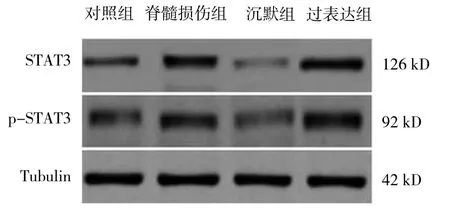
图2 4组大鼠脊髓组织中STAT3、p-STAT3蛋白表达水平
表3 4组大鼠脊髓组织STAT3、p-STAT3蛋白相对表达量、IL-17 mRNA 表达水平比较 (n =15,±s)

表3 4组大鼠脊髓组织STAT3、p-STAT3蛋白相对表达量、IL-17 mRNA 表达水平比较 (n =15,±s)
注 :†与沉默组比较,P <0.05。
组别 STAT3 p-STAT3 IL-17 mRNA对照组1.00±0.01† 1.00±0.05† 1.00±0.01†脊髓损伤组1.10±0.05† 1.21±0.07† 1.13±0.10†沉默组0.10±0.02 0.37±0.01 0.24±0.01过表达组1.23±0.16† 1.36±0.12† 1.35±0.12†F值 8.335 16.088 16.886 P值 0.001 0.001 0.001
3 讨论
脊髓损伤发生后机体会出现原发性脊髓组织坏死、细胞溶解、继发性损伤等,患者中枢神经系统受到损伤,损伤面以下的运动感觉功能、括约肌功能完全丧失或者不完全丧失[6]。患者神经元会大量坏死、发生局部免疫炎症反应及缺血性水肿,目前临床上常手术联合药物治疗此病,以减轻继发性损伤,但疗效均不理想,患者预后较差。
近年来随着对miRNA生物学功能机制的不断深入研究,在多种动植物、微生物中发现多达17 000个miRNA,和人类相关的miRNA包括1 000多种,为临床多种疾病诊断、治疗及预后提供新的方向[7-8]。有研究认为[9-11],当机体处于正常生理条件下,miRNA能够对正常免疫功能进行调节,当机体生理条件异常时,miRNA参与机体应激反应,miRNA表达出现异常,对紊乱的机体功能进行调节,通过一系列的作用,导致自身免疫性疾病的发生。有研究表明[12],miRNA可参与机体细胞增殖、凋亡、免疫反应、炎症反应等生理过程和疾病的发生过程。徐宏博等[13]认为miRNA与多种中枢神经系统类疾病相关,包括帕金森综合征、阿尔兹海默病等。miRNA是一类长19~25个核苷酸的非编码RNA,通过靶向靶基因3'-非编码区,进而对靶基因的表达进行抑制[14]。研究表明[15-16],miRNA可通过靶向调控STAT3通路,对细胞炎症反应、细胞增殖、凋亡进行调节。
STAT3属于STAT家族成员,是一种转录因子,能够调控基因的表达。STAT3位于染色体17q21区域,为DNA结合蛋白酶,能够对表皮细胞生长因子的刺激产生反应。当STAT3磷酸化后会导致STAT3二聚化、易位至细胞核中,与DNA结合,参与机体的炎症反应[17-18]。目前有研究报道[19],Th17细胞分化与IL-6、IL-21、IL-23相关,可在丝氨酸激酶或者YAK的诱导下转化为p-STAT3,之后形成二聚体并进入至细胞核,和IL-17的启动子相结合,对其进行调节、转录,最终促进Th17细胞的分化。有研究表明[20],STAT3的过度表达与Th17细胞的分化相关。本研究中,对4组大鼠脊髓组织IL-6、IL-21、IL-23表达水平及STAT3、p-STAT3蛋白相对表达量、IL-17 mRNA表达水平进行检测,结果显示,沉默组大鼠脊髓组织IL-6、IL-21、IL-23表达水平及STAT3、p-STAT3蛋白相对表达量、IL-17 mRNA表达水平均低于过表达组大鼠,该结果提示miR-136-5p可通过靶向STAT3,抑制STAT3磷酸化,作用于Th17细胞,对Th17细胞炎症因子水平进行调控,进而抑制炎症反应。
综上所述,脊髓损伤后miR-136-5p沉默可抑制STAT3的表达,进而抑制炎症因子的过度表达,最终抑制脊髓炎症反应。
目前关于对miR-136-5p靶向调控STAT3的研究尚未有报道,本文研究了miR-136-5p靶向STAT3调控对脊髓损伤大鼠炎症因子的影响,为临床上脊髓损伤的研究提供了新的方向。

