急性ST段抬高型心肌梗死患者行急诊经皮冠状动脉介入治疗术后发生院内死亡的危险因素分析
刘肖 李树仁 高楠 郑瑜 张一峰 党懿 刘惠良 孟存良 张飞飞 郝潇
我国冠心病的发病率逐年增高。ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)是冠心病中较为危重的一种类型。直接经皮冠状动脉介入治疗(primary percutaneous coronary intervention,PPCI)是STEMI的首选治疗方法[1]。然而,对于那些具有高危特征的患者,如高龄、心原性休克等,院内短期预后一般较差。2016年全国冠心病行介入治疗的总患者数为666 495例,其中PPCI共55 833例,总的介入治疗死亡率为0.21%[2]。虽然目前经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)术已日趋成熟,但仍有部分STEMI患者即使行PPCI后,院内死亡率仍较高。哪些患者属于高危人群,哪些因素决定了患者的高死亡风险,如何早期识别高危患者,这给临床医师提出了挑战。本研究旨在在连续接受PPCI的STEMI患者中筛选出与发生院内死亡相关的危险因素。
1 对象与方法
1.1 研究对象
2016年9月至2018年6月在河北省人民医院心脏中心行PPCI的STEMI患者共428例,排除36例,其中单造影4例、球囊扩张5例、溶栓治疗7例、临床资料不完整16例、术中死亡4例。最终392例STEMI患者纳入本研究,其中男性318例(79.7%),女性74例(20.3%),平均年龄(60.95±12.75)岁。根据是否发生术后死亡分为存活组与死亡组,发生院内死亡27例,死亡率为6.9%。入选标准:(1)符合《急性ST段抬高型心肌梗死诊断和治疗指南》[3]的诊断标准;(2)从发病到入院12 h内行PPCI,至少置入1枚支架。排除标准:(1)急诊单冠状动脉造影或球囊扩张;(2)已在院外行溶栓治疗;(3)临床资料不完整;(4)术中死亡。
1.2 研究方法
1.2.1 资料收集 收集患者在院期间的基本资料,包括性别、年龄、体重指数(body mass index,BMI)、血压、Killip心功能分级、吸烟、饮酒、既往史、院前用药情况、血液化验、左心室射血分数(left ventricular ejection fraction,LVEF)等,发生院内死亡的记录死亡原因。收集患者手术资料,包括SYNTAX评分、发病至球囊扩张时间(time from symptom onset to balloon,TSOB)、罪犯血管情况、病变部位、血栓负荷、术中是否血栓抽吸、是否应用主动脉内球囊反搏(intraaortic balloon pumping,IABP)装置、术中并发症、术中用药、置入支架数量、术后心肌梗死溶栓治疗试验(thrombolysis in myocardial infarction,TIMI)血流分级、术后用药、术后并发症等情况。
1.2.2 相关定义 泵衰竭:心力衰竭(Killip心功能分级≥Ⅲ级且LVEF≤40%)、心原性休克;致命性心律失常:室性心动过速(室速)、心室颤动(室颤)、高度房室传导阻滞及不明原因的心搏骤停等;机械并发症:心脏破裂、乳头肌断裂及室间隔穿孔等;非心脏原因:消化道出血、卒中及呼吸衰竭等。
1.2.3 PPCI术 PPCI术由经验丰富具有介入手术资质的医师完成,根据《急性ST段抬高型心肌梗死诊断和治疗指南》[3]推荐,术前双联抗血小板治疗负荷剂量:顿服阿司匹林300 mg+氯吡格雷300 mg或替格瑞洛180 mg;术前抗凝:静脉注射普通肝素3000 U。术中抗凝:根据患者体重以70~100 U/kg补充肝素,或根据患者综合情况若联合应用血小板糖蛋白Ⅱb/Ⅲa受体拮抗药,维持活化凝血时间(activated coagulation time,ACT)在250~300 s。术后双联抗血小板治疗:阿司匹林(100 mg、每日1次)+氯吡格雷(75 mg、每日1次)或替格瑞洛(90 mg、每日2次)维持。术后均转入冠心病重症监护病房,且根据《经皮冠状动脉介入治疗围术期非口服抗凝药物临床应用中国专家共识》[4]进行二级预防治疗。
1.3 统计学分析
所有数据应用SPSS 21.0软件进行处理。计量资料均行正态性检验:正态分布数据用均数±标准差表示,非正态数据用中位数(四分位数间距)表示。若计量资料符合正态性,则组间比较应用t检验;若计量资料不符合正态性,则组间比较应用Wilcoxon秩和检验。计数资料用百分位数表示,组间比较用卡方检验、校正卡方检验或Fisher精确概率法检验。对两组中有统计学差异的一般资料进行logistic单因素回归分析,筛选出P<0.20的因素,再进行logistic多因素回归分析,筛选出与发生院内死亡相关的危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较(表1)
两组患者心率、高血压病、卒中史、PCI史、心肌梗死史、心绞痛史、入院前血管紧张素转换酶抑制药/血管紧张素Ⅱ受体拮抗药(angiotensin converting eniyme inhibitors/angiotensinⅡreceptor antagonists,ACEI/ARB)使用、入院前β阻滞药使用,双联抗血小板治疗负荷剂量等比较,差异均无统计学意义(均P>0.05)。死亡组患者女性占比更多、年龄更大,且Killip心功能分级≥Ⅲ级、糖尿病、心房颤动(房颤)、他汀类用药比例,白细胞计数、中性粒细胞计数、血小板分布体积宽度、K+浓度、肌酐、尿酸、肌酸激酶同工酶(creatine kinase-MB,CK-MB)峰值均明显高于存活组,差异均有统计学意义(均P<0.05)。死亡组BMI、收缩压、舒张压、LVEF值均较低,且Ca2+浓度、估算的肾小球滤过率,术后用阿司匹林+替格瑞洛、ACEI/ARB、β阻滞药、他汀类、螺内酯的比例均低于存活组,差异均有统计学意义(均P<0.05)。
2.2 两组患者手术相关资料比较(表2)
两组患者TSOB、病变血管内径、病变长度、侧支循环、同时处理非罪犯血管、高血栓负荷、血栓抽吸、置入多枚支架、罪犯血管等比较,差异均无统计学意义(均P>0.05)。死亡组的SYNTAX评分、完全闭塞比例、多支病变(≥2支)比例、术后TIMI血流分级≤Ⅱ级比例、术中应用比伐芦定、应用IABP,术中并发症(慢血流、心搏骤停、急性心脏压塞),术后并发症(心原性休克、心搏骤停、房颤、室颤、室速、室间隔穿孔、高度房室传导阻滞、消化道出血)均明显高于存活组,差异均有统计学意义(均P<0.05)。死亡组患者术中应用肝素比例小于存活组,差异有统计学意义(P<0.05)。
2.3 logistic单因素回归分析
logistic单因素回归分析显示,性别(女)、年龄≥65岁、收缩压>140 mmHg(1 mmHg=0.133 kPa)、Killip心功能分级≥Ⅲ级、糖尿病、既往房颤史、院前应用他汀类药物、完全闭塞、多支病变、术后TIMI血流分级≤Ⅱ级、术中心搏骤停、术中IABP、术后发生心搏骤停、术后室颤、术后房颤、术后室速、术后高度房室传导阻滞、术后消化道出血、白细胞计数、中性粒细胞计数、K+≥4.1 mmol/L、Ca2+(<2.11 mmol/L或≥2.52 mmol/L)、肌酐>132 μmol/L、尿酸>250 μmol/L、CK-MB峰值>25 U/L、LVEF≤40%是与死亡相关的危险因素,而K+≥4.1 mmol/L、 术后使用ACEI/ARB、β阻滞药、他汀类、螺内酯药物是与患者生存的保护因素(均P<0.05,表3)。
2.4 logistic多因素回归分析
将logistic单因素回归分析结果中有统计学意义的指标行logistic多因素回归分析显示,年龄≥65岁(OR 3.552,95%CI 1.086~11.62,P=0.036)、LVEF≤40%(OR 6.754,95%CI 1.982~23.02,P=0.002)、CK-MB峰值>25 U/L(OR 4.243,95%CI 1.219~14.77,P=0.023)、TSOB≥195 min(OR 3.490,95%CI 1.079~11.29,P=0.037)、术后TIMI血流分级≤Ⅱ级(OR 8.425,95%CI 2.899~24.49,P<0.001)为STEMI患者行急诊PPCI术后发生院内死亡的独立预测因素(表4)。
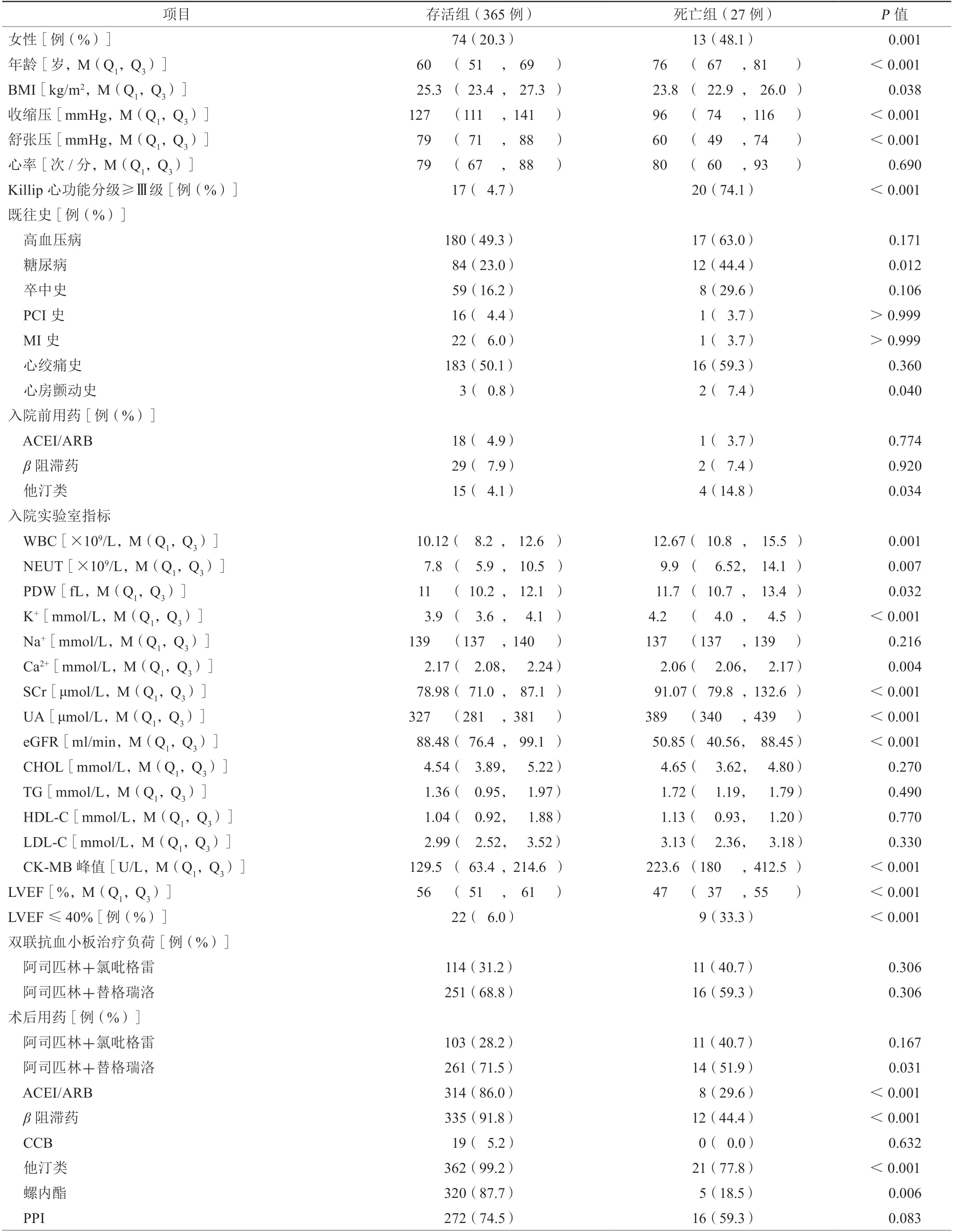
表1 两组患者基本临床资料分析
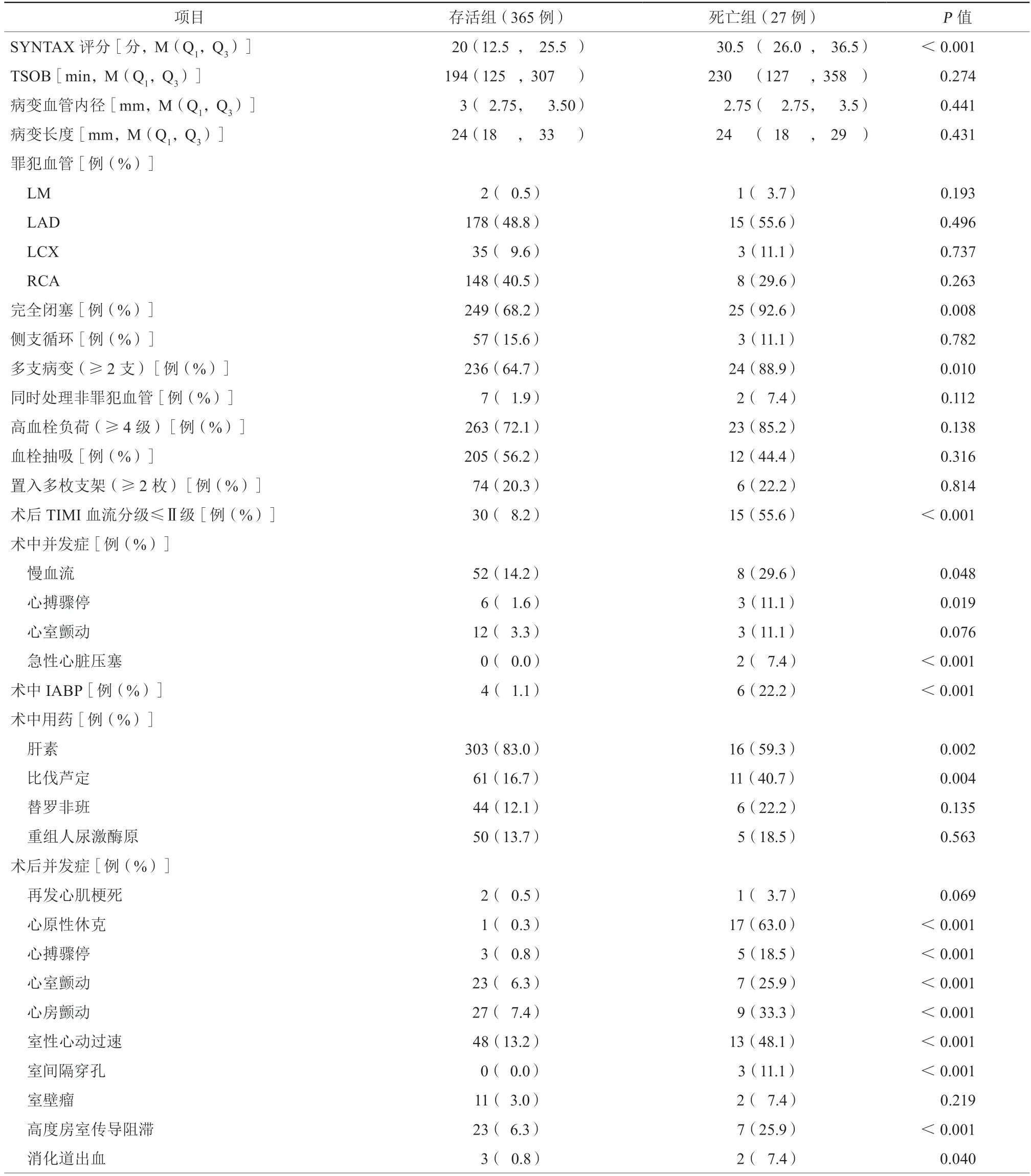
表2 两组患者手术相关资料分析
3 讨论
虽然STEMI死亡率最近有所下降,但来自国内外一些注册登记的数据表明,死亡风险仍然很大,特别是在STEMI的早期阶段,早期PPCI术愈发显得重要[5-8]。本文就PPCI术后发生院内死亡的患者进行分析,结果显示年龄≥65岁、LVEF≤40%、CK-MB峰值>25 U/L、TSOB≥195 min、术后TIMI血流分级≤Ⅱ级为STEMI患者行急诊PPCI术后发生院内死亡的危险因素。
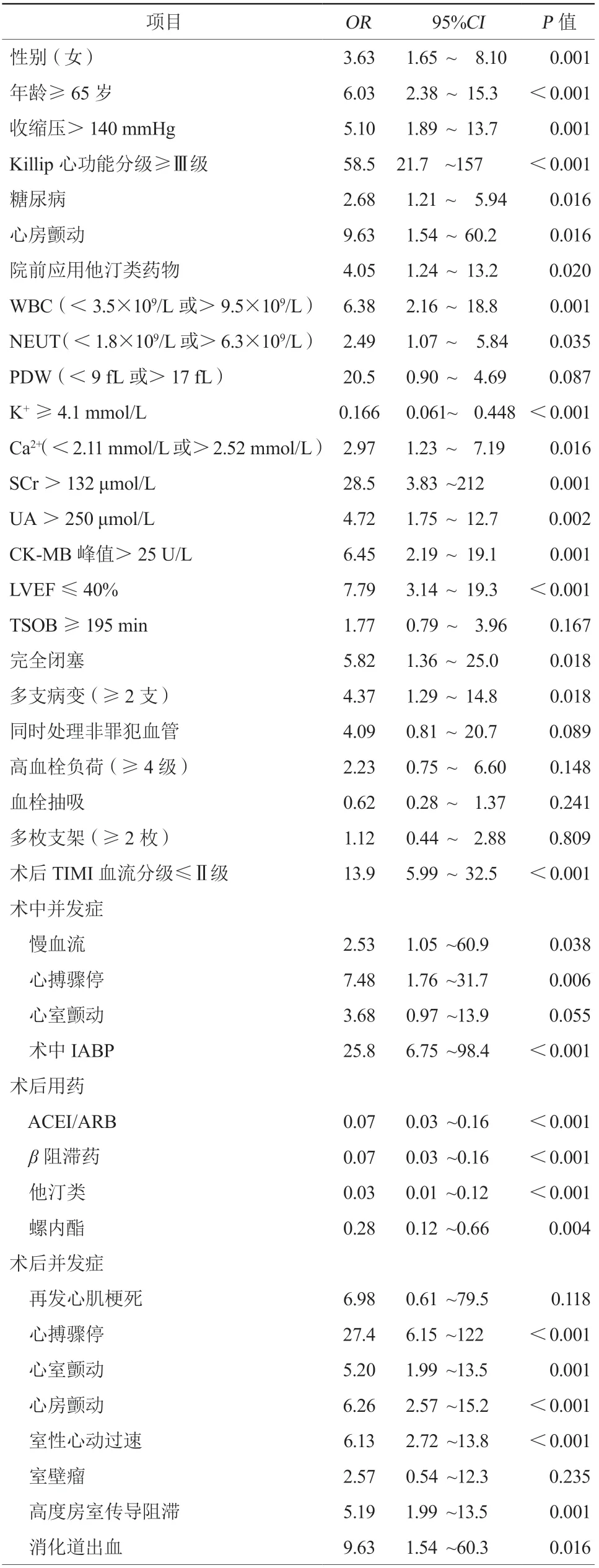
表3 发生院内死亡的logistic 单因素回归分析
老年人有较高的心血管危险因素,较年轻人更容易患冠心病[9-10]。有研究表明,年龄较大的STEMI患者无论治疗与否,都有较高的死亡、出血和并发症风险[11]。老年人在接受双重抗血小板或三重抗凝治疗时也有更高的胃肠道出血风险[12]。老年人的肾功能也较差,在PPCI中使用对比剂可能会增加肾功能衰竭和对比剂肾病的风险[13-14]。此外,PCI相关并发症,如无复流、慢血流,对老年人的打击可能比对年轻患者的打击更大[15]。本研究中死亡组的中位年龄为76岁,存活组为60岁,更进一步说明死亡与高龄有关。
一项队列研究显示,13.6% STEMI患者在住院期间被诊断为心力衰竭(heart failure,HF)[16]。本研究中定义Killip心功能分级≥Ⅲ级且LVEF≤40%为HF,发生率为7.9%。STEMI后发生HF是预后不良的危险因素之一[17]。不可逆的心肌细胞损伤或微血管功能障碍和左心室结构的改变,即使在成功的PPCI中,也可能影响左心室功能的恢复,并导致梗死后左心室重构。左心室重构的发生本身就会带来更高的HF和致命性心律失常的风险,从而导致更坏的预后[18-19]。但随着PPCI的广泛应用,STEMI合并左心室功能受损患者的总体心原性死亡率在下降[20]。而Stolfo等[21]研究发现,大部分STEMI和左心室功能不全患者中,在出院前重新评估时已发现左心室收缩功能有明显改善。本研究组将进一步随访在门诊进行规律复查的患者,从而观察患者行PPCI术后对心功能的影响。
心肌标志物CK-MB和肌钙蛋白与梗死面积密切相关,与左心室收缩功能相关性较小。在Hartman等[22]研究中,CK-MB峰值水平被认为是判断梗死面积大小的最佳预测指标,可作为行PPCI STEMI患者3~6个月发生主要不良心血管事件的独立预测因子[23]。本研究的CK-MB峰值取自患者入院及第2~3天的心肌酶谱测定。当STEMI患者血运重建后心肌中的CK-MB被血流冲刷出来,引起血液中CK-MB浓度升高,峰值时间提前。因此可通过CK-MB定量检测结果来判断心肌再灌注以及观察治疗效果等。
快速而有效的再灌注措施可以降低STEMI患者死亡率和致残率。PPCI实施每延迟30 min,死亡率增加7.5%~10.0%[24]。缺血再灌注的关键是缩短心肌总缺血时间,心肌血供恢复越及时,患者预后越好。本院于2017年4月正式通过中国胸痛中心认证,使得门-球时间较前明显降低[25]。随着门-球时间的降低,使得到达可以行PPCI医院之前的时间显得更加重要。不同院前诊断及区域协同救治主要影响STEMI患者从发病至进入导管室的过程,进而影响心肌总缺血时间[26]。因此,增加患者对症状的认识,减少从症状发作到治疗的时间间隔,以及缩短医疗单位之间的转移时间是降低TSOB的关键[27]。Doost Hosseiny等[5]对澳大利亚地区心肌梗死患者资料进行分析表明,TSOB>240 min的患者1年内主要不良心血管事件发生率明显上升。影响STEMI患者TSOB延长的因素包括患者高龄、教育程度、经济及交通状况、首诊医院无PCI条件、医院绿色通道条件等诸多指标。公众缺乏急性胸痛相关知识和院前急救医疗服务体系不完善也是主要原因[28]。因此,向公众普及胸痛急救相关知识以及基层胸痛中心的建立迫在眉睫。
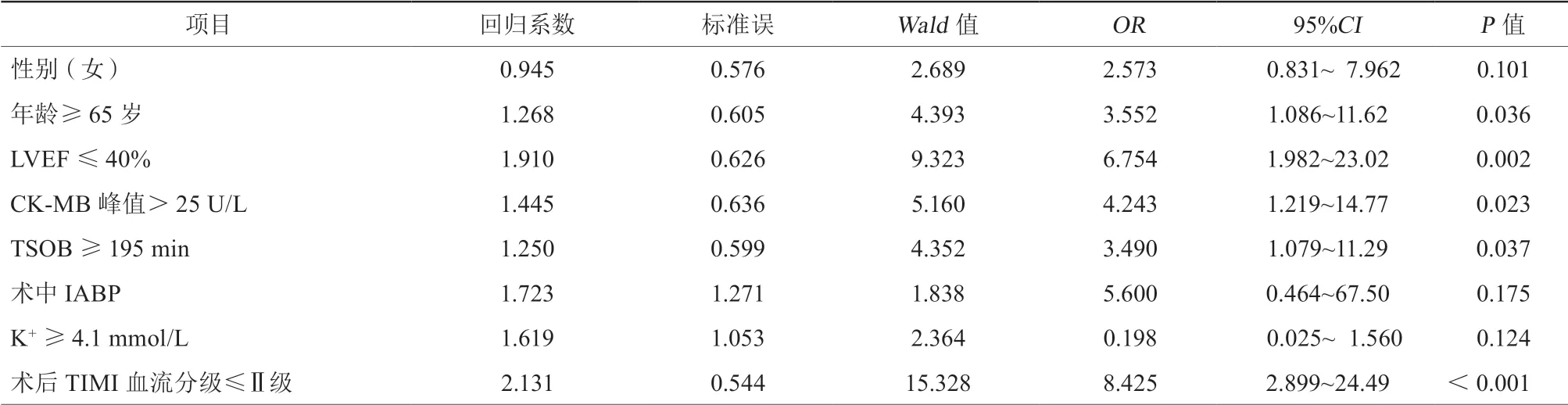
表4 发生院内死亡的logistic 多因素回归分析
本研究中术后TIMI血流分级≤Ⅱ级定义为慢血流/无复流。慢血流/无复流的发生阻碍了有效的心肌再灌注,成为主要不良心血管事件的独立预测因子[29]。有研究表明,慢血流/无复流现象是一个复杂且多因素相关的病理生理过程,其确切机制尚不清楚,但目前认为这一现象与微循环、再灌注损伤和微血栓形成有关[30-31]。据报道,缺血时间延长会导致远端毛细血管床水肿和肿胀,损伤心肌细胞,改变毛细血管的完整性,从而破坏微血管床,这一切都有利于慢血流/无复流现象的发生[32]。本研究中死亡组慢血流/无复流的发生比例为55.6%,再次说明慢血流/无复流的发生与STEMI患者近期及远期预后相关。多项研究显示,术中应用硝普钠、血小板糖蛋白Ⅱb/Ⅲa受体拮抗药、重组人尿激酶原可以改善术后慢血流的发生[33-37]。
本研究通过对392例经PPCI术的STEMI患者的临床资料及手术资料进行分析发现高龄、心功能差、CK-MB峰值升高、TSOB、PPCI后慢血流是STEMI患者住院期间死亡的高危因素,对STEMI患者住院期间发生死亡具有较好的预测价值。本研究为单中心研究,收集的样本量较小,总体数据的基数较小,阳性例数较少,对结果会产生一些统计偏倚,从而影响结果的准确性。目前我们已经联合河北省多家三甲医院进行大样本数据分析,未来本中心会统计大量数据来建立一种预测发生院内死亡的模型,进一步指导临床工作。

