14-3-3η 表达水平对依那西普治疗的类风湿关节炎患者临床应答的预测价值
王希佳,程佳芬
上海市第十人民医院1 临床药学科;2 肾脏风湿科,上海 200072
类风湿关节炎(rheumatoid arthritis,RA)是以侵蚀性关节炎为主要临床表现的慢性自身免疫疾病;高发于30~50 岁女性,全球发病率为0.5%~1%[1]。目前在常用的抗风湿类药物中,TNF 抑制剂由于较好的疗效和安全性受到广泛关注,其中,依那西普是中国治疗RA 最常用的TNF 抑制剂[2]。尽管依那西普的单用或联用在大多数RA 患者中效果显著,但仍有部分患者对于依那西普缺乏应答[3]。另外,依那西普的药物成本较高,患者的经济负担较大。因此,亟待探索影响依那西普治疗RA 疗效的因素,以期提高疗效并进行个体化治疗,从而减轻患者负担。
14-3-3 蛋白是由不同基因编码的、以稳定的同源/异源二聚体形式结合的、高度保守的酸性蛋白家族,通过控制蛋白在不同信号通路中的活性来调控各种生理和病理过程,包括自身免疫性疾病,如RA、多发性硬化症等[4,5]。作为7 种不同的亚型的一种,14-3-3η 蛋白可以增加促炎信号传导以及炎性介质,并与RA 患病风险密切相关;然而,其与依那西普治疗RA 患者的临床疗效的关联尚不明确[6]。因此,本研究旨在评估14-3-3η 表达水平与RA 患病风险、疾病活动度的关联,并且探索其在依那西普治疗RA 患者临床应答中的预测作用。
1 资料与方法
1.1 研究对象
研究纳入2014 年7 月至2017 年6 月在本院接受依那西普治疗的88 例活动性RA 患者。
纳入标准:①符合美国类风湿病协会1987 年修订的RA 分类标准;②年龄满18 周岁;③中重度疾病活动度,定义为基于红细胞沉降率的28 关节疾病活动度评分 〔28-joint disease activity score based on erythrocyte sedimentation rate,DAS28(ESR)〕≥3.2;④自愿接受依那西普联合甲氨蝶呤(MTX)或来氟米特(LEF)治疗24 周;⑤经研究者评估可定期随访。
排除标准:①有依那西普禁忌症者;②曾经或正患有除RA 以外的炎症性关节炎,如痛风、反应性关节炎、银屑病关节炎、血清阴性脊柱关节病等;③合并除RA 以外的其他自身免疫性疾病,如系统性红斑狼疮、混合性结缔组织病、硬皮病、结核病、多肌炎等;④伴有活动性或复发性的细菌、病毒、真菌、分支杆菌感染病史的患者;⑤伴有恶性疾病,如血液系统疾病或恶性肿瘤等;⑥孕妇或哺乳期妇女。
入组RA 患者平均年龄为57.7±11.3 岁,男性16 例(18.2%)、女性72 例(81.8%);平均身体质量指数(BMI)为22.1±3.4 kg·m-2;中位病程为3.3 年(四分位值:1.5~6.9 年);类风湿因子(RF)阳性者59 例(67.0%),抗环瓜氨酸肽抗体(ACCP)阳性者60 例(68.2%);有生物制剂治疗史者14 例(15.9%);压痛关节数(TJC)为7.3±3.4,肿胀关节数(SJC)为6.7±3.5;红细胞沉降率(ESR)为(46.3±26.4)mm·h-1;C反应蛋白(CRP)为(45.3±37.4)mg·L-1;DAS28(ESR)评分为5.3±0.7;健康评估问卷残疾指数评分(HAQDI)为1.8±0.3。
此外,研究同期纳入80 例在医院进行健康体检的志愿者作为对照。本研究经本院伦理委员会审核批准,所有受试者均签署知情同意书。
1.2 样本采集
治疗前采集所有RA 患者的全血样本。采血后轻轻倒转采血管,混合4~5 次,直立置于室温、待血液完全凝固(约1 h),1600 g 离心10 min,分离血清。将分离好的血清转移至单独的冻存管中,按照每管400~500 μL 分装好,置于-80 ℃保存待测。
健康对照者的全血样本采集、处理同RA 患者。
1.3 血清中14-3-3η 蛋白检测
采用定制的14-3-3η 蛋白ELISA 试剂盒(上海酶联生物科技有限公司)检测受试者血清中14-3-3η蛋白水平,所有操作过程均按照试剂盒说明书进行。
1.4 治疗
RA 患者依据病情及意愿,选择接受依那西普联合MTX 或依那西普联合LEF。45 例选择依那西普联合MTX,用药方案如下:依那西普25 mg/次,每周2 次,肌肉皮下注射;MTX 7.5~20 mg/周,口服,持续24 周。43 例选择依那西普联合LEF,用药方案如下:依那西普25 mg/次,每周2 次,肌肉皮下注射;LEF 20 mg/天,口服,持续24 周。
1.5 治疗应答评估
分别于治疗前和治疗24 周后评估所有RA 患者DAS28(ESR)评分。参考欧洲抗风湿病联盟(EULAR)标准,临床应答定义为相比治疗前,治疗后DAS28(ESR)评分下降≥1.2 分。
1.6 统计分析
采用SPSS 24.0(IBM,美国)进行数据统计分析,并用GraphPad prism V7.01 进行绘图。变量以均值±标准差(±s)、中位值(25th~75th 分位值)或频次(%)的形式描述。组间比较采用Wilcoxon 秩和检验。连续变量间的关联采用Spearman 相关性分析。血清14-3-3η 水平对于RA 患者的诊断作用以及对于临床应答和不应答患者的区分作用采用受试者工作特征曲线(ROC)、曲线下面积(AUC)以及AUC 95%置信区间(CI)进行评估。临床应答的预测因素采用单元和多元逻辑回归模型(向前选择法)进行分析,并计算优势比(OR)和95%CI。所有检验均为双侧检验。P<0.05 为具有统计学意义。
2 结果
2.1 14-3-3η 在RA 患者和健康对照者中表达水平
14-3-3η 在RA 患者中表达量为1.41(0.09~7.24)ng·mL-1,显著高于其在健康对照者中表达量〔0.04(0.02~0.08)ng·mL-1〕(P<0.001)。见图1-A。14-3-3η 区分RA 患者与健康对照者的ROC 曲线下面积AUC 为0.868(95%CI:0.815~0.921),表明血清14-3-3η 水平对于分辨RA 患者与健康对照者有很好的区分作用。见图1-B。
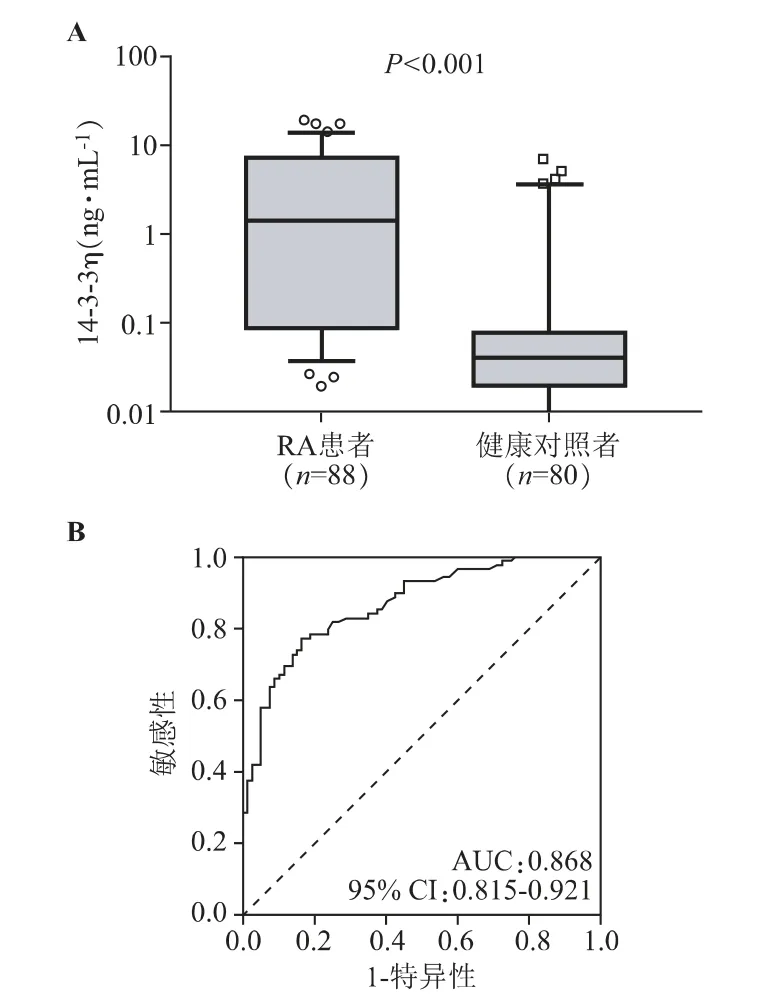
图1 RA 患者和健康对照者中14-3-3η 表达差异以及ROC 曲线
2.2 14-3-3η 表达量与临床特征的关联分析
14-3-3η 与呈连续变量的临床特征关联分析显示:14-3-3η 表达量与RA 患者病程(P=0.028)、SJC(P=0.003)、CRP(P<0.001)水平以及DAS28(ESR)评分(P=0.012)呈正相关,见表1;而与患者年龄(P=0.529)、BMI(P=0.829)、TJC(P=0.730)、ESR(P=0.056)、HAQ-DI 评分(P=0.172)无关联。
此外,14-3-3η 与呈分类变量的临床特征关联分析显示:14-3-3η 表达量(中位值)与ACCP 阳性正相关(P=0.025);而与RA 患者性别(P=0.762)、RF状态(P=0.065)、生物制剂治疗史(P=0.083)无关联。见表2。
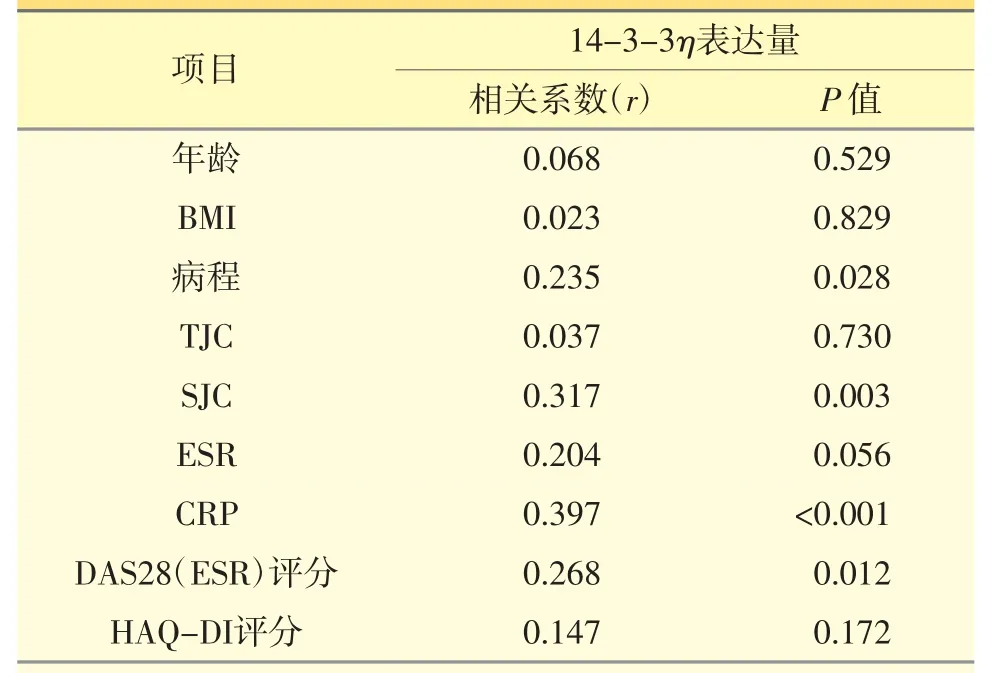
表1 14-3-3η表达量与临床特征(连续变量)关联
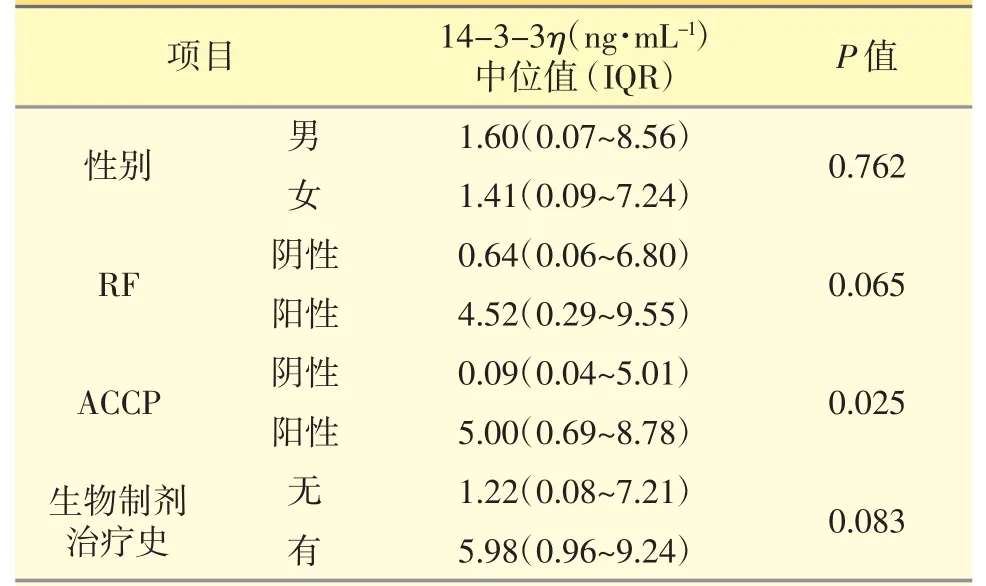
表2 14-3-3η 表达量与临床特征(分类变量)关联
2.3 14-3-3η 与临床应答的关联分析
在接受依那西普治疗的RA 患者中,58 例达到临床应答,30 例未达到临床应答。临床应答患者基线期14-3-3η 表达量为4.59(0.14~8.94)ng·mL-1,高于临床无应答患者基线期14-3-3η 表达量〔0.70(0.05~3.12)ng·mL-1〕(P=0.011)。见图2-A。表明14-3-3η 高水平与依那西普治疗RA 患者高临床应答相关。
进一步ROC 曲线分析发现,14-3-3η 区分临床应答患者与无应答患者的AUC 为0.665(95%CI:0.547~0.784),表明14-3-3η 可以在一定程度上预测依那西普治疗RA 患者的临床应答。见图2-B。
2.4 临床应答预测因素的单元与多元逻辑回归分析

图2 临床应答和无应答患者血清中14-3-3η 表达水平差异以及ROC 曲线
针对临床应答预测因素的单元逻辑回归结果显示,14-3-3η 表达量〔P=0.021,OR=1.141(1.020~1.277)〕、ACCP 阳性 〔P=0.006,OR=6.187(1.670~22.919)〕和CRP 水平〔P=0.044,OR=1.015(1.000~1.030)〕可预测更高的临床应答。见表3。
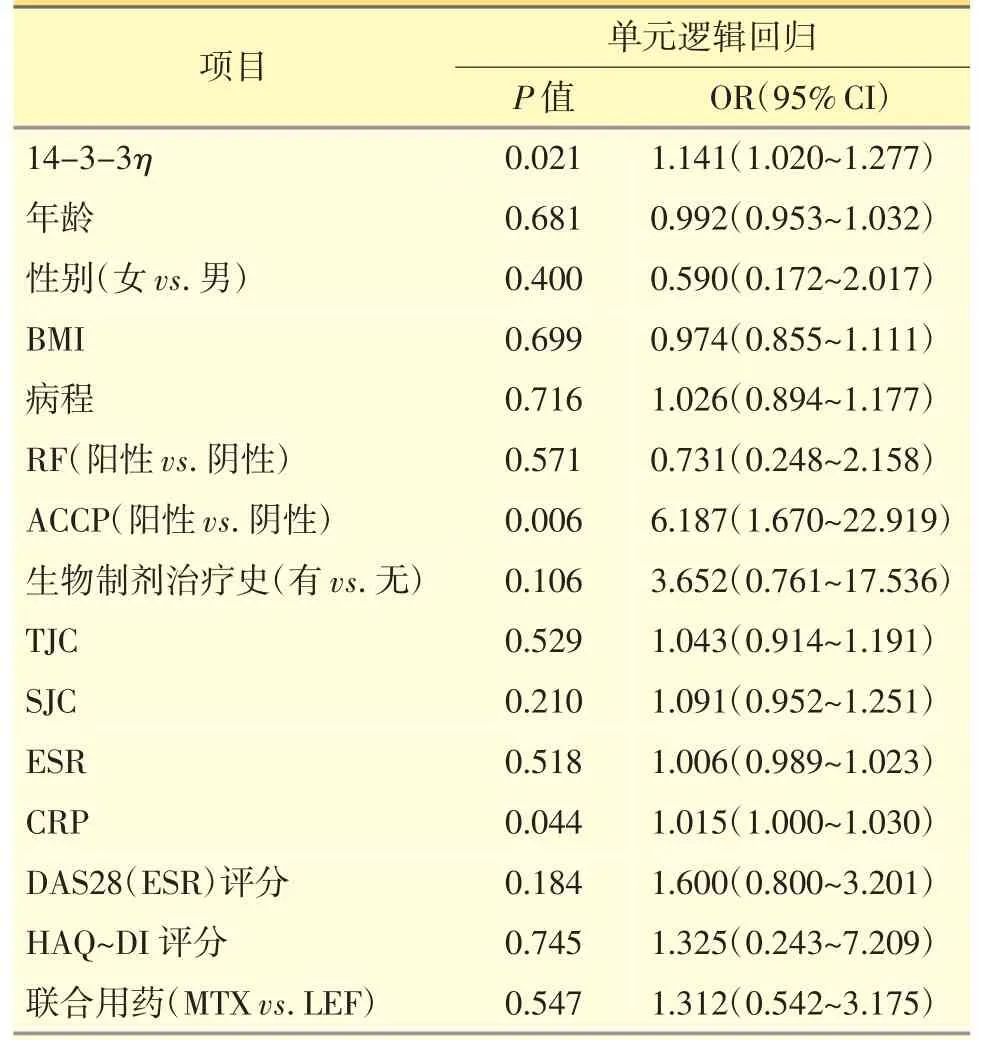
表3 临床应答的预测因素-单元逻辑回归
多元逻辑回归结果显示,CRP 〔P=0.047,OR=1.128(1.110~1.145)〕和ACCP 阳性〔P=0.022,OR=5.185(1.275~21.090)〕可以独立预测更高的临床应答;而14-3-3η 表达量并不是临床应答的独立预测因素。见表4。
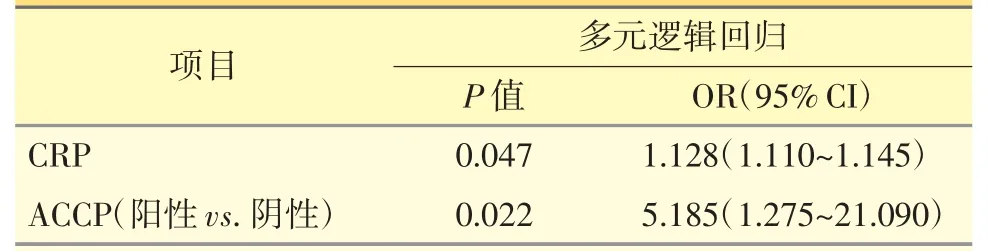
表4 临床应答的预测因素-多元逻辑回归
3 讨论
本研究发现:(1)14-3-3η 在RA 患者血清中高表达,进一步ROC 曲线分析显示,14-3-3η 可以预测RA 高患病风险,且其与RA 患者疾病活动度正相关。(2)14-3-3η 在临床应答患者中高表达,且ROC 曲线分析表明14-3-3η 可以预测依那西普治疗RA 患者更高的临床应答。
14-3-3η 是一种在真核生物中广泛表达的高度保守的酸性蛋白,能够参与信号传导等多种生理学进程[7,8]。在RA 研究中,RA 患者血清14-3-3η 表达量较健康对照者更高,且14-3-3η 高表达的RA 患者疾病活动度普遍较14-3-3η 低表达患者更高[9]。
另一项研究表明,14-3-3η 浓度在RA 患者血清中明显升高,提高了炎症因子如白介素-1 与白介素-6 的水平,并与类风湿因子、ACCP 水平呈正相关[10]。还有研究发现,14-3-3η 在炎性关节疾病患者滑膜液和血清中高表达,且其表达量与已知的RA标记物基质金属蛋白酶(matrix metalloproteinase,MMP)MMP-1、MMP-3 正相关[4]。以上研究表明,14-3-3η 在RA 患者中高表达,且与RA 患病风险、炎症水平、疾病活动度正相关;但这些研究均基于欧洲与北美的RA 患者,而在中国RA 患者中14-3-3η 与RA 患病风险、疾病活动度的关联少有研究。
本研究发现,在中国RA 患者中,14-3-3η 高表达可以预测RA 高患病风险,且与RA 病程、SJC、CRP 水平、ACCP 阳性以及DAS28(ESR)评分正相关。可能的原因是:(1)14-3-3η 能够推进促炎信号的传导,如MAPK 信号通路,以及炎性介质的释放,如白介素-1、白介素-6 等,使炎症反应增强,从而加重了患者疾病活动度。(2)14-3-3η 可能通过抑制软骨分化,增加软骨侵蚀来促进RA 患者骨损伤,从而增加了受累的关节数[11]。(3)由于14-3-3η 水平与RA骨侵蚀程度呈正相关,而RA 病程与骨侵蚀程度也呈正相关,因此14-3-3η 水平与RA 病程呈正相关[11]。
有少数研究发现,14-3-3η 不仅在RA 患者中差异表达,还可以预测患者对治疗的应答。在接受传统DMARD 治疗的RA 患者中,14-3-3η 基线期表达量与患者治疗一年后临床缓解率〔DAS28(ESR)≤2.6 分〕呈负相关[12]。同样,在接受托珠单抗(tocilizumab)治疗的RA 患者中,治疗前14-3-3η表达量越低,患者治疗12 周后临床缓解率〔DAS28(ESR)≤2.6 分〕更高[13]。
本研究发现,在接受依那西普治疗的RA 患者中,基线14-3-3η 水平在应答患者中较无应答患者中更高。这可能归因于:
(1)本研究与之前研究的终点不同。在既往研究中,研究终点为临床缓解,即DAS28(ESR)≤2.6分。已知14-3-3η 表达量与RA 疾病活动度正相关,由此得出:基线期14-3-3η 表达量越低,患者疾病活动度更低,DAS28(ESR)评分也更低。因此,患者在治疗后更易达到DAS28(ESR)≤2.6 分。而本研究中,临床应答定义为相比治疗前,治疗后DAS28(ESR)评分下降≥1.2 分。基线14-3-3η 水平越高的患者疾病活动度越高〔DAS28(ESR)评分越高〕,接受治疗后DAS28(ESR)评分下降可能越大,故而基线14-3-3η 水平越高的患者对于治疗的应答更高。
(2)14-3-3η 与患者炎症水平正相关,而TNF抑制剂具有抗炎作用,因此,基线期14-3-3η 水平越高的RA 患者对于TNF 抑制剂抗炎作用的反应可能更高,炎症水平下降幅度更大,DAS28(ESR)评分降低值更多。
此外还发现,14-3-3η 可以预测,但不能独立预测更高的临床应答,这可能由于14-3-3η 能够通过影响其它独立影响因素,如CRP、ACCP 等,从而间接地影响RA 患者对于依那西普治疗的应答。
本研究初步揭示了14-3-3η 与RA 患者对于依那西普治疗应答的关联,但仍存在一些缺陷:(1)虽然本研究的样本量对比于大多数其它研究而言较大,但是深入的研究仍需要扩大样本量来提高统计效能。(2)14-3-3η 在RA 中的分子机制并没有纳入研究。(3)已知14-3-3η 具有一定的炎症区域特异性,关节滑膜液测定14-3-3η 可能与血清中得出的结果有异,因此,本研究的结果需要在不同的样本中作进一步验证[7]。(4)2009/2010 年,ACR/EULAR 已经提出了RA 的新的分类标准,然而本研究使用的仍为1987 年的RA 分类标准,未使用更新版本。
综上所述,血清14-3-3η 水平与RA 高患病风险及疾病活动度相关,并可以在一定程度上预测RA 患者对依那西普治疗的临床应答。

