低酯果胶的氨基酸修饰及修饰物凝胶特性研究
(合肥工业大学 食品与生物工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009)
果胶是由D-半乳糖醛酸通过α-1,4糖苷键连接成主链和由D-半乳糖、L-阿拉伯糖、D-山梨糖和L-鼠李糖等中性糖组成侧链的杂多糖,主链中的羧基通常以部分甲酯化状态存在[1-3]。根据酯化度的不同,果胶分为高酯果胶和低酯果胶,低酯果胶的酯化度小于50%,其胶凝pH为2.6~6.8,低酯果胶中COO-相对较多,分子间的排斥作用大,难以通过自身结合,必须在体系中添加钙离子,通过静电作用与带负电的羧基结合,形成“蛋盒”模型[4]。因此,与高脂果胶相比,低酯果胶在低糖、低热量食品中的应用能满足人们的消费需求。低酯果胶具有生物相容性、无毒性、可生物降解性和高营养价值,因而被视为药品、保健品和化妆品行业中最具吸引力的新型生物聚合物材料,日益受到消费者青睐[5-6]。实际应用中存在Ca2+浓度过大而导致胶体脱水收缩、凝胶不均匀及易形成预凝胶等现象,影响了产品的品质,也限制了低酯果胶的应用[7]。
通过修饰果胶主链上的羟基和羧基,以及侧链中的中性糖,可以制备出功能性质得到改进的衍生物,如溶解性、疏水性、流变性和乳化性能等[8]。Kurita等[9]采用甘氨酸和双甘氨肽修饰果胶后所得产物的水溶性都显著提高,解决了果胶在溶解过程中容易结团的问题。Majzoob等[10]使用1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDAC)合成了具有良好体外生物降解性和低毒性的果胶-半胱氨酸衍生物。Marudova等[11]以聚-L-赖氨酸充当果胶凝胶的交联剂,检测了聚-L-赖氨酸浓度和聚合度对电荷密度和分布不同的果胶凝胶化的影响,发现用聚阳离子肽中和果胶上的阴离子电荷会导致凝胶不透明并最终导致凝胶网络塌陷。笔者以氨基酸修饰低酯果胶制备果胶/氨基酸复合物,以凝胶强度为评价指标,探讨氨基酸种类、果胶质量分数、果胶与氨基酸质量比、pH及Ca2+质量分数等对果胶/氨基酸复合物凝胶强度的影响,通过傅里叶红外光谱(FT-IR)、差示扫描量热法(DSC)和流变学分析果胶/氨基酸复合物的性质,并分析了果胶/氨基酸复合物凝胶的流变学性质,以期为低钙条件制备高强度低酯果胶凝胶提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材 料
柑橘低酯果胶(LMP,酯化度27.9%,分子量100 kD),购于安徽宇宁果胶股份有限公司;赖氨酸(Lys)、精氨酸(Arg)、甘氨酸(Gly)、半胱氨酸(Cys)、谷氨酰胺(Gln)、谷氨酸(Glu)和酪氨酸(Tyr)购于北京索莱宝科技有限公司;其他试剂均为国产分析纯。
1.1.2 仪 器
数显恒温水浴锅(HH-2),国华电器有限公司;分析天平(CP124C),奥豪斯仪器(上海)有限公司;数显电动搅拌器(JJ-1),江苏金坛市金城国胜实验仪器厂;Nicolet 67傅里叶红外光谱仪,美国Thermo公司;质构仪(TA-XT Plus),英国Stable Micro System公司;示差扫描量热仪Q200,美国TA公司;流变仪(DHR-3),美国TA公司。
1.2 方 法
1.2.1 果胶/氨基酸复合物凝胶的制备
称取一定量的低酯果胶加入70 mL一定pH的磷酸缓冲液(0.2 mol/L磷酸氢二钠,0.1 mol/L柠檬酸)中,常温搅拌均匀使其充分溶解,获得不同质量分数的LMP溶液;向LMP溶液中分别加入一定量的不同种类的氨基酸,继续常温搅拌2 h,再80 ℃水浴10 min,得到果胶/氨基酸复合物溶液。另称取一定量的CaCl2溶于30 mL一定pH的磷酸缓冲液中,配制不同质量分数的CaCl2溶液。最后将预热至80 ℃的CaCl2溶液缓慢地加入果胶/氨基酸复合物溶液中,搅拌均匀后冷却,4 ℃保存24 h,制得果胶/氨基酸复合物凝胶[12],测定其凝胶强度。
1.2.2 凝胶强度测定
将待测凝胶样品置于质构仪上,探头P 0.5,测量前速度5 mm/s,测量时速度2 mm/s,返回速度10 mm/s,目标深度10 mm,触发力3g,第一次穿透过程中探头所受的最大应力即为凝胶强度[13]。
1.2.3 各因素对果胶/氨基酸复合物凝胶强度的影响
1) 氨基酸种类:按照1.2.1的步骤,用pH 4.0缓冲液配制质量分数为1.5%的LMP溶液,以m(果胶)∶m(氨基酸)=5∶1的比例分别加入Arg,Lys,Gly,Gln,Cys,Glu和Tyr等7种氨基酸,在Ca2+质量分数为0.5%条件下,制得不同氨基酸修饰的果胶/氨基酸复合物凝胶,测定其凝胶强度。
2) 果胶质量分数:按照1.2.1的步骤,用pH 4.0缓冲液分别配制质量分数为1.0%,1.5%,2.0%的LMP溶液,以m(果胶)∶m(氨基酸)=5∶1的比例分别加入Lys,Gly和Glu,在Ca2+质量分数为0.5%条件下,制得不同果胶质量分数条件下获得的果胶/氨基酸复合物凝胶,测定其凝胶强度。
3) 果胶与氨基酸质量比:按照1.2.1的步骤,用pH 4.0缓冲液配制质量分数为1.5%的LMP溶液,分别加入Lys,Gly和Glu,使m(果胶)∶m(氨基酸)分别为9∶1,7∶1,5∶1和3∶1,在Ca2+质量分数为0.5%条件下,制得果胶与氨基酸不同质量比修饰的果胶/氨基酸复合物凝胶,测定其凝胶强度。
4) pH:按照1.2.1的步骤,分别用pH 2.8,3.4,4.0,4.6,5.2和5.8的缓冲液配制质量分数为1.5%的LMP溶液,以m(果胶)∶m(氨基酸)=5∶1的比例分别加入Lys,Gly和Glu,在Ca2+质量分数为0.5%条件下,制得不同pH缓冲液条件下获得的果胶/氨基酸复合物凝胶,测定其凝胶强度。
5) Ca2+质量分数:按照1.2.1的步骤,用pH 4.0缓冲液配制质量分数为1.5%的LMP溶液,以m(果胶)∶m(氨基酸)=5∶1的比例分别加入Lys,Gly和Glu,分别在Ca2+质量分数为0.3%,0.4%,0.5%,0.6%,0.7%的条件下,制得不同Ca2+质量分数条件形成的果胶/氨基酸复合物凝胶,测定其凝胶强度。
1.2.4 果胶/氨基酸复合物特性分析
在1.2.3实验结果的基础上,分别在最适条件下制作Lys,Gly和Glu修饰的果胶/氨基酸复合物溶液,再将该溶液用2倍体积无水乙醇溶液沉淀出产物,接着用体积分数为80%的乙醇洗涤沉淀产物3遍,最后于50 ℃干燥3 h,研磨成粉状,过80目筛,得粉末状果胶/氨基酸复合物,分析各果胶/氨基酸复合物特性。
1) FT-IR光谱分析:分别将一定量的果胶及果胶/氨基酸复合物干样与KBr粉末一起研磨成粉末,在4 000~400 cm-1进行红外光谱扫描,用Origin 8.5软件将收集的数据绘制为吸光度与波数的函数关系图,并进行分析。
2) DSC测定:分别称取10 mg果胶和果胶/氨基酸复合物干样,置于坩埚中,以空坩埚为对照扫描,以10 K/min的升温速率从20 ℃升至350 ℃,氮气流速50 mL/min,测定果胶及果胶/氨基酸复合物变性温度[14]。
1.2.5 果胶/氨基酸复合物凝胶流变性质测定
1) 温度扫描:在1.2.3凝胶制备结果的基础上,分别在最适条件下制作Lys,Gly和Glu修饰的果胶/氨基酸复合物溶液,接着缓慢倒入预热至80 ℃的CaCl2溶液,搅拌均匀后立即取1 mL混合液于流变仪样品台中,样品表面加轻质硅油,防止水分蒸发,使用Peltier系统将温度预先升至80 ℃,然后以2 ℃/min的线性速率降至20 ℃,记录凝胶化过程中的储能模量(G′)和损耗模量(G″)。设定恒定频率为1 Hz,恒定应变为0.1%。
2) 频率扫描:在1.2.3实验结果的基础上,分别在最适条件下制作Lys,Gly和Glu修饰的果胶/氨基酸凝胶样品,再于1 rad/s至100 rad/s范围进行频率扫描,测试温度为20 ℃,记录G′和G″变化[15]。
1.2.6 果胶/氨基酸复合物中分子间作用力
在1.2.3实验结果的基础上,在最适条件下制备果胶/氨基酸复合物溶液中添0.1,0.3,0.5 mol/L NaCl溶液,参考1.2.5方法测定不同Na+浓度对果胶/氨基酸复合物凝胶的流变性质,分析果胶/氨基酸复合物中的分子间作用力。
1.2.7 数据处理
实验重复3次,取平均值±标准差的形式表示,数据通过SPSS软件进行单因素方差分析(ANOVA),数据的显著性(p<0.05)通过Duncan’s法比较,图片通过Origin 8.5软件制作。
2 结果与讨论
2.1 不同因素对果胶/氨基酸复合物凝胶强度影响
2.1.1 氨基酸种类
氨基酸种类对果胶/氨基酸复合物凝胶强度影响如图1所示。
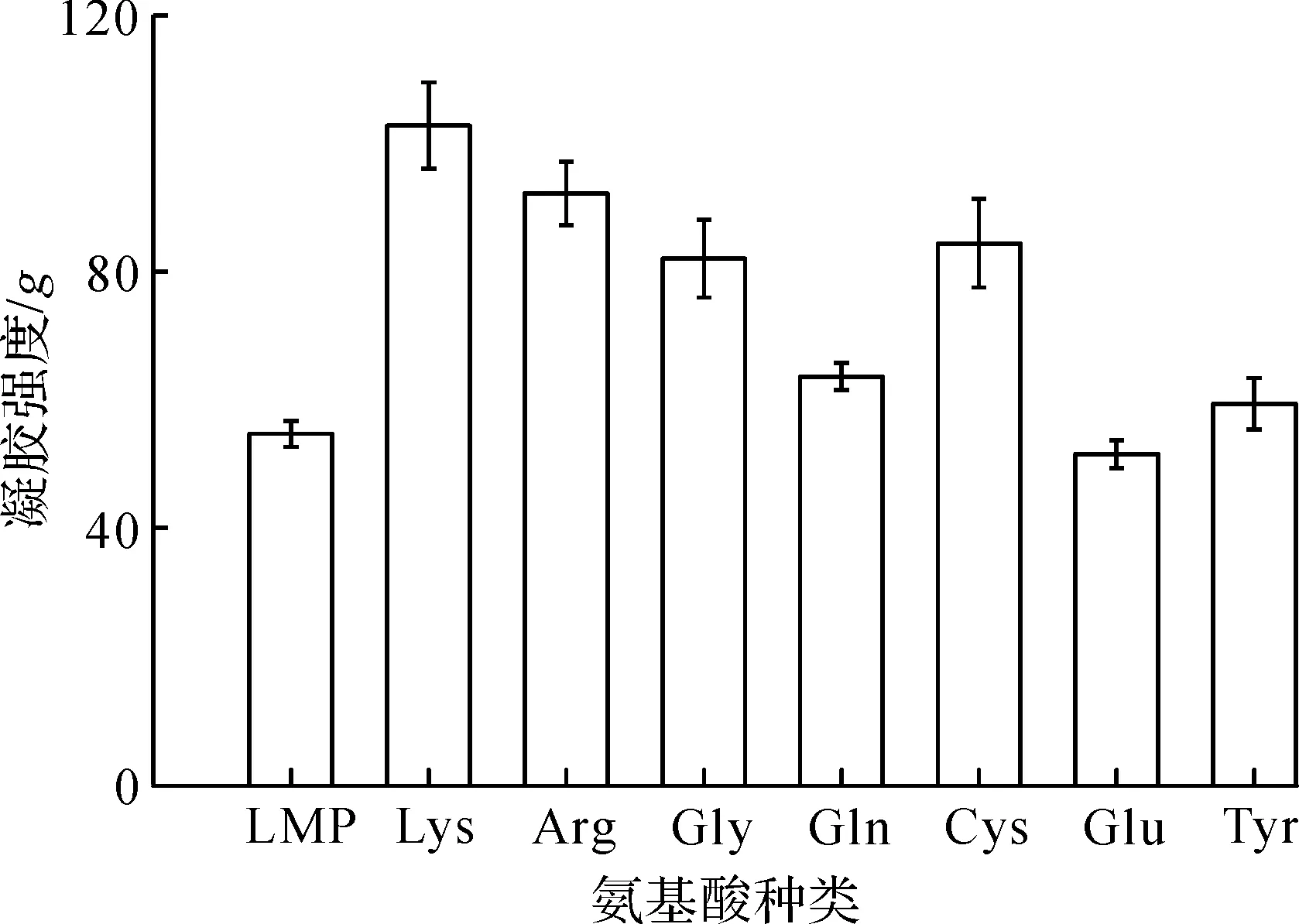
图1 氨基酸种类对果胶/氨基酸复合物凝胶强度影响Fig.1 Effect of amino acid species on the gel strength of pectin/amino acid complex
由图1可知:氨基酸种类对果胶/氨基酸复合物凝胶强度的影响有显著性差异(p<0.05)。其中Lys和Arg修饰后的果胶凝胶强度最强,强度分别达到102g和92g,比对照组(54g)增加了将近2倍;Gly和Cys修饰的低酯果胶的凝胶强度也比对照组高,强度分别达到82g,84g;Gln,Glu和Tyr修饰的低脂果胶的凝胶强度与对照组相比没有显著性差异(p>0.05),强度分别为58g,52g,60g。这可能与氨基酸类型有关,它们具有不同侧链,带有不同数量的电荷,导致它们与低酯果胶的相互作用方式及作用能力有差异,故而表现出对低酯果胶凝胶强度的改变不同。根据图1的结果,以碱性氨基酸Lys、中性氨基酸Gly和酸性氨基酸Glu为代表,分析不同氨基酸修饰的低酯果胶的修饰条件对果胶/氨基酸复合物凝胶强度的影响规律。
2.1.2 果胶质量分数
果胶质量分数对果胶/氨基酸复合物凝胶强度影响如图2所示。
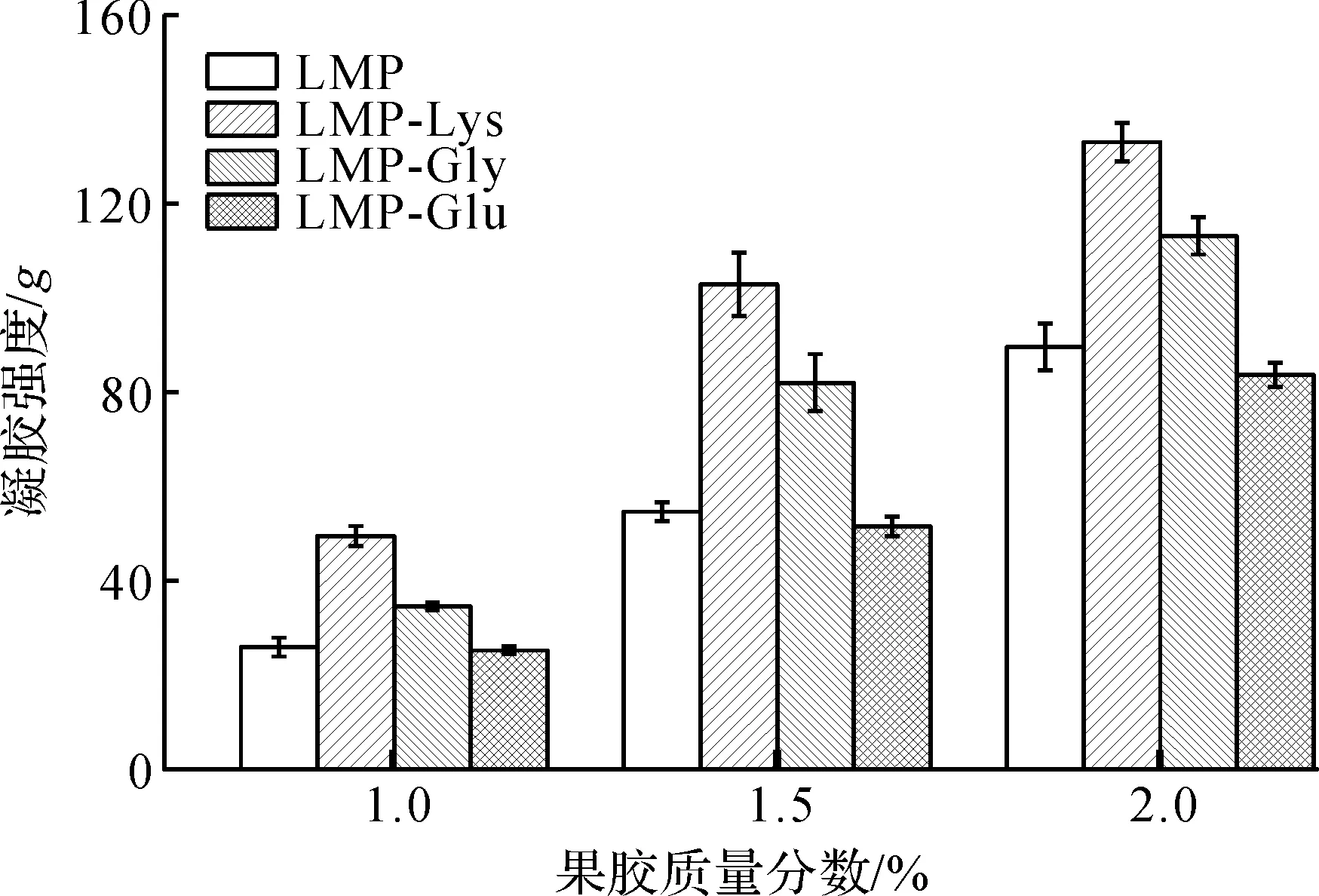
图2 果胶质量分数对果胶/氨基酸复合物凝胶强度影响Fig.2 Effect of pectin concentration on the gel strength of pectin/amino acid complex
由图2可知:Lys与Gly修饰的果胶均明显高于(p<0.05)对照组果胶的凝胶强度。果胶/氨基酸复合物凝胶强度随着果胶质量分数的增加而增强(p<0.05)。当果胶质量分数为1.0%时,大部分凝胶样品凝胶强度低于40g,凝胶样品较松散;果胶质量分数达到1.5%时,凝胶强度普遍超过80g,凝胶更稳定更具弹性;果胶质量分数为2.0%,凝胶强度普遍达到110g以上。这可能是因为随着果胶质量分数的增加,单位空间的果胶分子增多,果胶间的间隙逐渐减小,果胶链之间的交联增强;同时,单位体积中羧基与钙离子结合的几率变大,故而赋予修饰后的果胶凝胶具有更好的质构特性[16]。因此,综合实验结果和经济效益,果胶质量分数选择1.5%。
2.1.3 果胶与氨基酸质量比
果胶与氨基酸质量比对果胶/氨基酸复合物凝胶强度影响如图3所示。
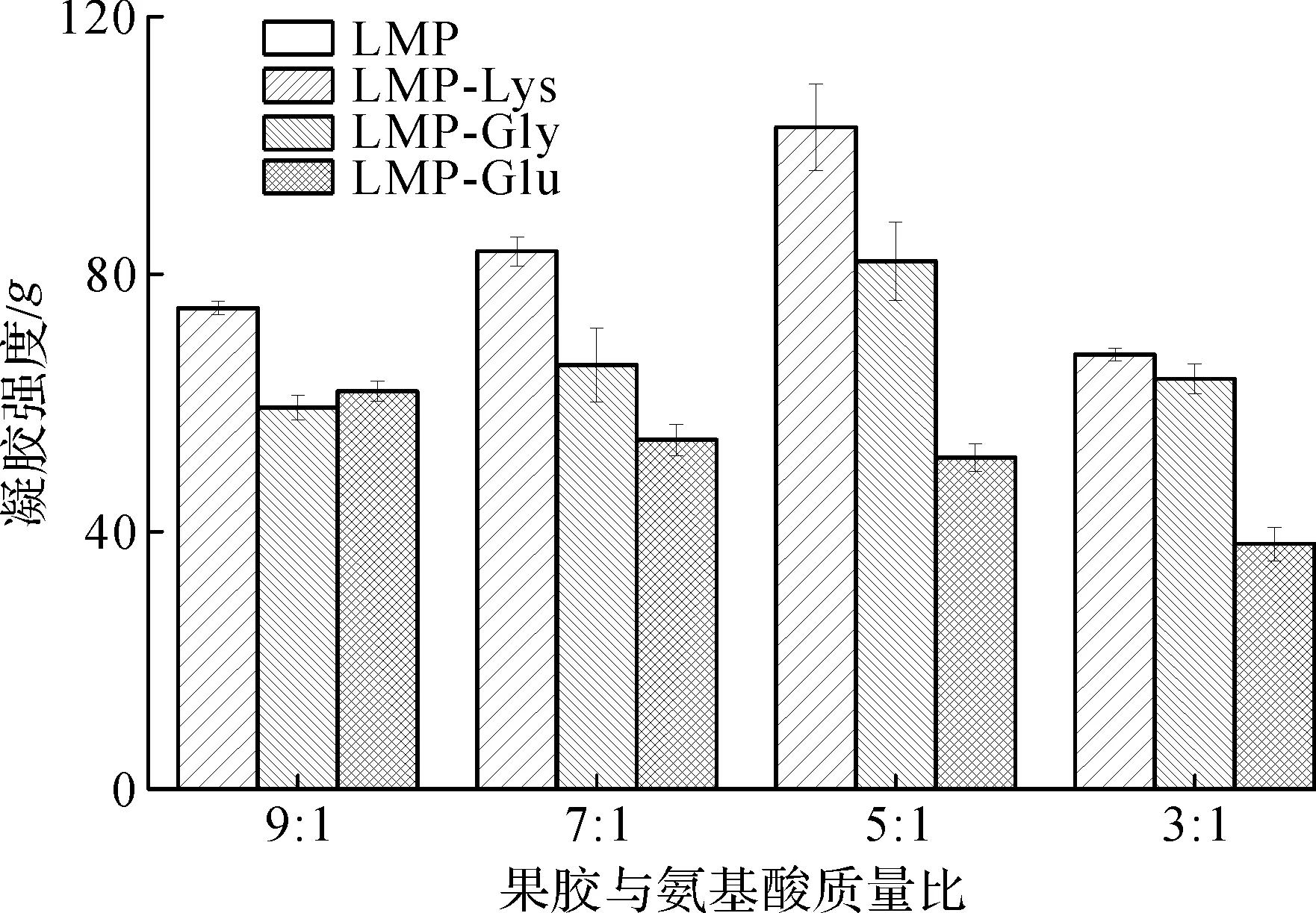
图3 果胶与氨基酸质量比对果胶/氨基酸复合物凝胶强度影响Fig.3 Effect of pectin and amino acid ratio on the gel strength of pectin/amino acid complex
由图3可知:经Lys和Gly修饰的果胶/氨基酸复合物凝胶强度随着果胶与氨基酸质量比的增加而增强(p<0.05),m(果胶)∶m(氨基酸)=5∶1时达到最大,之后再增加比例凝胶强度呈现下降趋势。这可能是因为随着氨基酸含量的增加,与果胶主链上基团复合的几率增强,形成更稳定的网络结构,从而增强了凝胶性能。Glu则不同,随着氨基酸的添加,果胶/氨基酸复合物凝胶强度一直呈下降趋势,这可能与Glu自身性质有关,在pH 4.0时,Glu和果胶等电点均小于溶液pH,造成一定的空间排斥,降低复合物结合程度,从而降低凝胶强度。因此,选取m(果胶)∶m(氨基酸)=5∶1。
2.1.4 pH
pH对果胶/氨基酸复合物凝胶强度影响如图4所示。
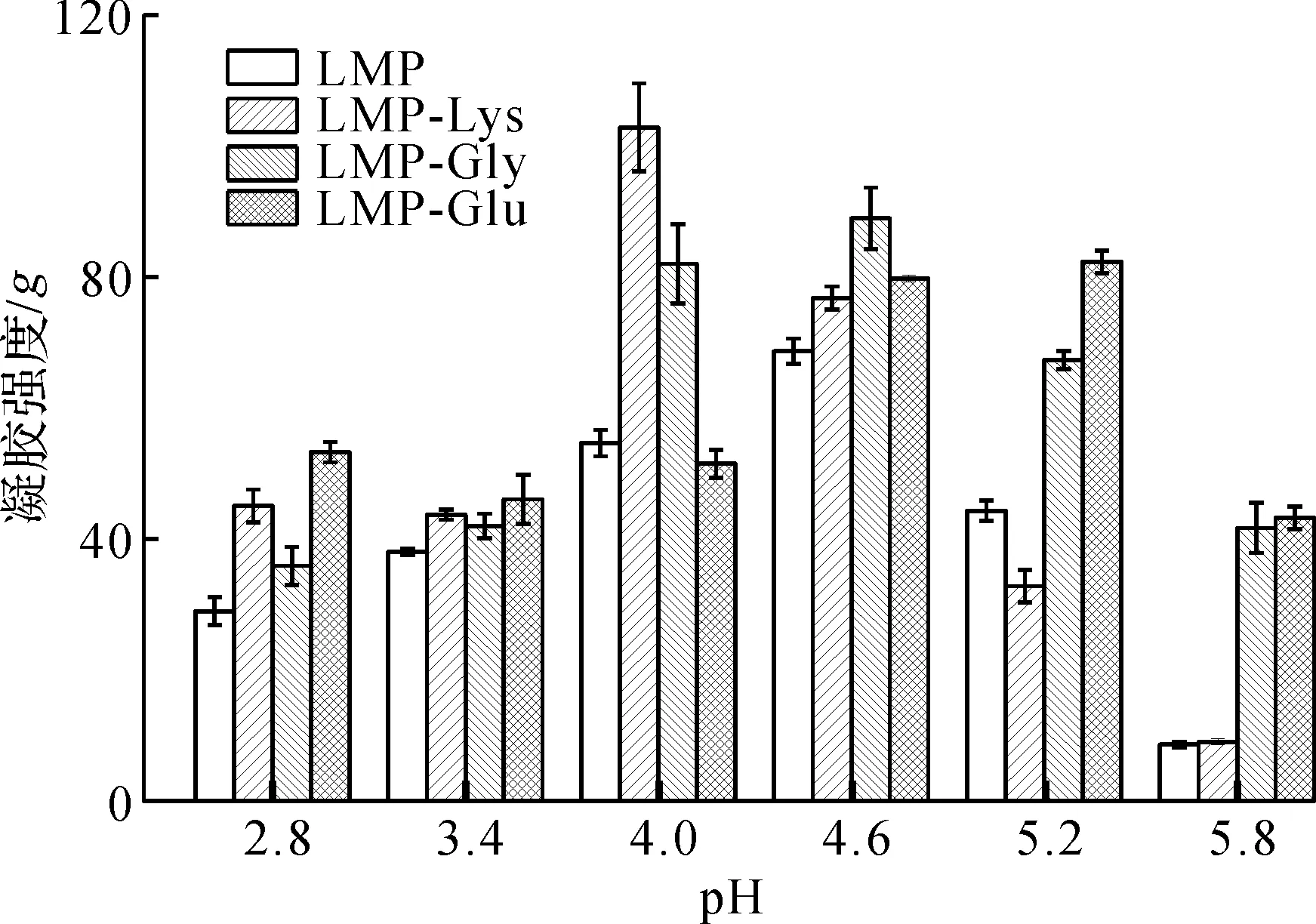
图4 pH对果胶/氨基酸复合物凝胶强度影响Fig.4 Effect of pH on the gel strength of pectin/amino acid complex
由图4可知:pH为2.8~3.4时,果胶与果胶/氨基酸复合物凝胶强度为40g左右,差异不显著(p>0.05);当pH为4.0时达到最佳凝胶效果,此时经Lys修饰的果胶/氨基酸复合物凝胶强度明显高于其他样品,约为对照组的2倍,而经Glu修饰的果胶/氨基酸复合物强度变化不明显;当pH继续升高时,果胶/氨基酸复合物凝胶强度呈现下降趋势。这可能是由于在合适的pH 4.0左右条件下,果胶携带较多游离羧基,增大了分子间排斥力,与Ca2+结合形成更多稳定的“蛋盒”桥联结合区,使得果胶凝胶性能逐渐改善和增强[17]。因此,最佳pH为4.0,此时果胶及果胶/氨基酸凝胶强度普遍达到最大。
2.1.5 Ca2+质量分数
Ca2+质量分数对果胶/氨基酸复合物凝胶强度影响如图5所示。
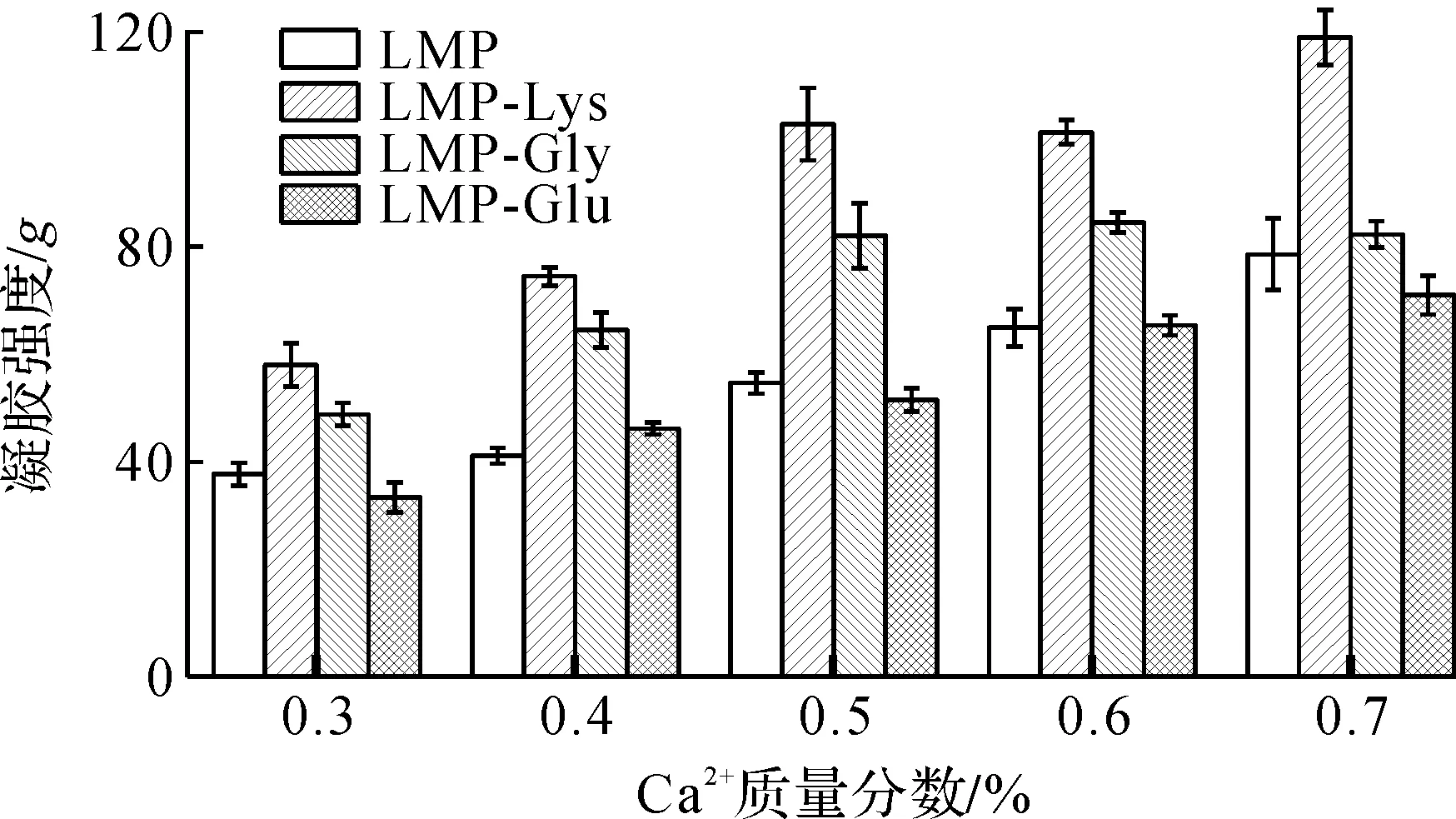
图5 Ca2+质量分数对果胶/氨基酸复合物凝胶强度影响Fig.5 Effect of Ca2+ concentration on the gel strength of pectin/amino acid complex
由图5可知:果胶及果胶/氨基酸复合物凝胶强度表现出强烈的Ca2+质量分数依赖性。当Ca2+质量分数为0.5%时,各果胶/氨基酸复合物凝胶强度均达到最大;随着Ca2+质量分数继续增加,凝胶强度增加趋势缓慢。这可能是因为随着Ca2+质量分数的增加,与COO—结合形成越来越多的“蛋盒”结合区,达到稳定的三维网络结构,但Ca2+质量分数过高时,三维结构开始收缩,胶组织变脆、出水,凝胶强度随之减弱[18]。因此,最佳Ca2+质量分数为0.5%。
2.2 果胶/氨基酸复合物的FT-IR光谱
果胶及果胶/氨基酸复合物红外图如图6所示。
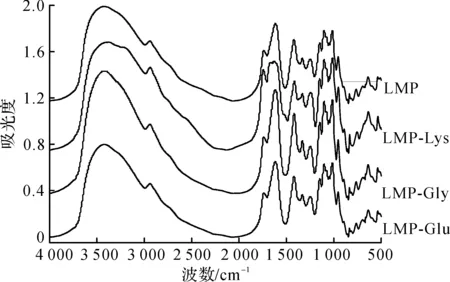
图6 果胶及果胶/氨基酸复合物红外图Fig.6 Infrared spectra of pectin and pectin/amino acid complex
由图6可知:果胶和果胶/氨基酸复合物红外吸收峰的总体峰形无明显差异,其中3 440是—OH伸缩振动,2 940是C—H伸缩振动,1 750是COOCH3和COOH振动,1 620是游离羧基振动,1 420,1 330是C—H弯曲振动(CH2、CH3),1 000~1 250是COC振动[19],表明果胶/氨基酸复合物都有果胶的特征吸收峰。与LMP红外峰相比,经氨基酸修饰的果胶/氨基酸复合物出现新的峰,其中LMP-Lys在1 664出现酰胺Ⅰ的特征吸收峰[20-21],说明在氨基酸修饰果胶过程中果胶主链上的羧基与Lys上的氨基可能发生了酰胺化反应,形成了酰胺键。
2.3 果胶/氨基酸复合物的DSC特性
果胶及果胶/氨基酸复合物DSC曲线如图7所示。
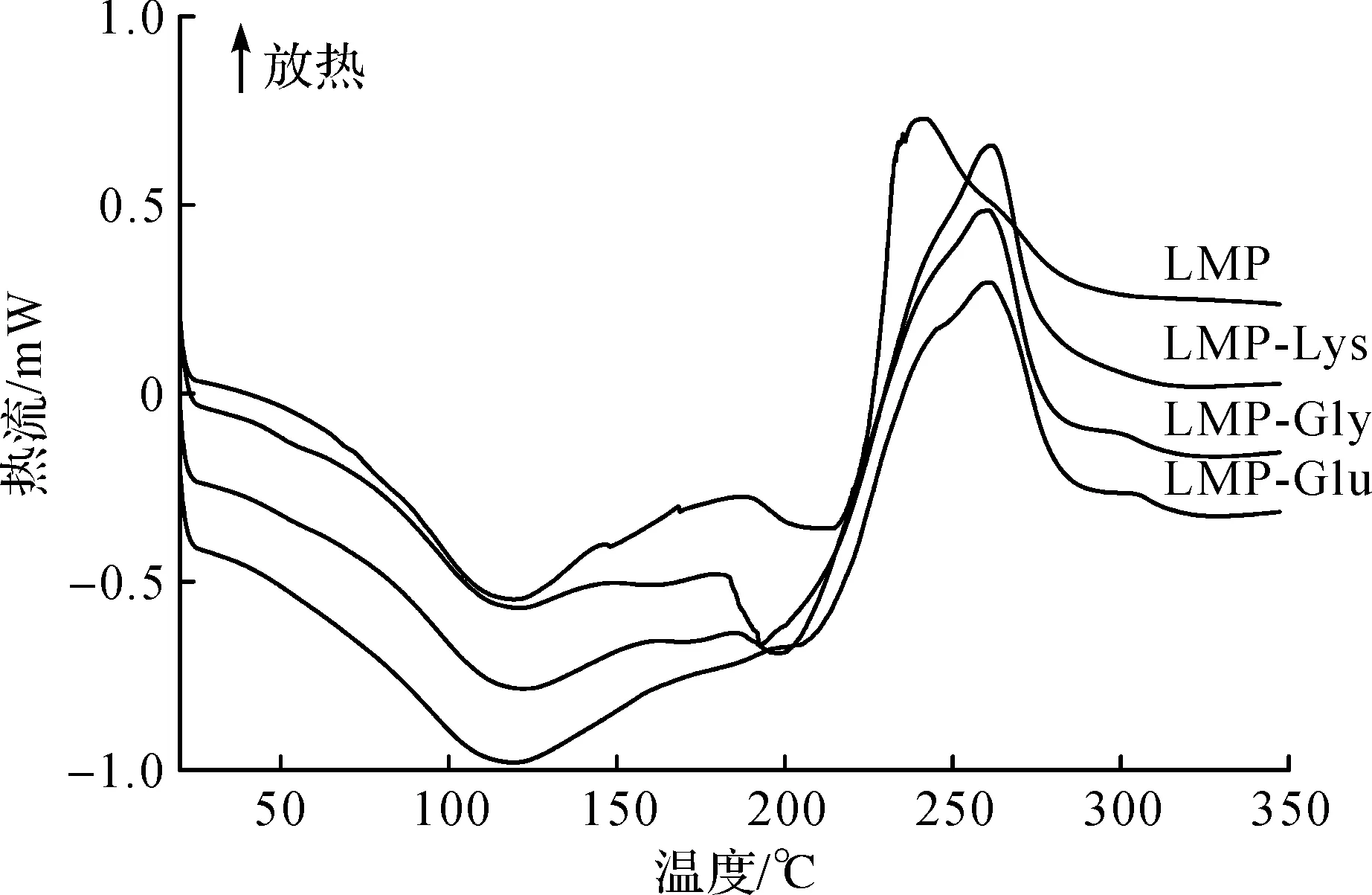
图7 果胶及果胶/氨基酸复合物DSC曲线Fig.7 DSC curve of pectin and pectin/amino acid complex
由图7可知:果胶及果胶/氨基酸复合物均在120 ℃左右和190~220 ℃出现吸收峰,第一个吸热峰为果胶的溶解,第二个吸热峰为果胶的脱水,然后在较高的温度下脱羧,并伴随主链C—C共价键的断裂,最终导致果胶的降解[22]。与对照组相比,经氨基酸修饰的果胶/氨基酸复合物的降解温度从240 ℃升至260 ℃,果胶/氨基酸复合物热稳定性提高可能是由于果胶多糖羧基与氨基酸氨基的结合导致热降解温度升高[23-24]。
2.4 果胶/氨基酸复合物凝胶的流变学特征
通过动态流变性能测试,考察了氨基酸修饰对果胶凝胶力学性能和内在结构的影响,结果如图8,9所示。

图8 果胶/氨基酸复合物凝胶体系温度扫描曲线Fig.8 Temperature-sweeping curves of pectin/amino acid complex gel system
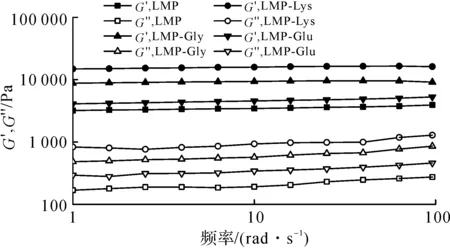
图9 果胶/氨基酸复合物凝胶体系频率扫描曲线Fig.9 Frequency-sweeping curves of pectin/amino acid complex gel system
由图8可知:储能模量(G′)和损耗模量(G″)在降温冷却(80~20 ℃)模式下所有样品的G′值都比G″值大得多,表明所获得果胶凝胶具有典型的弹性凝胶状结构[25],且经氨基酸修饰的果胶/氨基酸复合物G′值整体高于对照组,其中LMP-Lys显示最强,表明氨基酸的修饰增强了原来的凝胶结构,这与质构仪所测的凝胶强度趋势相对应。由图9可知:氨基酸修饰的果胶/氨基酸复合物G′,G″表现出同温度扫描相似的趋势,其中LMP-Lys、LMP-GlyG′值都明显高于对照组;对于所有的凝胶样品,G′和G″随频率从1增加到100 rad/s过程中有小幅度的增强,表现出轻微的频率依赖性,说明所制备的果胶样品具有稳定的凝胶网络结构[26]。
2.5 果胶/氨基酸复合物中分子间作用力
NaCl浓度对果胶/氨基酸复合物凝胶体系温度扫描曲线的影响如图10所示。
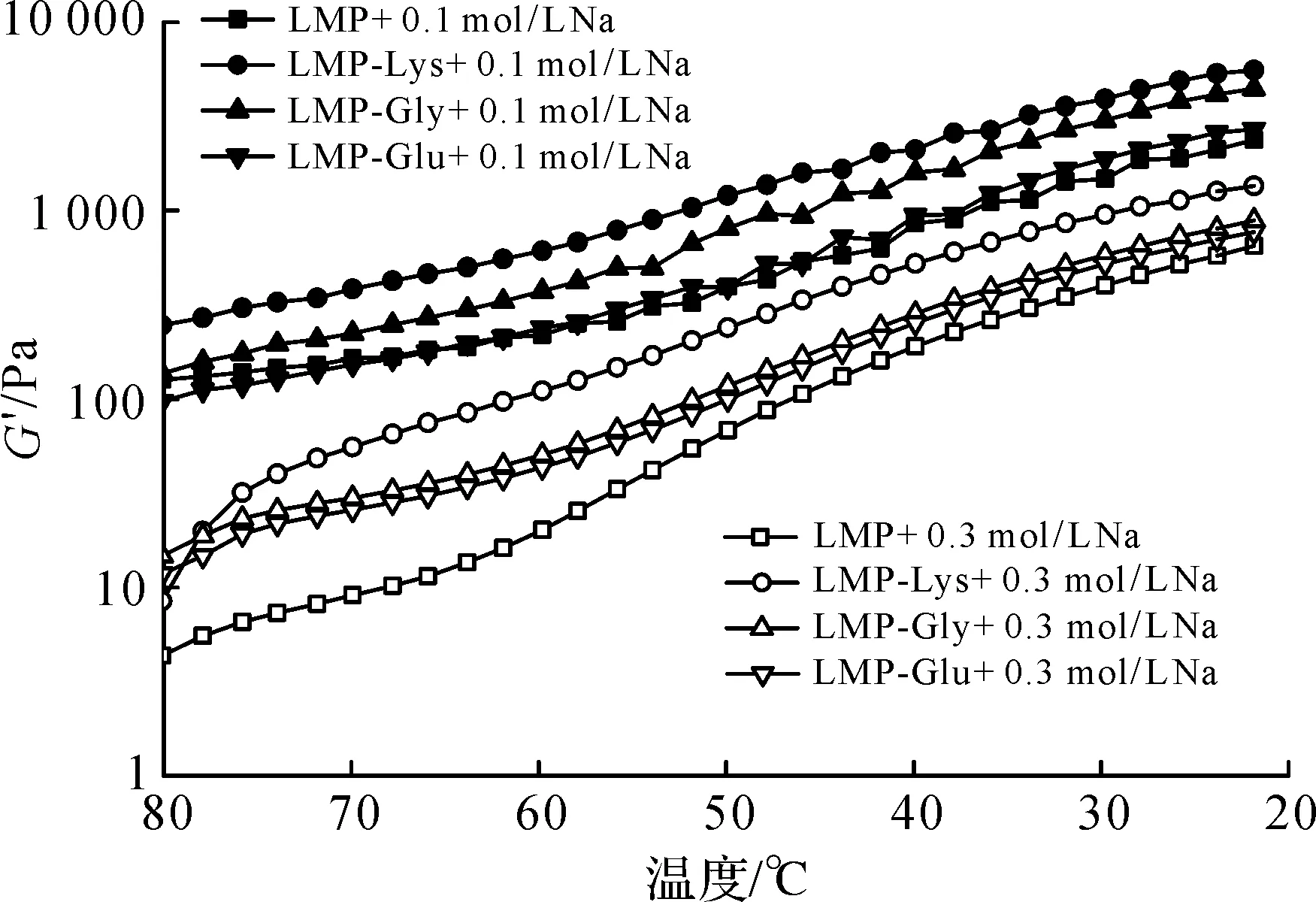
图10 NaCl浓度对果胶/氨基酸复合物凝胶体系温度扫描曲线的影响Fig.10 Effect of NaCl concentration on the temperature-sweeping curve of pectin/amino acid complex gel system
由图10可知:相较于未添加NaCl的凝胶样品,当NaCl浓度为0.1 mol/L时,所有凝胶样品G′呈缓慢下降的趋势,当浓度达到0.3 mol/L时,G′急剧下降,呈现弱凝胶并伴随出水现象,随着盐浓度达到0.5 mol/L时,所有样品不成胶(未显示数据)。
NaCl浓度对果胶/氨基酸复合物凝胶体系频率扫描曲线的影响如图11所示。
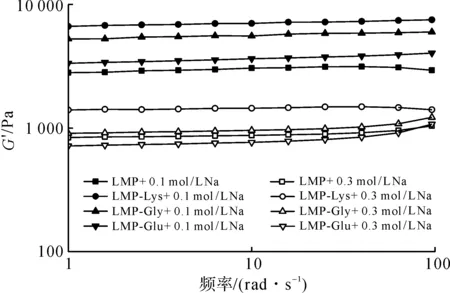
图11 NaCl浓度对果胶/氨基酸复合物凝胶体系频率扫描曲线的影响Fig.11 Effect of NaCl concentration on the Frequency-sweeping curves of pectin/amino acid complex gel system
由图11可知:所有样品G′随NaCl浓度的增加而减小,进一步印证了NaCl的添加对果胶/氨基酸复合物凝胶网络结构产生影响,说明静电作用力在低酯果胶/氨基酸复合物形成凝胶的过程中起到关键作用[27]。
3 结 论
通过对果胶/氨基酸复合物凝胶形成条件的单因素研究发现,Ca2+质量分数是果胶凝胶形成的必要因素,果胶浓度、氨基酸种类、果胶与氨基酸的质量比及pH也相应影响凝胶效果,果胶溶液凝胶最佳条件为:果胶质量分数为1.5%,m(果胶)∶m(氨基酸)=5∶1,pH为4,Ca2+质量分数0.5%时,经碱性氨基酸修饰的果胶/氨基酸复合物较酸性氨基酸凝胶强度更强,该条件下的凝胶强度能达到100g以上,比对照组的凝胶强度高出了将近2倍,氨基酸的添加有利于在减少Ca2+浓度下达到同样的凝胶效果,且通过热力学和流变学分析进一步说明复合物结构更具稳定性。