多孔氮化硼复合水净化材料的制备及其再生性能
何 适 ,李 杰 ,戴 伟 ,陶军晖 ,刘俊逸 ,田永红
1.长江大学物理与光电工程学院,湖北 荆州 434023;
2.湖北第二师范学院物理与机电工程学院,湖北 武汉 430205
随着世界人口的增长和工业化进程的加快,环境问题,尤其是水污染问题日益成为人们亟待解决的关键问题之一[1-3]。未经处理的工业及生活废水被直接排放,对自然生态环境及人类身体的健康造成巨大威胁。因此,通过吸附、光催化降解和生物降解等先进技术净化处理污水对解决水体污染问题具有重要的意义。在这些方法中,吸附是最有效的水处理方法之一[4-6]。
传统的用于水净化的吸附材料,如活性炭[7-8]、碳纤维膜[9]和胺基化的高分子聚合物纤维[10-11]等,对于一般污染物具有较高的吸附能力。但是,对于成分复杂的污水和更加严格的排放标准,这些传统吸附材料的污水净化能力和再生利用率不能完全满足需求。
多孔氮化硼(porous boron nitride,PBN)具有独特的物理化学特性,如高比表面积、大的孔体积、低密度、优良的化学稳定性和抗氧化性等[12-15],使其在水净化领域具有广泛的应用前景。然而,PBN水净化材料重复利用效率低,导致资源的极大浪费,同时也不利于环境保护。目前处理对水中污染物吸附饱和的PBN的再生方法主要是酸洗涤法和烧灼法。但是这些再生方法存在造成环境二次污染、成本高和能耗高等缺陷,这种低效的再生方法阻碍了PBN在水净化领域的实践应用。
本文针对PBN再生效率低的缺点,研究了通过水热合成法制备的α-Fe2O3/PBN复合水净化材料,所制备的复合水净化材料相对于初始PBN,其吸附性能无明显下降,且负载前后PBN的晶体结构无变化。负载在PBN表面的α-Fe2O3与过氧化氢(hydrogen peroxide,H2O2)发挥协同催化降解作用[16-17],将吸附在复合水净化材料表面的有机污染物进行催化降解,从而使吸附材料得到再生。通过6次吸附-再生-吸附循环,所制备的α-Fe2O3/PBN复合水净化材料的吸附能力仍能保持原有吸附材料的93.5%。且这种再生方法具有操作简单、成本低和环境友好等特点。由此可见,α-Fe2O3/PBN复合水净化材料在环境治理领域有巨大的应用前景。
1 实验部分
1.1 样品制备
首先,将68 mg六水氯化铁(ferric chloride hexahydrate,FeCl3·6H2O,)溶解于50 mL去离子水中,并加入适量的九水硅酸钠(sodium silicate 9-hydrate,Na2SiO3·9H2O);接着,将200 mg PBN加入到溶液中,磁力搅拌器搅拌5 min后,放入到超声仪中继续超声处理10 min;然后,将所得混合物置于水压釜中,加热至190℃并保温1 h,并自然冷却;最后,将所得混合溶液过滤,并用去离子水和无水乙醇反复冲洗固体物质,所得红色产物即为α-Fe2O3/PBN复合水净化材料。
1.2 样品表征
采用粉末X射线衍射仪(X-ray diffractometer,XRD)(岛津XRD-6100型)分析样品的结晶结构及其晶型。采用扫描电子显微镜(scanning electron microscope,SEM)(日立SEM S-4800型)对样品的微观形貌结构进行观察分析。采用全自动等温吸附仪(autosorb quantachrome instruments)(美国康塔Autosorb-iQ-1900型)分析样品的比表面积、孔体积及其孔道结构特征,其测试温度为-196℃。采用紫外可见分光光度计(ultraviolet-visible spectrophotometer,UV-vis)(岛津 UV-2600型)测量吸附前后水溶液中不同染料分子的特征吸收峰的强度,并通过回归计算的方式定量计算污水中不同污染物的浓度。
2 结果与讨论
2.1 复合水净化材料的表征
图1(a)为PBN和α-Fe2O3/PBN复合水净化材料的XRD图。从图1(a)可以观察到,在PBN的XRD图中位于2θ=26°的衍射峰半峰宽较宽且强度较弱,此峰可指标化为六方氮化硼的(002)晶面[18];而在 2θ=42.5°的位置出现一个较宽且强度较弱的衍射峰,此衍射峰可指标化为六方氮化硼(100)晶面的衍射峰。同时,可指标化为六方氮化硼(101)晶面的位于43.8°的衍射峰并未出现在此XRD图谱中,说明其结晶度较低,有序度不高,且所得PBN的结构与文献报道的错层六方BN结构一致[19]。氮化硼为类碳结构的材料,其结构为层状,多孔结构的形成,可能导致其有序的层状结构被破坏,故无序的错层结构预示着其内部存在大量的孔洞结构[19]。图1(a)中α-Fe2O3/PBN复合水净化材料的XRD图谱显示,PBN在负载α-Fe2O3前后,其衍射峰的峰位和峰型并没有明显的变化,说明α-Fe2O3负载并未改变PBN的内部晶体结构。而α-Fe2O3/PBN复合水净化材料中同时存在峰位位于23.8,32.8,35.3,40.3,49.2,53.6,62.1,63.7°的衍射峰,其可分别指标化为α-Fe2O3的(012)(104)(110)(113)(024)(116)(214)和(300)晶面(JCPDS Card No.24-0072),与报道的数据吻合[20-21]。此结果说明通过水热法成功地将α-Fe2O3负载在PBN上,并获得α-Fe2O3/PBN复合水净化材料。
图 1(b)为α-Fe2O3/PBN 复合水净化材料的SEM图。SEM图显示,α-Fe2O3颗粒并未出现明显团聚,而是较为均匀致密地分布在PBN的表面。其均匀分布可能主要归因于以下2个方面的原因:Fe3+均匀吸附在PBN表面;Na2SiO3·9H2O呈碱性可使Fe3+在PBN表面形成均匀分布的Fe(OH)3。较均匀分布的α-Fe2O3在与H2O2的协同作用下能对吸附在PBN表面的有机污染物发挥最大的催化降解效能[22]。这也预示着α-Fe2O3/PBN复合水净化材料具有优异的再生效率。
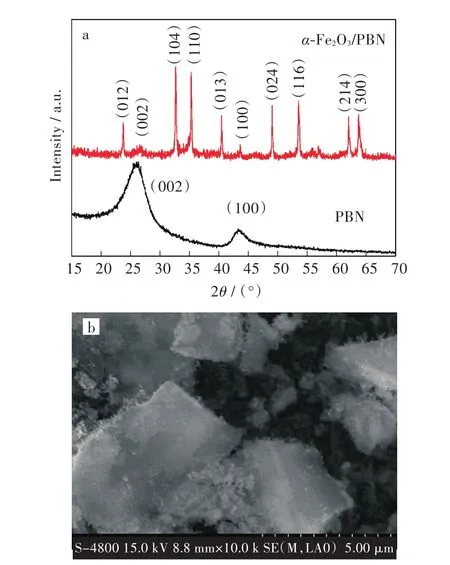
图1 α-Fe2O3/PBN:(a)XRD图,(b)SEM图Fig.1 α-Fe2O3/PBN:(a)XRD patterns,(b)SEM image
图 2(a)为 PBN 和α-Fe2O3/PBN复合水净化材料在-196℃下氮气吸附/脱附等温线。观察两者的等温吸附曲线可知,负载反应前后的曲线的形状基本相同。这说明经过负载α-Fe2O3后所得的α-Fe2O3/PBN复合水净化材料的孔道结构与负载前的PBN无明显变化。依据国际理论和应用化学联合会分类标准,PBN和α-Fe2O3/PBN复合水净化材料均含有微孔结构,同时也存在撕裂的介孔结构。此外,负载反应后所得的α-Fe2O3/PBN复合水净化材料的低温氮气吸附量略低于负载前的PBN,表明负载反应使PBN的比表面积和孔体积有所下降。通过 Brunauer-Emmett-Teller(BET)公式计算可得,负载后PBN的比表面积由初始的960 m2/g降低到780 m2/g。孔体积也从原来的0.57 cm3/g减少到0.49 cm3/g。通过对比分析PBN负载前后比表面积和孔体积可知,负载反应发生在PBN的表面,并未对其孔道结构产生明显的影响。这与PBN负载α-Fe2O3前后的XRD图谱结果相吻合。
2.2 复合水净化材料的吸附及再生性能研究

图2 PBN和α-Fe2O3/PBN:(a)在-196℃下氮气吸附/脱附等温线,(b)对MB的吸附速率,(c)再生循环利用率对比图Fig.2 PBN and α-Fe2O3/PBN:(a)nitrogen adsorption/desorption isotherms at-196 ℃,(b)adsorption rates of MB,(c)comparison of regeneration performance
PBN与α-Fe2O3/PBN复合水净化材料均具有高的比表面积和大的孔体积等优良性能,可用于工业及生活污水处理。为了证明α-Fe2O3/PBN复合水净化材料在环境治理方面的潜在应用价值,选用亚甲基蓝(methylene blue,MB)染料做为模拟污染物测试其水净化能力。同时,以PBN为对照,评估通过水热法将α-Fe2O3负载到PBN上所制备的复合水净化材料相对于初始PBN的污水处理能力的变化。
将100 mg的PBN与110 mg的α-Fe2O3/PBN复合水净化材料分别加入到初始浓度、温度和pH值分别为40 mg/L、30℃和300 mL的MB水溶液中,测试PBN与α-Fe2O3/PBN复合水净化材料对水溶液中有机染料MB的吸附曲线,如图2(b)所示。本实验所制得的α-Fe2O3/PBN复合水净化材料为α-Fe2O3的负载量占复合材料总质量的10%的样品。吸附实验结果显示,PBN与α-Fe2O3/PBN复合水净化材料对水溶液中MB均具有较高的吸附效率。由图2(b)可知,PBN在开始的10 min内去除水溶液中98.5%的MB,在60 min内去除99.8%的MB染料分子;α-Fe2O3/PBN复合水净化材料也同样具有优异的水净化能力,其在最初的10 min内去除水溶液中94.5%的MB分子,在60 min内去除96.8%的MB染料分子。由此可以得出,相对于PBN而言,负载10%的α-Fe2O3的α-Fe2O3/PBN复合水净化材料对水溶液中MB染料分子的吸附能力没有明显的变化。这说明α-Fe2O3的负载并未使PBN的吸附性能产生明显的下降。
优异的再生性能是污水净化材料在环境净化领域获得广泛应用的关键因素之一。α-Fe2O3/PBN复合水净化材料具有优良的化学稳定性和热稳定性,故可利用简单、绿色、高效的协同催化降解反应将其再生并充分利用。具体来说,将吸附饱和的α-Fe2O3/PBN复合水净化材料在H2O2溶液中处理1 h,即可将吸附在α-Fe2O3/PBN复合水净化材料表面的有机染料去除掉,从而使复合水净化材料获得再生。很明显,此种协同催化再生方法具有广泛的应用前景。水净化实验表明,经过6次吸附-再生循环后,再生后的α-Fe2O3/PBN复合水净化材料的移除能力保持初始复合材料移除能力的93.5%,如图2(c)所示。值得注意的是,再生后的α-Fe2O3/PBN复合水净化材料因其高的化学稳定性和结构稳定性,故在经过第4次循环后,其移除效率下降并不明显。
为了更加清晰地认知α-Fe2O3在α-Fe2O3/PBN复合水净化材料再生过程中的作用,选用PBN进行对比。将两者分别放入相同浓度的H2O2溶液中进行再生实验,实验结果显示,PBN经过第1次再生循环后,其吸附效率仅为初始的30%;而经过6次吸附-再生活化循环后,其吸附效率损失其初始的88.2%。实验结果表明,α-Fe2O3/PBN复合水净化材料的再生效率远大于PBN的。由此可知,α-Fe2O3的存在增强了吸附在复合水净化材料表面有机染料分子的降解效率。
通过分析再生后的α-Fe2O3/PBN复合水净化材料的晶型结构,进一步验证其优异的再生性能。图 3(a)和图 3(b)分别为再生后α-Fe2O3/PBN 复合水净化材料的XRD和SEM图,从图3(a)中可以观察到,再生后的α-Fe2O3/PBN复合水净化材料相对于初始样品[图1(a)]的晶型结构几乎相同,值得注意的是,其α-Fe2O3/PBN颗粒仍然较为均匀地分布在PBN表面,如图3(b)的SEM图中箭头所指。此结果说明吸附-再生循环反应过程对α-Fe2O3/PBN复合水净化材料的吸附能力和结构无明显影响。故其优异的再生效率将很好地降低水处理的运营成本,在污水净化领域具有巨大的应用前景。

图3 再生后的α-Fe2O3/PBN:(a)XRD图,(b)SEM图Fig.3 Regenerated α-Fe2O3/PBN:(a)XRD pattern,(b)SEM image
2.3 复合水净化材料的再生机理研究
吸附-再生-吸附实验证实,α-Fe2O3/PBN复合吸附材料具有优异的吸附和再生能力,其优异的吸附能力是由物理及化学吸附共同作用产生的[23-24],而其高效的再生效率主要由于α-Fe2O3对吸附在PBN表面的有机污染物具有优良的降解能力[25]。具体来说,α-Fe2O3/PBN复合吸附材料优良的降解能力可能主要归因于3个因素:α-Fe2O3催化加速了H2O2分解,产生了较多·O2(氧自由基),亲核能力较强[26-28];α-Fe2O3做为酸碱金属氧化物,可以提供较多的稳定弱酸弱碱位,MB吸附在α-Fe2O3上或氮化硼活性位点上,降低了活化能,氧自由基能亲核进攻MB,加快其氧化速度;H2O2均存在还原性,能将Fe3+部分还原成Fe2+,并与H2O2发生芬顿反应[29],Fe2++H2O2→Fe3++OH-+·OH,产生的羟基自由基具有非常强的氧化性。
3 结 语
本文通过水热法将α-Fe2O3负载在PBN上,成功制备α-Fe2O3/PBN复合水净化材料,其对水溶液中的有机染料具有优良的移除能力。此外,利用α-Fe2O3及H2O2的协同催化降解作用分解吸附于PBN表面的有机污染物,从而使PBN仍能保持良好的吸附性能。通过对比PBN与α-Fe2O3/PBN复合水净化材料再生前后对水溶液中MB染料吸附效率证实α-Fe2O3/PBN复合水净化材料展现出优良的再生和重复利用能力,经过6次循环后,其移除效率仅仅损失初始的6.5%,而PBN吸附效率损失其初始的88.2%。由此证实,α-Fe2O3增强了吸附在复合水净化材料表面有机染料分子的降解效率,提高了其再生能力。本方法具有操作简单、成本低、效率高、对环境友好等特点,在水处理领域具有广阔的应用前景。

