一/二代头孢菌素用于肝胆外科手术预防性抗菌的效果模拟研究
魏 杰 李 怡 宋香清
(1 湖北省武汉市江夏区第一人民医院/华中科技大学协和江南医院药剂科,武汉市 430200,电子邮箱:txbpharmacist@163.com;2 湖南省肿瘤医院药学部,长沙市 410013)
目前一、二代头孢菌素(分别以头孢唑啉和头孢呋辛为代表)仍是各类外科手术主要的预防性抗菌药物,在我国的《抗菌药物临床应用指导原则(2015年版)》(以下简称抗菌指导原则)[1]以及美国医院药师学会的《外科手术抗菌药物预防使用临床实践指南》[2]中,其仍受到强烈推荐。基于数十年前循证医学证据,头孢唑啉和头孢呋辛是有效的外科手术预防性抗菌药物,但随着细菌对药物敏感性的持续性变化,如今其并不一定完全有效。在缺乏新的循证医学证据以及在我国目前的微生物敏感性水平下,头孢唑啉和头孢呋辛能否继续作为肝胆外科一线的手术预防性抗菌药物,值得进一步研究探讨。因此,本文将基于药代动力学(pharmacokinetics,PK)/药效动力学(pharmacodynamics,PD)理论,利用蒙特卡洛模拟(Monte Carlo simulation,MCS)对此进行探讨,以期为临床合理用药提供参考。
1 方 法
1.1 肝胆外科预防性抗菌用药的PK/PD靶指数及其数学模型 头孢唑啉和头孢呋辛属于时间依赖型抗生素,反映抗菌疗效的PK/PD靶指数为给药间期游离药物浓度大于最低抑菌浓度的时间(time of the free drug concentration remains above the minimum inhibitory concentration during the dosing interval,fT>MIC)占一个给药间期的百分率(%fT>MIC)。头孢菌素用于抗感染治疗时,%fT>MIC达到50%即可获得较佳疗效[3];但对于严重感染,%fT>MIC甚至%fT>4MIC达到100%才可获得更好的临床疗效及微生物学效果[4-6]。这提示适当提高PK/PD靶指数可提高治疗效果。但头孢菌素用于外科手术预防性抗菌时,%fT>MIC的目标阈值国内外至今没有统一标准[7]。研究表明,足够的抗菌药物浓度水平对外科手术切口感染的预防具有相当重要的作用,并且低药物浓度水平与高感染发生率具有显著相关性[8]。因此,外科手术预防性抗菌可能需要适当提高PK/PD靶指数。
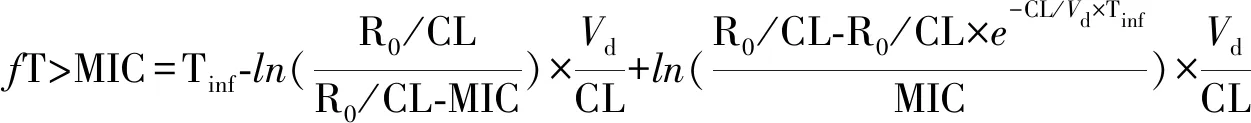
1.2 肝胆外科手术部位感染的可能病原菌及其最低抑菌浓度 根据抗菌指导原则,导致肝胆外科手术术后感染的病原菌主要为革兰阴性杆菌[1]。国内相关研究结果也显示[10-13],导致肝胆外科手术术后感染的病原菌主要为包括大肠埃希菌、肺炎克雷伯菌和铜绿假单胞菌在内的革兰阴性杆菌,以及包括金黄色葡萄球菌和表皮葡萄球菌在内的少部分革兰阳性菌。因此,本研究拟以上述细菌为效果预测的目标菌群。大肠埃希菌和肺炎克雷伯菌的最低抑菌浓度(minimum inhibitory concentration,MIC)分布数据来源于《中国细菌耐药监测研究2015-2016革兰氏阴性菌监测报告》[14],但通过该报告以及国内有关网络资源均无法获取头孢唑啉和头孢呋辛对其他目标菌群的MIC分布数据,故其他目标菌群的MIC参考欧洲药敏试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)数据库中的数据[15]。由于该数据库也并未报告头孢唑啉和头孢呋辛对铜绿假单胞菌的MIC分布数据,故本研究未对此进行讨论。头孢唑啉和头孢呋辛对各目标菌群的MIC分布情况,见表1。

表1 头孢唑啉和头孢呋辛对各目标菌群的MIC分布[n(%)]
注:下划线数据对应的MIC值为敏感性折点,参考EUCAST标准[15]或美国临床和实验室标准协会标准[16]确定。
1.3 抗菌效果模拟 本研究采用MCS(Crystal Ball Professional.软件v7.2.2)对头孢唑啉和头孢呋辛的抗菌预防效果进行模拟,通过计算给药方案的fT>MIC的目标获得概率(probability of target attainment,PTA)和累积反应分数(cumulative fraction of response,CFR),进行效果预测[17]。将药物的PK参数及给药方案的特定值(如给药剂量、输注时间等)整合到fT>MIC模型中,在每个特定的MIC下将获得相应的PTA,各PTA根据公式PTAi×Fi(PTAi是在特定MIC值的中靶估计概率,Fi为在群体菌株中各个MIC分布的相对概率),可获得菌株群体(即具有累积的MIC分布)对预设靶标的期望概率,即CFR。当PTA≥90%时可认为方案对分布在某一特定MIC值的分离菌效果较理想,当CFR≥90%时可认为方案对整个菌株群体(即包含各MIC分布的分离菌)效果较理想。在MCS运行前,设药物的PK参数(如t1/2和CL)服从对数正态分布,f服从均匀分布,目标菌群的MIC服从自定义分布,Tinf为常数,模拟次数为5 000,置信区间为95%。将上述各参数作为变量代入fT>MIC的模型中,分别计算在各变量下fT>MIC的PTA或CFR。头孢唑啉和头孢呋辛的有关PK参数来源于公开发表的文献[18-20]:头孢唑啉t1/2为(1.94±0.26)h,CL为(51.53±12.21)mL/min,f(1-蛋白结合率)为0.15~0.20;头孢呋辛t1/2为(1.19±0.23)h,CL为(178.73±18.76)mL/min,f(1-蛋白结合率)为0.50~0.67。目标菌群的MIC取频率分布值见表1,Tinf取值临床最为常用的0.5 h。
根据美国医院药师学会《外科手术抗菌药物预防使用临床实践指南》[2]关于头孢唑啉和头孢呋辛用于外科手术抗菌预防的推荐剂量,同时考虑到肝胆外科手术的一般时长,本研究分别模拟2 g头孢唑啉和1.5 g头孢呋辛给药后1 h、2 h、3 h、4 h、5 h、6 h内,fT>MIC在MIC分别为≤0.064、0.125、0.25、0.5、1、2、4、8、16、32、64、128、256、>256 μg/mL下的PTA,以及在各目标菌群(具有累积MIC分布的菌群)下的CFR。
2 结 果
2 g头孢唑啉对MIC≤2 μg/mL、MIC=4 μg/mL、MIC=8 μg/mL和MIC=16 μg/mL的分离菌可分别在给药后6 h、5 h、3 h和1 h内达到≥90% PTA,但对MIC>16 μg/mL的分离菌无法在给药后1 h内达到≥90% PTA。1.5 g头孢呋辛对MIC≤0.5 μg/mL、MIC=1 μg/mL、MIC=2 μg/mL、MIC=4 μg/mL、MIC=8 μg/mL和MIC=16 μg/mL的分离菌可分别在给药后6 h、5 h、4 h、3 h、2 h和1 h内达到≥90% PTA,但对MIC>16 μg/mL的分离菌无法在给药后1 h内达到≥90% PTA。对具有累积MIC分布的各目标菌群,2 g头孢唑啉对金黄色葡萄球菌和表皮葡萄球菌能分别在给药后6 h和1 h内达到≥90% CFR,1.5 g头孢呋辛对金黄色葡萄球菌和表皮葡萄球菌仅分别在给药后3 h和2 h内达到≥90% CFR,两药对其他目标菌群在给药后6 h内的任意时间均无法达到≥90% CFR。见表2和表3。

表2 头孢唑啉和头孢呋辛给药后fT>MIC对各MIC的PTA(%)
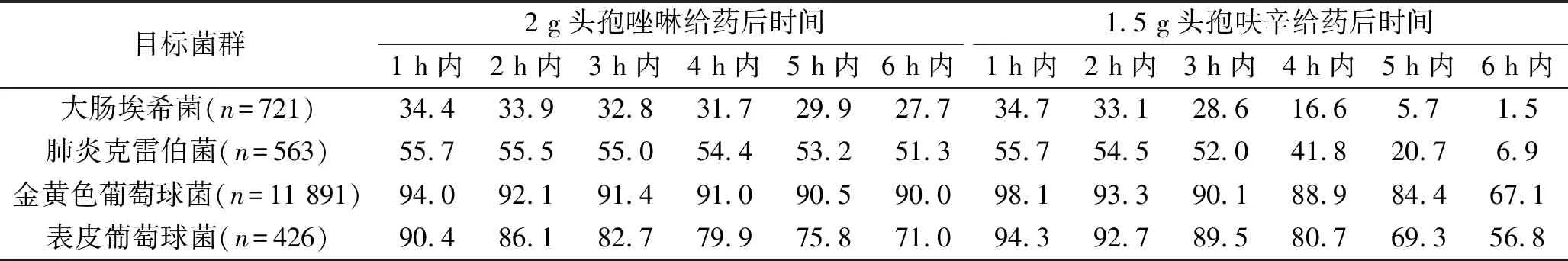
表3 fT>MIC对具有累积MIC分布的各目标菌群的CFR(%)
3 讨 论
随着细菌对抗菌药物的敏感性变化,部分作为一线预防方案的抗菌药物的预防效能可能会下降。已有研究证实,头孢西丁对胃肠外科手术术后感染的预防效果下降[21]。因此,随着细菌对头孢唑啉和头孢呋辛的敏感性变化,两药能否继续作为肝胆外科手术预防性抗菌的一线方案,目前国内外少有研究,也缺乏新的循证医学证据。借鉴文献[21]的研究方法,本研究利用MCS对头孢唑啉和头孢呋辛预防肝胆外科手术术后感染的效果作了理论评估,结果显示,2 g头孢唑啉对MIC≤2 μg/mL、MIC=4 μg/mL、MIC=8 μg/mL和MIC=16 μg/mL的分离菌可分别在给药后6 h、5 h、3 h和1 h内达到≥90% PTA,但对MIC>16 μg/mL的分离菌无法在给药后1 h内达到≥90% PTA。这提示目前头孢唑啉仍可用于且较适宜用于MIC≤8 μg/mL的分离菌为污染菌的肝胆外科手术的抗菌预防,对于MIC≤2 μg/mL的污染菌,如手术时间<6 h,术前使用一剂即可;对于MIC为4 μg/mL的污染菌,如手术时间<5 h,术前使用一剂即可,否则术中需追加抗生素;对于MIC为8 μg/mL的污染菌,当手术时间<3 h,术前使用一剂也可,否则术中需追加抗生素;当污染菌的MIC≥16 μg/mL,头孢唑啉或因术中频繁给药(对MIC为16 μg/mL的污染菌,术中需1 h给药1次)或因达不到理想的PK/PD暴露(对MIC>16 μg/mL的分离菌无法在给药后1 h内达到≥90% PTA),不宜作为肝胆外科手术的抗菌预防。此外,1.5 g头孢呋辛对MIC≤0.5 μg/mL、MIC=1 μg/mL、MIC=2 μg/mL、MIC=4 μg/mL、MIC=8 μg/mL和MIC=16 μg/mL的分离菌,可分别在给药后6 h、5 h、4 h、3 h、2 h和1 h内达到≥90% PTA,但对MIC>16 μg/mL的分离菌无法在给药后1 h内达到≥90% PTA。这提示目前头孢呋辛仍可用于且较适宜用于MIC≤4 μg/mL的分离菌为污染菌的肝胆外科手术的抗菌预防。但与头孢唑啉不同的是,头孢呋辛对于MIC≤0.5 μg/mL的污染菌,如手术时间<6 h,则术前使用一剂即可;对MIC分别为1、2和4 μg/mL的分离菌,可分别对历时为5 h、4 h和3 h内的手术,术前使用一剂即可,超过上述历时则需术中追加抗生素;对MIC≥8 μg/mL的分离菌,头孢呋辛或因术中频繁给药(对于MIC为8 μg/mL的污染菌,术中需2 h给药1次;对于MIC为16 μg/mL的污染菌,术中需1 h给药1次)或因达不到理想的PK/PD暴露(对MIC>16 μg/mL的分离菌无法在给药后1 h内达到≥90% PTA),不宜作为肝胆外科手术的抗菌预防。但在临床实践中,很少能够掌握抗菌药物对分离菌的具体MIC值,特别是用于外科手术抗菌预防时,因此无法根据分离菌的具体MIC值确定抗菌药物的选择及具体的预防方案。此时,可根据目标菌群在本院或本地区的累积MIC分布作MCS指导经验用药。
本研究结果显示,对于具有累积MIC分布的各目标菌群,2 g头孢唑啉对金黄色葡萄球菌和表皮葡萄球菌能分别在给药后6 h和1 h内达到≥90% CFR,1.5 g头孢呋辛对金黄色葡萄球菌和表皮葡萄球菌仅分别在给药后3 h和2 h内达到≥90% CFR,两药对其他目标菌群在给药后6 h内的任意时间均无法达到≥90% CFR。这提示头孢唑啉和头孢呋辛均较适宜用于以金黄色葡萄球菌为污染菌的肝胆外科手术的抗菌预防,均不宜用于以大肠埃希菌和肺炎克雷伯菌等革兰阴性杆菌为污染菌的抗菌预防,与有关研究结果[22]相似。这两种药物对革兰阴性杆菌的效果较差(CFR更低),可能与目标菌群对两药的敏感性特征有关。由表1可知,头孢唑啉对大肠埃希菌和肺炎克雷伯菌的敏感率(以≤MIC敏感性折点的菌株频率分布计,下同)仅为34.26%(247/721)和55.6%(313/563),头孢呋辛仅为32.18%(232/721)和53.82%(303/563),而两药对金黄色葡萄球菌的敏感率高达88.93%(17 120/19 252)和89.31%(10 620/11 891),这不仅反映了目前大肠埃希菌和肺炎克雷伯菌对头孢唑啉和头孢呋辛的耐药率高,也在一定程度上解释了这两种药物对上述目标菌群效果不理想的原因。此外,头孢唑啉经验用于以金黄色葡萄球菌为污染菌的肝胆外科手术预防性抗感染时,如手术历时<6 h,术前使用一剂即可;而使用头孢呋辛时,如手术历时<3 h,术前使用一剂也可,否则术中需追加抗生素,这与抗菌指导原则(2015年版)相符。
但目前有临床研究结果显示,头孢唑啉和头孢呋辛用于预防肝、胆外科手术部位感染效果不佳。Zhou等[23]对在厦门大学第一附属医院进行择期选择性肝切除术的120例患者进行研究后发现,与安慰剂组相比,治疗组在切皮前30 min静脉使用1.5 g头孢呋辛并未有效减少术后感染发生率,并且两组感染部位分布相似,因此认为选择性肝切除术术前抗生素(头孢呋辛)常规预防是没有必要的,并不会降低术后感染并发症的风险。但该研究并未提供导致切口部位感染的病原学数据,如导致术后感染的病原菌为革兰阴性杆菌,则上述研究结果与本文相似。2018年波士顿的一家医疗研究中心对80例发生肝胆外科手术部位感染的患者进行了分析,结果显示导致切口部位感染的最常见细菌是肠球菌属、大肠埃希氏菌和肠杆菌,而且这些微生物多呈多药耐药,对包括头孢唑啉在内的标准预防方案并不敏感[24]。这进一步证实了头孢唑啉预防以上述细菌为污染菌的肝、胆外科手术部位感染无效的结论,与本研究以大肠埃希菌等革兰阴性杆菌为目标菌群的模拟结果相似。
本研究从理论上证实了在目前的细菌耐药性水平下,头孢唑啉与头孢呋辛可能并不宜于继续作为用于以革兰阴性杆菌为主要污染菌的肝胆外科手术抗菌预防的一线方案。但有几点值得注意:(1)本研究以一室模型计算fT>MIC是否合适?研究证实计算给药间期药物浓度大于最低抑菌浓度的时间(T>MIC)时一室模型可近似替代二室模型[25],故即使头孢唑啉和头孢呋辛体内过程符合二室模型,仍可选取一室模型对fT>MIC进行估算。(2)本研究直接计算fT>MIC而非%fT>MIC在不同时间点对目标菌群的PTA和CFR,这是因为目前国内外并未相对统一头孢菌素用于外科手术抗菌预防的%fT>MIC的目标阈值,同时可直观了解fT>MIC在不同时间点对目标菌群的PTA和CFR,方便探讨在不同%fT>MIC目标阈值下的给药间隔(%fT>MIC改变的只是给药间隔)。例如头孢呋辛对金黄色葡萄球菌,fT>MIC在给药后3 h内达到≥90% CFR,如以100%fT>MIC为其PK/PD靶值,其追加间隔应为3 h,如以50%fT>MIC为其PK/PD靶值,其追加间隔可延长至6 h。(3)不同区域的目标菌群分离菌株的MIC分布情况可能稍有差别,因此所获效果与本结果也可能不尽相同,在临床实践中还应采用本区域的细菌耐药监测数据进行效果预测。尽管如此,依据本研究中目标菌群的MIC分布数据(实际为全国数据)得到的模拟结果仍具有一定的普遍代表意义。

