PLCγ1 在小鼠卵母细胞减数分裂恢复中的作用
郝肖琼,贾方毅,付旭阳
(1.包头医学院生理学教研室,内蒙古 包头 014040;2.中国农业大学生物学院农业生物技术国家重点实验室,北京 100094)
哺乳动物的卵母细胞从胚胎时期起就被阻滞在减数分裂I 前期的双线期,卵泡壁层颗粒细胞产生的C 型钠肽(NPPC)结合其鸟苷酸环化酶受体2(NPR2),产生的cGMP 是维持减数分裂阻滞的关键因子[1],青春期来临后,下丘脑产生促黄体激素(LH)峰,通过促进颗粒细胞中EGF 样生长因子的表达[2],转激活卵丘细胞中的EGF 受体(EGFR),从而诱导卵母细胞恢复减数分裂[3]。
前期的研究表明,LH-EGFR 信号升高卵丘细胞内的钙离子水平,高水平的钙离子降低NPR2 与NPPC 的亲和性,使NPR2 失活,cGMP 水平下降,最终导致减数分裂的恢复[4],因此,卵丘细胞内高浓度的钙离子是卵母细胞减数分裂恢复的关键所在,但卵丘细胞内钙离子水平究竟是怎样升高的,目前还不清楚。
激活磷脂酶C(PLC)启动磷脂酰肌醇信号通路,产生的1,4,5-三磷酸肌醇(IP3)能够升高胞内钙离子水平。 PLC 家族具有多种同工酶,目前已发现 六 大 类: PLCβ、 PLCγ、 PLCδ、 PLCε、 PLCζ 和PLCη,共13 种亚型[5]。 PLC 广泛分布于机体的各组织中,对机体多种生理活动做出了重要的调控。其中,生长因子受体可引起PLCγ1 的活化[6],产生IP3导致胞内钙离子释放,另外,PLCγ1 还参与细胞增殖、分化、受体内吞、细胞运动等活动[7-8]。
内质网IP3R 钙库释放升高了胞内钙离子水平[9-10],这一过程可通过激活PLCγ1 产生IP3实现。IP3R 基因家族编码三种同源IP3结合蛋白,形成三种亚型[11]:IP3R1、IP3R2 以及IP3R3,受体在不同组织中存在不同的表达多样性,在卵巢中的表达情况目前尚未有报道。
本文主要探究了LH-EGFR 信号通过PLCγ1 促进卵母细胞减数分裂的恢复,以及下游分子IP3R1的作用。
1 材料和方法
1.1 实验动物
实验所用21~23 d(12~14 g) SPF 级C57BL/6J 雌性小鼠(200 只)购于中科院遗传所实验动物中心[SCXK (京) 2015-0019],本研究经包头医学院实验动物伦理委员会批准(包院字20180901),实验动物房[SYXK (京) 2015-0028]:22℃~24℃恒温,12 h/12 h 光照/黑暗交替,自由采食饮水,按实验动物使用的3R 原则给予人道关怀。
1.2 主要试剂与仪器
孕马血清(PMSG, 浙江宁波激素厂);NPPC、EGF、milrinone、U73122、牛血清白蛋白(Sigma 公司,美国);LH(Sigma 公司,美国);Fluo 3-AM(日本同仁化学研究所);MEMα 粉末状培养基(Gibco 公司,美国);RNA 提取试剂盒、RNA 反转录试剂盒(Qiagen 公司,美国);TransStart Green qPCR SuperMix(全式金公司);cGMP 检测试剂盒(Cayman 公司,美国);免疫组化试剂盒、DAB 显色试剂盒(北京中杉金桥生物技术有限公司);蛋白质浓缩胶缓冲液、分离胶缓冲液、30%丙烯酰胺-甲叉双丙烯酰胺溶液、5×SDS 上样缓冲液(北京康为世纪生物科技有限公司);TEMED(Amresco 公司,美国);高灵敏度化学发光显色液、PVDF 膜(Millipore 公司,美国);IP3R1 抗体由中国科学院动物研究所唐铁山研究员惠赠。
体视显微镜、石蜡切片机(Lecia 公司,德国);A1激光共聚焦扫描显微镜(Nikon 公司,日本);Realtime PCR 仪(Appiled Biosystems 公司,美国);电泳仪、电泳槽(Bio-Rad 公司,美国);化学发光成像系统(北京原平皓生物技术有限公司);细胞培养膜(Millipore 公司,美国)。
1.3 实验方法
1.3.1 卵丘卵母细胞复合物(COCs)的分离及培养
小鼠腹腔注射PMSG 5 IU/只,44 ~46 h 后处死取卵巢,卵巢放置在预先平衡好的MEMα 液(含1 μmol/L milrinone 抑制卵母细胞成熟)中,用1 mL 注射器刺破卵泡,捡取形态良好、卵丘细胞包裹均匀的COCs,COCs 培养于含有30 nmol/L NPPC 的MEMα 液中,添加10 ng/mL EGF 以及40 μmol/L U73122;进行U73122 的剂量依赖性实验研究时,培养液中含有30 nmol/L NPPC、10 ng/mL EGF 以及不同剂量的U73122,此外,U73122(40 μmol/L)对减数分裂自发恢复的影响也做了研究。 COCs 于37℃,5% CO2,95%湿度的培养箱培养,4 h 后,脱去卵丘细胞,观察卵母细胞发生GVBD 的比率。 每次实验每组使用30 枚COCs。
1.3.2 卵泡的分离及培养
卵巢取自注射PMSG 44~46 h 的小鼠,用1 mL注射器分离卵泡(直径300 ~400 μm),将分离好的卵泡放置在0.44 μm 孔径的细胞培养膜上,培养膜悬浮放置在35 mm 细胞培养皿中(添加1.5 mL MEMα 液),MEMα 液添加或者不添加1 μg/mL LH以及40 μM U73122;于37℃,5% CO2,95%湿度的培养箱培养,4 h 后,刺破卵泡,脱去卵丘细胞,观察卵母细胞发生GVBD 的比率。 每次实验每组使用20 枚卵泡。
1.3.3 卵丘细胞内钙离子水平的检测
COCs 取自注射PMSG 44~46 h 的小鼠卵巢,培养于MEMα 液中,MEMα 液含有30 nmol/L NPPC,添加10 ng/mL EGF 以及40 μmol/L U73122,于37℃,5% CO2,95%湿度的培养箱培养2 h,之后PBS 清洗3 次,加入5 μmol/L 钙离子荧光探针Fluo 3-AM 孵育20 min,之后PBS 清洗3 次,在A1 激光共聚焦显微镜下观察细胞内钙离子水平,绿色荧光表示胞内钙离子水平,荧光强度代表胞内钙离子水平相对值。 每次实验每组使用15 枚COCs。
1.3.4 Real-time PCR
细胞样品取自注射PMSG 44 ~46 h 的小鼠卵巢,PBS 清洗,总RNA 的提取依照RNeasy micro-RNA isolation kit 操作指南进行,总RNA 的反转依照QuantiTek 反转录体系进行,得到cDNA。 在ABI 7500 Real-time PCR 系统下进行反应,每个样品重复3 次,所有实验重复3 次。 实验所用引物由英潍捷基(上海)贸易有限公司合成,引物序列见表1。
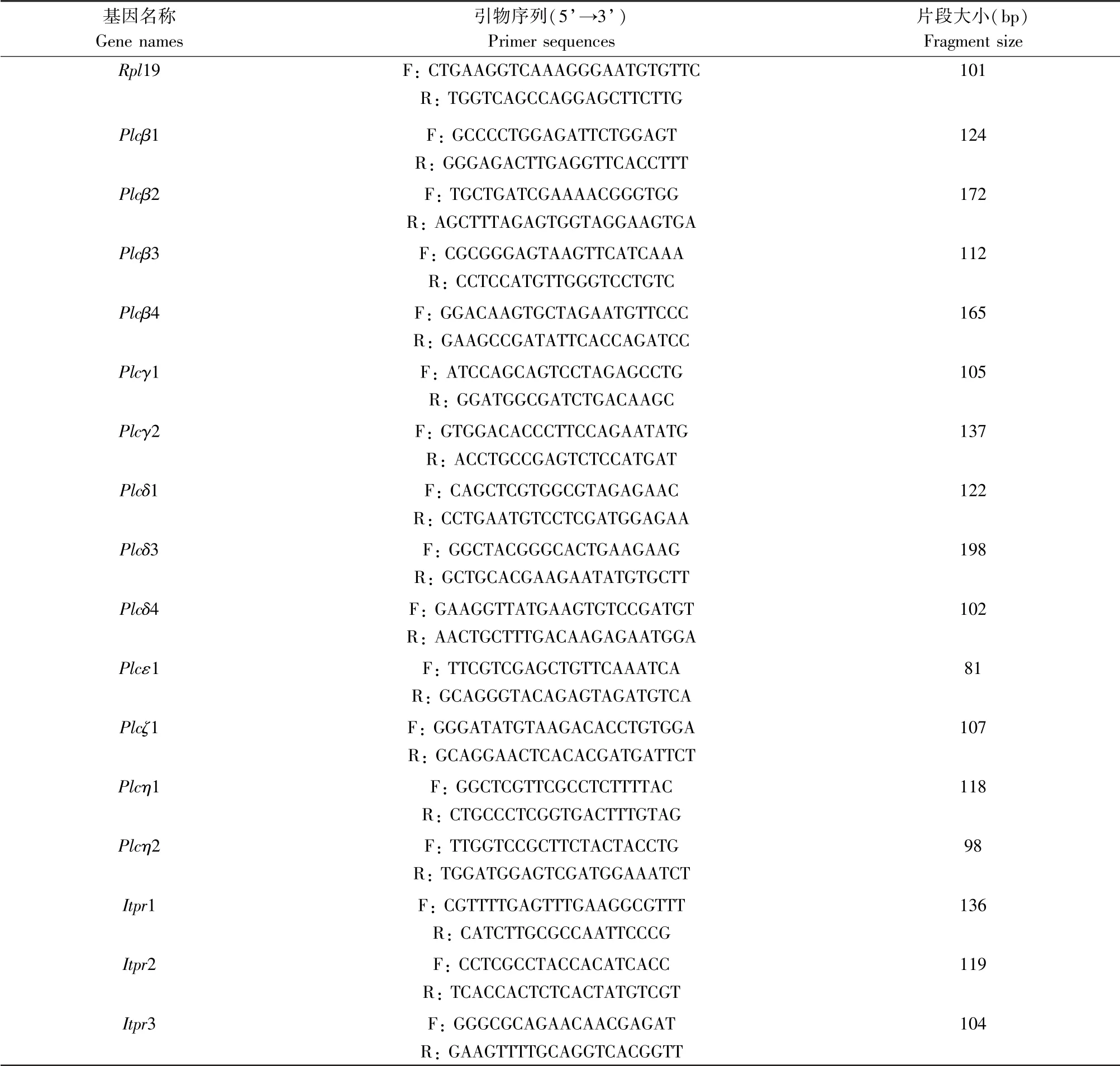
表1 Realtime-PCR 引物序列Table 1 Gene primer sequences
1.3.5 Western blot
颗粒细胞、卵丘细胞与裸卵均取自注射PMSG 44~46 h 的小鼠卵巢,加入细胞裂解液进行细胞裂解,BCA 试剂盒检测蛋白浓度,之后加入1×SDS 上样缓冲液,沸水煮10 min;将处理好的样品加入凝胶中,进行凝胶电泳(5%浓缩胶,60 V,40 min,10%分离胶,100 V,1.5 h),之后采用湿法转膜(100 V,1 h);含有5%奶粉的TBST 封闭2 h,一抗孵育4℃过夜;二抗孵育1 h,使用化学发光成像系统曝光。
1.3.6 免疫组织化学
小鼠腹腔注射PMSG 44 ~46 h 后取卵巢,置于4%多聚甲醛中固定48 h,酒精脱水、石蜡包埋、连续切片(组织厚度5 μm),用柠檬酸缓冲液进行抗原热修复:微波炉高火4 min,低火3×4 min,然后按免疫组化试剂盒的说明进行染色、DAB 显色、苏木精复染,封片观察。
1.3.7 细胞内cGMP 水平检测
COCs 取自注射PMSG 44~46 h 的小鼠卵巢,放置于MEMα 培养液中(每组需100 枚COCs)培养2 h,MEMα 液含有30 nmol/L NPPC,添加10 ng/mL EGF 以及40 μmol/L U73122,PBS 清洗后收集各组COCs,cGMP 含量依据cGMP 酶联免疫试剂盒中提供的方法进行检测。
1.4 统计学分析
所有的实验均重复至少3 次,并使用来自不同小鼠的样本进行。 用Sigma plot 13.0 软件进行统计学分析,数据类型采用方差分析(ANOVA)和t 检验,实验数据以平均数±标准误差(± s)表示,P<0.05 为有显著性差异。
2 实验结果
2.1 PLC 不同亚型mRNA 在颗粒细胞与卵丘细胞内的表达情况
激活PLC 启动磷脂酰肌醇信号通路,使胞内钙离子水平升高,PLC 有多种亚型,我们检测了不同亚型在颗粒细胞与卵丘细胞中的表达情况。 结果表明,小鼠注射PMSG 44~46 h 后,卵泡壁层颗粒细胞中Plcγ1 mRNA 的表达水平远远高于其它亚型(P<0.05) (图1A),这种现象同样出现在卵丘细胞中,卵丘细胞中Plcγ1 mRNA 的表达水平显著高于其它亚型(P <0.05) (图1B),这些结果提示PLCγ1 在减数分裂恢复中可能发挥主要作用。
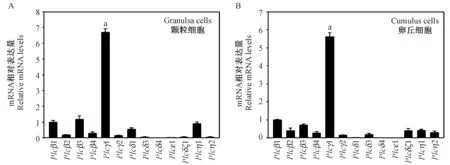
图1 PLC 不同亚型mRNA 在颗粒细胞与卵丘细胞中的表达情况Figure 1 The mRNA expression levels of PLC isoforms in granulosa cells and cumulus cells
2.2 PLCγ1 抑制剂U73122 抑制EGF 诱导的卵母细胞减数分裂恢复
注射PMSG 44~46 h 的小鼠卵泡颗粒细胞与卵丘细胞中Plcγ1 mRNA 的表达水平最高,因此PLCγ1 可能主要参与了卵母细胞减数分裂恢复的过程。 进一步研究发现添加PLCγ1 特异的抑制剂U73122 可显著抑制EGF 诱导的卵母细胞减数分裂恢复(P <0.05) (图2A),卵母细胞成熟率仅为(47.87±2.16)%,远低于对照组(90.53±0.86)%,且U73122 的抑制效果呈剂量依赖性(图2B),这些结果表明PLCγ1 在EGF 诱导的卵母细胞减数分裂恢复中发挥重要作用。
2.3 PLCγ1 抑制剂U73122 抑制EGF 诱导的卵丘细胞内钙离子水平升高
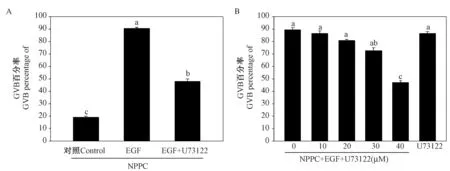
图2 PLCγ1 抑制剂U73122 对EGF 诱导的卵母细胞减数分裂恢复的影响Figure 2 The effect of U73122 on EGF-induced meiotic resumption
卵丘细胞内钙离子水平的升高是EGF 促进减数分裂恢复的关键[4,12],本研究提示PLCγ1 参与了EGF 诱导的卵母细胞减数分裂恢复,EGF 可能通过PLCγ1 启动磷脂酰肌醇信号通路,使卵丘细胞内钙离子水平升高。 因此,同时检测抑制PLCγ1 对卵丘细胞内钙离子水平的影响。 与之前的研究结果相同[4],对照组卵丘细胞内钙离子荧光强度(绿色荧光)十分微弱(图3A),添加EGF 后显著增加了胞内钙离子荧光水平(图3A),然而,PLCγ1 的抑制剂U73122 可明显逆转EGF 介导的胞内钙离子水平增加(P <0.05) (图3A),荧光强度同样也显著下降(P <0.05) (图3B),这表明EGF 确实通过PLCγ1升高了卵丘细胞内的钙离子水平,抑制PLCγ1 的作用则导致胞内钙离子水平无法升高。
2.4 PLCγ1 抑制剂U73122 逆转EGF 介导的胞内cGMP 水平下降
卵丘细胞内钙离子水平升高可使NPR2 失活,cGMP 水平下降,导致减数分裂恢复[4]。 cGMP 水平的变化代表了NPR2 鸟苷酸环化酶活性的变化,本研究检测了U73122 对COCs 内cGMP 水平的影响。结果表明,对照组添加NPPC 处理细胞,胞内cGMP水平上升,而EGF 显著降低了胞内cGMP 水平(图4),与之前的报道一致[1],添加U73122 显著逆转EGF 介导的胞内cGMP 水平下降(P <0.05) (图4),这说明EGF 通过PLCγ1 升高了细胞内的钙离子水平,高水平的钙离子可降低NPR2 活性,导致cGMP 水平下降。
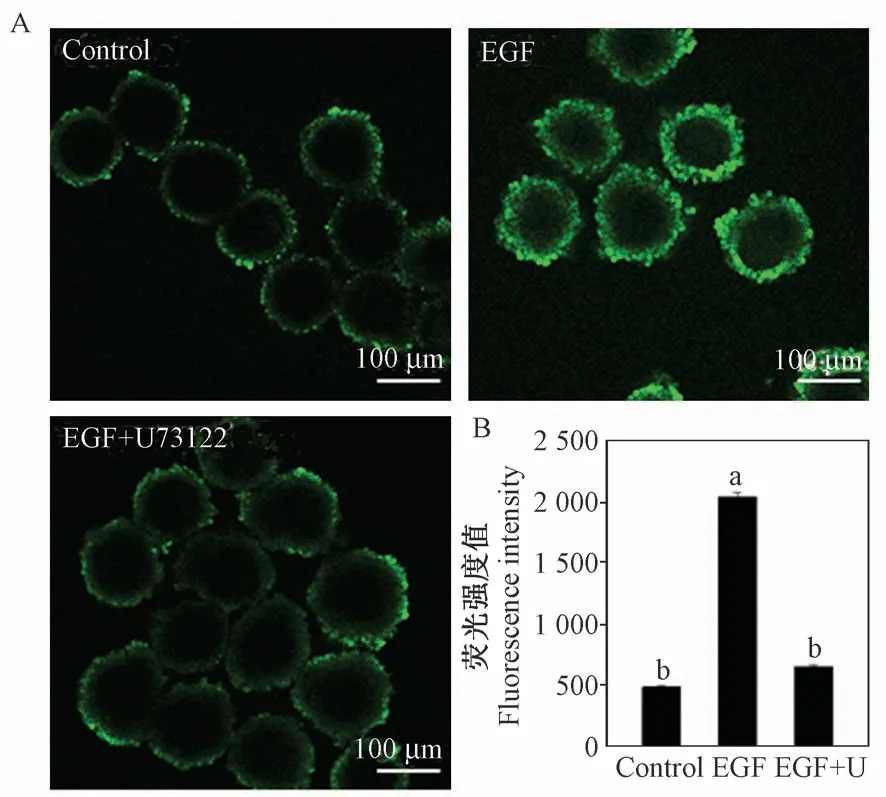
图3 PLCγ1 抑制剂U73122 对卵丘细胞内钙离子水平的影响Figure 3 Effect of U73122 on EGF-mediated calcium elevation
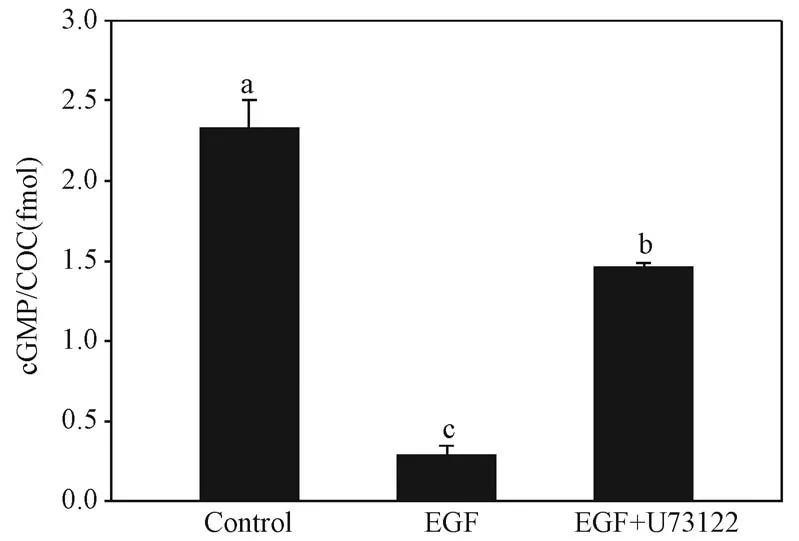
图4 U73122 对COCs 内cGMP 水平的影响Figure 4 Effects of U73122 on cGMP levels in COCs
2.5 PLCγ1 抑制剂U73122 抑制LH 诱导的卵母细胞减数分裂恢复
根据上述研究结果,本研究进一步采用卵泡培养模型模拟体内状态,研究U73122 对LH 诱导的减数分裂恢复的作用。 结果显示,添加LH 诱导了减数分裂的恢复,而U73122 明显抑制LH 诱导的减数分裂恢复(P <0.05) (图5),卵母细胞的成熟率仅为(46.98±1.43)%,LH 是通过激活卵丘细胞内的EGF 受体发挥作用的[3],因此,这些结果说明LH/EGFR 信号通过PLCγ1 升高卵丘细胞内的钙离子水平,使NPR2 失活,cGMP 水平下降,最终导致卵母细胞恢复减数分裂。
2.6 IP3R 不同亚型mRNA 在颗粒细胞、卵丘细胞与卵母细胞中的表达情况
PLCγ1 的下游分子IP3R,IP3R 具有三种亚型IP3R1、IP3R2 以及IP3R3,其相应基因为Itpr1、Itpr2以及Itpr3。 本研究发现,注射了PMSG 44 ~46 h 的小鼠卵泡颗粒细胞、卵丘细胞与卵母细胞中,Itpr1 mRNA 的表达水平均显著高于其它两种亚型(P <0.05) (图6A、6B 和6C),提示三种亚型中IP3R1发挥主要作用。
2.7 IP3R1 在颗粒细胞、卵丘细胞与卵母细胞中的表达定位
Western blot 结果表明,IP3R1 在颗粒细胞、卵丘细胞与卵母细胞中都有表达(图7A),免疫组织化学的结果同样显示IP3R1 在三种细胞中均有表达(图7B),这说明IP3R1 在PLCγ1 升高胞内钙离子水平的过程中发挥作用。

图5 U73122 对LH 诱导卵母细胞减数分裂恢复中的影响Figure 5 The effect of U73122 on LH-induced meiotic resumption
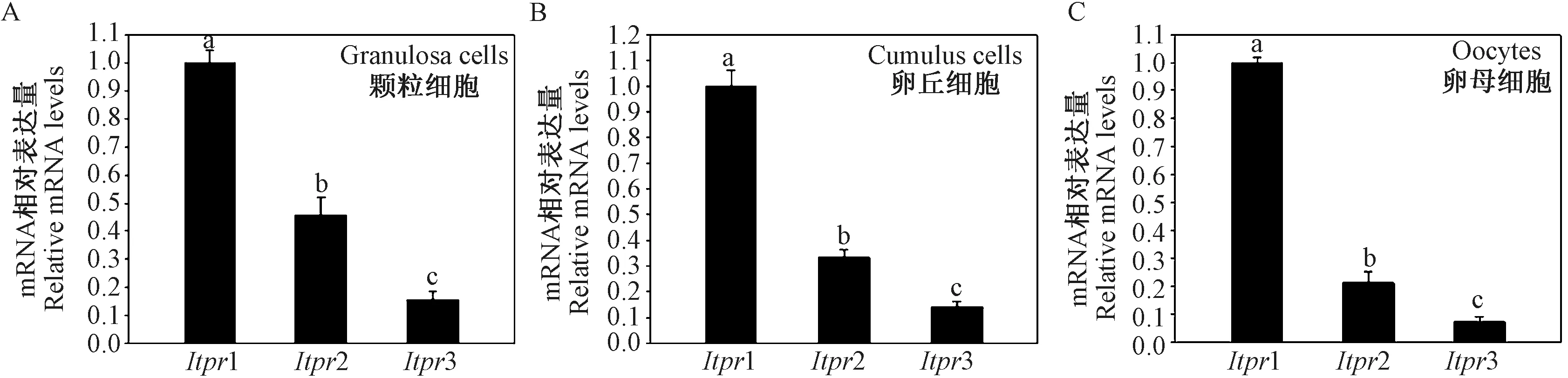
图6 IP3R 不同亚型mRNA 在颗粒细胞、卵丘细胞与卵母细胞中的表达情况Figure 6 The mRNA expression levels of IP3R isoforms in granulosa cells, cumulus cells and oocytes

图7 IP3R1 在颗粒细胞、卵丘细胞与卵母细胞中的表达情况Figure 7 The expression of IP3R1 protein in granulosa cells, cumulus cells and oocytes
3 讨论
卵泡壁层颗粒细胞表达的NPPC,可与卵丘细胞中的受体NPR2 结合,产生的cGMP 是维持卵母细胞减数分裂阻滞的关键因子[1],前期研究表明,LH-EGFR 信号升高了卵丘细胞内的钙离子水平,使NPR2 与NPPC 的亲和性下降,导致NPR2 失活,cGMP 水平下降,最终诱导卵母细胞减数分裂的恢复[4]。 卵丘细胞内高水平的钙离子决定着减数分裂恢复的进程,而胞内高浓度的钙离子是由内质网钙库动员导致的[4]。 本研究发现,LH/EGFR 信号通过PLCγ1 与IP3R1 升高了卵丘细胞内的钙离子水平,导致NPR2 失活与减数分裂恢复。
内源性的PLC 是调控多种信号转导的关键分子,PLC 具有多种亚型,其中,Plcγ1 mRNA 的表达水平在颗粒细胞与卵丘细胞中是多种亚型中最高的,且远远高于其它亚型,PLCγ1 特异的抑制剂U73122 能够显著抑制EGF 诱导的卵母细胞减数分裂恢复,新霉素(PLC 抑制剂)可抑制体外培养的牛和猪卵母细胞减数分裂的恢复[13],这些结果说明PLC 可能在这一过程中发挥作用。 本研究进一步证明是PLCγ1 参与了减数分裂恢复的进程。 EGFR信号与PLCγ 的活化相耦联[14-15],而本研究表明EGFR 信号通过PLCγ1 诱导减数分裂恢复,也间接证明了这一点。
前期的研究表明,EGF 诱导卵母细胞减数分裂恢复的核心是升高了卵丘细胞内的钙离子水平,使NPR2 失活[4,12],而激活PLCγ1 即产生IP3,升高胞内钙离子水平。 本研究发现U73122 可以显著抑制胞内钙离子水平的增加,同时,U73122 也可以逆转EGF 介导的胞内cGMP 水平下降。 结合前期研究结果,PLC 信号与钙离子信号以EGFR 的胞内区为靶点[16],本研究进一步阐明了激活EGFR 通过PLCγ1/钙离子导致NPR2 失活与减数分裂恢复。
LH 本质上是通过激活EGFR 发挥作用的,本研究发现U73122 显著抑制了LH 诱导的卵母细胞减数分裂恢复,说明PLCγ1 在LH/EGFR 信号诱导减数分裂恢复中发挥重要作用。 有研究表明,PLCγ1在小鼠胚胎中广泛表达,敲除小鼠PLCγ1 后,小鼠胚胎发育受到损伤[17],这可能是因为敲除PLCγ1影响卵子的正常发育。
激活PLC 产生的IP3是IP3R 钙库唯一的门控分子[18-19],而LH/EGFR 通过PLCγ1 导致的卵丘细胞内钙离子水平升高需要IP3R 钙库的作用,IP3R具有3 种亚型,研究结果发现Itpr1 mRNA 的表达水平在三种亚型中最高,另外,免疫组化与Western blot 均显示IP3R1 在颗粒细胞、卵丘细胞与卵母细胞中表达,IP3R1 钙库被动员后释放钙离子,导致胞内钙离子水平升高,使NPR2 失活,本研究发现IP3R1 在颗粒细胞中的表达丰度也比较高,可能是除了NPR2 主要在卵丘细胞外,也表达于颗粒细胞[20]。 上述结果综合提示PLCγ1 通过IP3R1 升高卵丘细胞内钙离子水平,但IP3R1 究竟通过怎样的机制调控卵丘细胞内钙离子水平还需要进一步研究。
综上所述,本研究证实了LH/EGFR 信号通过PLCγ1-IP3R1 通路升高卵丘细胞内钙离子水平,使NPR2 失活,cGMP 水平下降,诱导卵母细胞减数分裂恢复。
致谢感谢中国农业大学生物学院张美佳教授提供实验场所,感谢张美佳教授在论文写作过程中给予的指导,感谢中国科学院动物研究所唐铁山教授赠予抗体。

