高效液相色谱-荧光法测定谷物及其制品中苯并(α)芘的不确定度评定
黄坤,郭嘉
(1.湖北省食品质量安全监督检验研究院,湖北省食品质量安全检测工程技术研究中心,湖北武汉430075;2.武汉工程大学绿色化工过程教育部重点实验室,湖北武汉430205)
苯并(α)芘(benzo(α)pyrene,BaP)是一种含有5 个环的稠环芳烃化合物,由有机化合物在高温条件下发生聚合反应而产生,具有强烈的致癌、致畸、致突变作用[1-2],因其污染引发的食源性疾病较为常见和广泛[3]。工业三废排放产生的苯并(α)芘通过空气、水、土壤等进入农作物体内进行富集[4],粮食烘干和晾晒过程也因与含有苯并(α)芘的烟道气、沥青路面接触而受到污染[5],作为日常生活的主要粮食消费品谷物及其制品,也因此类生产过程和环境污染等原因面临着苯并(α)芘的污染,因此在分析测试过程中有效评定苯并(α)芘测量结果的质量显得尤为重要。我国GB 2715-2016《食品安全国家标准粮食》中明确规定谷物及其制品中苯并(α)芘的含量不能超过5.0 μg/kg。目前关于各类食品检测方法的不确定度评定不少[6-8],但谷物及其制品中苯并(α)芘采用分子印迹柱净化、荧光检测的结果不确定度评定基本空缺。为了评估方法的不确定度,本文参考GB 5009.27-2016《食品安全国家标准食品中苯并(α)芘的测定》,以小麦粉为例,对谷物及其制品中苯并(α)芘的测定不确定度进行分析评定,找出影响结果的相关分量,在实际操作中可据此对相关环节进行重点控制,从而提高提高检测结果的可靠性和准确性,同时为其他产品中苯并(α)芘测定结果的不确定度评定提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
谷物及其制品(包括大米、小麦粉、玉米渣等):产自湖北云梦;乙腈、正己烷、二氯甲烷(色谱纯):美国Thermo Fisher Scientific 公司;苯并(α)芘标准品(纯度为98.8%):德国Dr.Ehrenstorfer 公司。
1.1.2 仪器
Waters e2695 高效液相色谱仪(Waters e2695 Sep arations Module,2475 FLR Detector):美国Waters 公司;Phenomenex Luna C18色谱柱(4.6 mm×150 mm,5 μm):美国菲罗门公司;XS204 型精密天平:梅特勒-托利多仪器上海有限公司;Talboys 数显型涡旋混合器:美国Troemner 公司;分子印迹固相萃取柱(500 mg,6 mL):天津博纳艾杰尔科技有限公司。
1.2 试验方法
1.2.1 样品的处理
准确称取已粉碎混匀的样品1 g 左右(精确至0.000 1 g),置于15 mL 离心管中,加入10 mL 正己烷,涡旋混合0.5 min 使试样完全分散,超声提取10 min。高速离心后将上清液加入已活化好的分子印迹固相萃取柱,待液面降至柱床时,用6 mL 正己烷淋洗,弃去流出液。用6 mL 二氯甲烷分两次洗脱并收集净化液至离心管中,于40 ℃下氮吹至干,准确移取1 mL 乙腈涡旋复溶0.5 min,过0.22 μm 微孔滤膜,续滤液供液相色谱分析。
1.2.2 色谱条件
Phenomenex Luna C18色谱柱(4.6 mm×150 mm,5 μm);柱温35 ℃;流动相:A 为乙腈,B 为水,流速1.0 mL/min;等度洗脱:洗脱程序85%A,洗脱20 min;检测器:荧光检测器,激发波长365 nm,发射波长410 nm;进样量20 μL。
1.2.3 标准溶液的配制
准确称取14.6 mg 苯并(α)芘标准品(纯度为98.8%),用乙腈超声溶解并定容至100 mL,即得浓度为144 μg/mL 的苯并(α)芘标准储备溶液。用1 mL 单标线吸量管(A 级)吸取标准储备溶液1 mL 于100 mL单标线容量瓶(A 级)中,用乙腈定容至刻度,混匀,即得浓度为1.44 μg/mL 的标准中间储备溶液;再用5 mL分度吸量管吸取标准中间储备液2.5 mL 于100 mL 单标线容量瓶(A 级)中,用乙腈定容至刻度,混匀,即得浓度为36.0 ng/mL 的标准使用溶液。
用1 mL 单标线吸量管(A 级)吸取标准使用溶液(36.0 ng/mL)1 mL 于10 mL 单标线容量瓶(A 级)中,用乙腈定容至刻度,摇匀,即得3.6 ng/mL 的标准工作溶液;用2 mL 单标线吸量管(A 级)吸取标准使用溶液2 mL 于10 mL 单标线容量瓶(A 级)中,用乙腈定容至刻度,摇匀,即得7.2 ng/mL 的标准工作溶液;用5 mL分度吸量管(A 级)分别吸取标准使用溶液3、4、5 mL于10 mL 单标线容量瓶(A 级)中,用乙腈定容至刻度,摇匀,分别得到10.8、14.4、18.0 ng/mL 的标准工作溶液;用10 mL 分度吸量管(A 级)吸取标准使用溶液8 mL 于10 mL 单标线容量瓶(A 级)中,用乙腈定容至刻度,摇匀,即得28.8 ng/mL 的标准工作溶液;直接将标准使用溶液作为36.0 ng/mL 的标准工作溶液。分别取以上7 种不同浓度的系列标准工作溶液各进样2 次进行液相色谱分析,以系列标准溶液的浓度C 为横坐标、色谱峰面积Y 为纵坐标,采用最小二乘法进行拟合得到标准工作曲线和线性回归方程Y=A1C+A2(A1为斜率,A2为截距)。
1.2.4 重复测定与加标回收试验
取同一阳性样品,按1.2.1 下项方法、1.2.2 项下条件对苯并(α)芘的含量进行6 次重复测定,取其平均值作为最终结果;取同一阴性样品,按3.6 μg/kg 的水平进行加标回收试验,测定9 次,计算平均回收率。
1.3 数学模型的建立
谷物及其制品中苯并(α)芘的含量计算公式如下:

式中:X 为谷物及其制品中苯并(α)芘的含量(重复测定6 次,取平均值作为最终结果),μg/kg;C 为从标准工作曲线计算得到的样品溶液中苯并(α)芘的浓度,ng/mL;V 为样品复溶的定容体积,mL;m 为样品的称样质量为回收率校正因子。
2 结果与分析
2.1 不确定度来源分析
从1.3 项下计算公式结合实际测定过程可知,苯并(α)芘测定结果不确定度urel(X)的主要来源包括:(1)样品溶液浓度引入的不确定度urel(C);(2)样品最终定容引入的不确定度urel(V);(3)样品称量引入的不确定度urel(m);(4)测量重复性产生的不确定度urel(x);(5)测量回收率产生的相对标准不确定度urel(R)。
2.2 不确定度的评定
2.2.1 样品溶液浓度引入的相对标准不确定度urel(C)
样品溶液浓度的不确定度来源于标准溶液配制产生的不确定度和标准工作曲线拟合产生的不确定度两部分。标准溶液配制包括储备液的配制、储备液的稀释和标准工作曲线制备3 个过程。
2.2.1.1 标准储备溶液的配制引入的相对标准不确定度urel(C1)
由1.2.3 项下的配制过程可知不确定度来源主要有以下3 个方面:
(a)标准品纯度引入的相对标准不确定度urel(C1a)根据标准品证书可知,苯并(α)芘标准品的纯度误差为±0.5%,按照均匀分布,则由纯度引入的不确定度为:
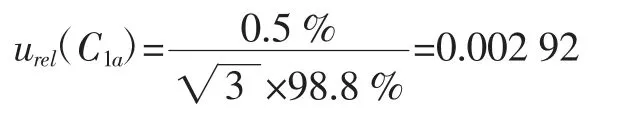
(b)标准品称量引入的相对标准不确定度urel(C1b)由2.2.3 项下处理可知由称量引入的不确定度为:

(c)标准储备溶液定容引入的相对标准不确定度urel(C1c)按照JJG 196-2006《常用玻璃量器》规定,20 ℃时100 mLA 级单标容量瓶容量允差为±0.10 mL,按矩形分布计算,其标准不确定度为参照2.2.2 项下处理,定容过程中100 mL 容量瓶由于环境温度变化产生的标准不确定度为0.158 20 mL。则标准储备溶液定容引入的相对标准不确定度为:

综上所述,标准储备溶液的配制引入的相对标准不确定度为:
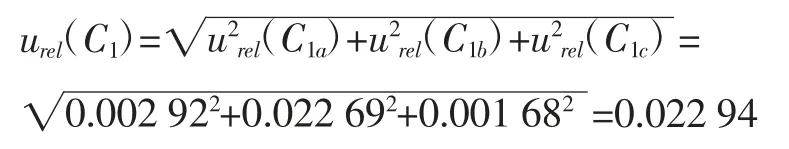
2.2.1.2 标准储备溶液的稀释引入的相对标准不确定度urel(C2)
根据1.2.3 项下的稀释过程,按均匀分布处理,相关器具及温度波动引入的不确定度见表1。
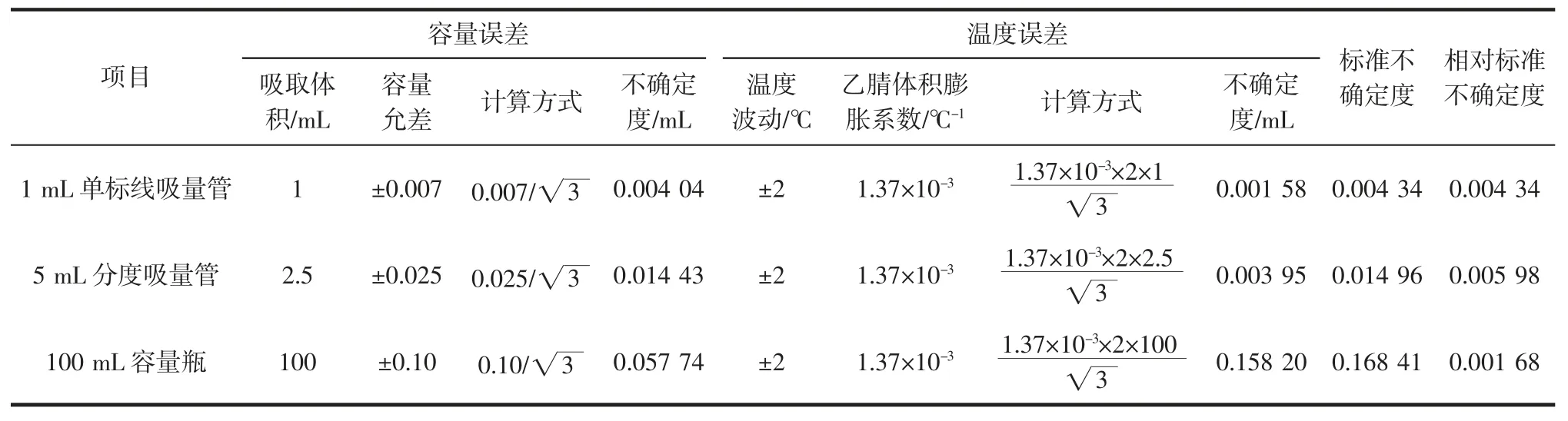
表1 标准储备溶液稀释过程引入的不确定度Table 1 Uncertainty resulting from dilution of standard stock solution
因此,由标准储备溶液稀释过程引入的相对标准不确定度为:

2.2.1.3 标准工作曲线制备过程引入的相对标准不确定度urel(C3)
由1.2.3 项下的制备过程可知由吸量管、容量瓶及温度波动引入的不确定度见表2。
因此,由标准工作曲线配制过程引入的相对标准不确定度为:


表2 标准工作曲线制备过程引入的不确定度Table 2 Uncertainty resulting from preparation of standard curve
2.2.1.4 标准工作曲线拟合引入的相对标准不确定度urel(C4)
根据1.2.3 项下的方法处理,测定数据及拟合结果如表3 所示。

表3 标准工作曲线结果Table 3 Results of standard curve
取一阳性样品重复测定6 次,将其峰面积代入线性回归方程计算测定浓度,然后根据1.3 项下的公式计算含量,其测定结果见表3(测定液平均浓度C0为3.750 ng/mL)。则由标准工作曲线拟合所引入的标准不确定度为:

式中:SR为标准溶液峰面积残差的标准差,计算公式如下为标准工作曲线的斜率73 493;p 为对C0的测定次数,p=6;n 为标准工作溶液测试次数,本试验中7 个浓度各测定2 次为标准系列溶液的平均浓度,822。因此由标准工作曲线拟合所引入的相对标准不确定度为
综上所述,由样品溶液浓度引入的相对标准不确定度为:
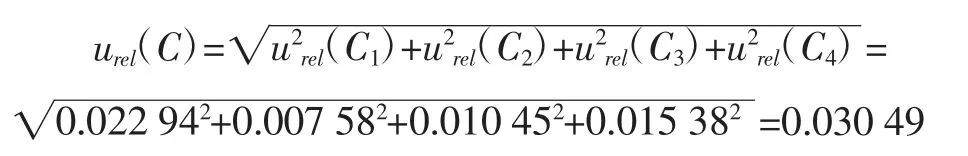
2.2.2 样品最终定容体积引入的相对标准不确定度urel(V)
样品最终定容采用1 mL 移液器,其引入的不确定度来源于其校准和环境温度变化两部分。按照校准证书给出的扩展不确定度U=0.04 μL(k=2),可知由校准引入的标准不确定度试验过程中虽有中央空调控温,但由于各种原因环境温度很难保证在20 ℃一成不变,设定室温在(20±2)℃之间波动。已知乙腈的体积膨胀系数为1.37×10-3/℃,按照矩形分布考虑则移液过程中由于环境温度变化产生的标准不确定度0.001 58 mL。
综上所述样品最终定容1 mL 引入的相对标准不确定度为:
2.2.3 样品称样质量引入的相对标准不确定度urel(m)
样品称量的不确定度主要来源于称量的重复性和天平校准。天平校准的不确定度与其灵敏度和线性相关,因称量在较窄的范围内进行,灵敏度可以忽略不计。
1)称量重复性引入的不确定度u1(m)由天平的校准证书得到扩展不确定度U=0.32 mg(k=2),转化为标准不确定度为
2)天平校准引入的不确定度由天平的说明书得到其线性误差为±0.000 5 g,服从矩形分布,转化为标准不确定度为
试验中样品的平均称样量为1.002 7 g,因此由样品称量引入的相对标准不确定度为:

2.2.4 测量重复性产生的相对标准不确定度
按照1.2.4 项下的方法测定,重复性的试验结果见表4。

表4 重复性试验结果Table 4 Results of repeatability test
根据JJF 1059.1-2012《测量不确定度评定与表示》规定,试验结果为正态分布,采用极差法可知单次测定的标准差则标准不确定度因此由测量重复性引入的相对标准不确定度为:
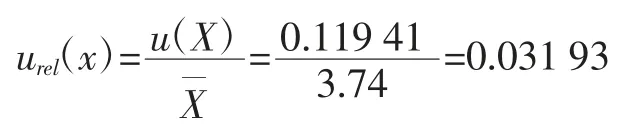
2.2.5 测量回收率产生的相对标准不确定度
按照1.2.4 项下的方法测定,回收率(R)的结果分别为92.14 %、90.51 %、96.03 %、93.85 %、94.71 %、93.68%、91.69%、93.55%、96.46% (平均回收率=93.62%),应用贝塞尔公式可知单次测定回收率的标准偏差则标准不确定度因此由测量重复性引入的相对标准不确定度为:

为了确定回收率是否计入苯并(α)芘含量的计算中,对平均回收率与1.0 进行显著性检验说明与1.0 具有高度显著性差异,因此在计算公式中必须采用回收率校正因子对结果进行修正。
2.3 合成相对标准不确定度
样品溶液的浓度、定容体积、样品称样量以及测量重复性等不确定度分量相互独立,各相对标准不确定度分量的数值及其贡献见图1,将上述不确定度进行合成,得到合成相对标准不确定度,如下所示:
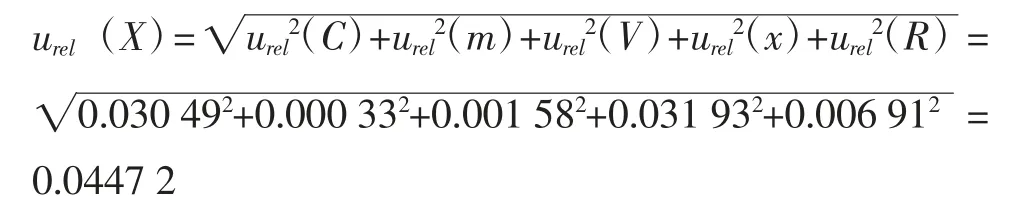
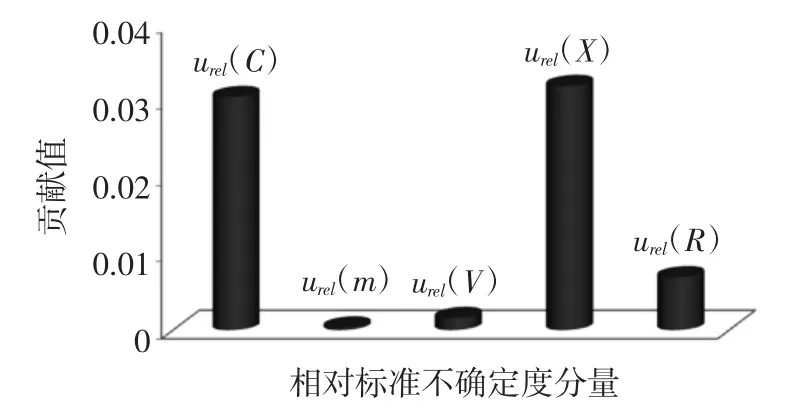
图1 相对标准不确定度分量及其贡献Fig.1 Relative standard uncertainty components and their contributions
2.4 扩展不确定度
依据JJF 1135-2005《化学分析测量不确定度评定》,取包含因子k=2(置信概率p≈95%)衡量,则扩展不确定度为:

3 测量结果及其不确定度报告
用高效液相色谱-荧光法测定谷物及其制品中的苯并(α)芘,测定结果报告如下:
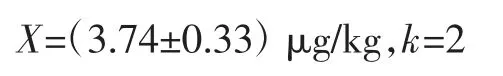
由测量结果可知依据GB 5009.27-2016《食品安全国家标准食品中苯并(α)芘的测定》采用正己烷提取、分子印迹固相萃取净化、高效液相色谱-荧光法测定谷物及其制品中苯并(α)芘的不确定度较小,测量结果具有较高的可信度和准确度,能够满足日常检测的质量控制要求。
4 结论
试验过程中,称量、定容、稀释、仪器测定等操作过程都会引入不确定度,从本文不确定度的分析和计算过程可以发现,影响谷物及其制品中苯并(α)芘测定结果不确定度的因素主要为测量重复性、样品溶液浓度和测量回收率,其次为样品最终定容体积和样品称样质量。其中样品溶液浓度因素中贡献较大的分量是标准储备溶液的配制、标准工作曲线的拟合和制备。因此在实际检测过程中要严格控制溶液配制和测量操作,尤其要注意标准溶液相关操作过程的规范性和一致性,以及平行样品的测定问题,定期对所涉仪器进行检定和提高实验人员的操作能力,以此减小测量不确定度,从而保证检测结果的准确度和可信度。

