抗噬菌体P2的植物乳杆菌突变菌株的筛选及其吸附特性研究
柴诗语,郭静,孟根其其格,马瑞瑞,陈霞
(内蒙古农业大学乳品生物技术与工程教育部重点实验室,农业部奶制品加工重点实验室,内蒙古呼和浩特010018)
植物乳杆菌(Lactobacillus plantarum)与人类生活密切相关,是一种常见于奶油、肉类中的乳酸菌,可定植在肠道发挥有益作用,在现代食品工业中可广泛应用,常做为制作发酵乳制品中的发酵剂[1-2]。自从Whitehead 和Cox 等发现导致某些乳制品发酵失败是由于发酵剂感染噬菌体病毒,发酵乳制品行业就试图寻找持久的解决方案来控制噬菌体污染问题[4]。烈性噬菌体是一类能侵染且致死细菌的病毒,其生活周期包括吸附、注入、复制、装配、释放[3]。吸附是噬菌体侵染宿主菌的第一步。噬菌体颗粒与宿主细胞表面碰撞,通过特异性识别其受体并与之紧密结合,使吸附发生[3]。植物乳杆菌细胞壁具有典型的革兰氏阳性菌结构,其受体成分可能为细胞壁上的多糖成分,包括磷壁酸、多层肽聚糖以及糖蛋白以及其他不同功能蛋白质[5]。一般采用基因诱导或自发突变等方法来获取抗性菌株,但基因诱导会存在抗性菌株遗传特性不稳定等缺点。而自然环境中,乳酸菌会自我形成抗噬菌体防御机制,来抵抗环境中的噬菌体污染。宿主菌可通过改变噬菌体受体来阻止噬菌体吸附,如受体表达下调和空间阻遏,受体突变和丢失等[6-7]。所以采用模拟极端环境驯化敏感菌,使其快速生成抗性,以此替代敏感株作为发酵用菌是较为安全又稳定的方法。
本试验在含有噬菌体P2 环境中使敏感植物乳杆菌L.plantarum IMAU10120 自发突变,以获得稳定遗传的抗噬菌体突变株。通过对比两者的吸附率,判断突变株的吸附受体是否发生改变,并分析不同生理状态对噬菌体吸附能力的影响,研究噬菌体P2 的吸附受体。为培育抗性工程菌提供一定的理论基础和数据支持,以降低工业生产环境中噬菌体污染的威胁,增加相关产品的稳定性。
1 材料与方法
1.1 材料与仪器
1.1.1 敏感株及噬菌体
敏感株植物乳杆菌L.plantarum IMAU10120:分离自内蒙古巴彦淖尔市乌拉特中旗草原上牧民家庭的自然发酵酸牛乳样品,由内蒙古农业大学乳品生物技术与工程教育部重点实验室提供;乳杆菌烈性噬菌体P2:分离自L.plantarum IMAU10120 的异常发酵液中,属长尾噬菌体[8]。
1.1.2 试剂
牛肉膏、植物蛋白胨、葡萄糖、乙酸钠、酵母粉、柠檬酸钠、MgSO4、MnSO4、Tween-80、KH2PO4、Na2HPO4、CaCl2、NaCl、琼脂、十二烷基硫酸钠(均为分析纯):呼和浩特泽浩生物科技有限公司。
1.1.3 仪器
ZHJH-C1112 型无菌工作台:上海智诚分析仪器制造有限公司;CP2202C 电子天平:上海奥豪斯仪器上海有限公司;EP pendorf 5810R 型高速台式离心机:德国Hambury 公司;SP-650 型全自动干热灭菌锅:上海DVANTEC 立敏事业有限公司;HA-300MIII 型全自动高压蒸汽灭菌器:日本HIRAYAMA 公司;雷磁PHSJ-3FpH 计:上海精密科学仪器有限公司;AL204 型分析天平:梅特勒-托利多仪器(上海)有限公司;EYELAWF0-700 型恒温干燥箱:上海爱鹏仪器有限公司;HWS28型电热恒温水浴锅:上海-恒科学仪器有限公司。
1.2 方法
1.2.1 活化敏感菌
将保存的L.plantarum IMAU10120 按2%的接种量接种于20 mL 复原豆乳中,37 ℃培养24 h,凝乳后第二代再按2%的量接种于MRS 液体培养基,37 ℃静置培养24 h,传至3 代,置于4 ℃冰箱保存。
1.2.2 纯化噬菌体
将2%L.plantarum IMAU10120 接种于5 mL MRS液体培养基中后加入CaCl2使其终浓度达10 mmol/L,37 ℃培养至OD600≈0.5 后按感染复数(multiplicity of infection,MOI)为0.5 加入噬菌体P2 裂解液,37 ℃培养3 h~4 h 直至菌液澄清。9 230 r/min 离心5 min 去除沉淀,收集上清液经0.22 μm 无菌滤膜过滤去除剩余菌体得到噬菌体悬液,按照双层平板法(上层琼脂0.7%,下层琼脂1.5%)进行噬菌体纯化。将噬菌体裂解液按浓度梯度稀释,对不同稀释梯度的噬菌体裂解液采用双层平板法进行计数,37 ℃培养16 h~18 h,计数噬菌斑,测定效价。所得滤液即为噬菌体原液。放于4 ℃冰箱中储存待用。
1.2.3 次级感染法筛选抗噬菌体菌株
采用次级感染的方法筛选植物乳杆菌自发突变抗噬菌体菌株。具体步骤如下:
1)敏感株按2 %接种量接至MRS-Ca 液体培养基,生长至OD600≈0.5;
2)按最佳感染复数接入噬菌体P2,37 ℃连续培养48 h;
3)将培养出的菌液涂布于MRS 平板之上,37 ℃连续培养48 h;
4)挑取单菌落,接种至MRS 液体培养基,37 ℃连续培养24 h;
5)将选育出的菌液3 次划线培养纯化;
6)将突变株株培养至含有P2 的MRS-Ca 培养基中,观察生长情况。若此条件下,菌株10 d 内传代正常,则判定该菌株为抗噬菌体菌株[9]。
1.2.4 抗噬菌体菌株的形态观察
将L.plantarum IMAU10120 及纯化后的抗噬菌体突变株分别接种于MRS 培养基中活化,多次10 倍稀释后,于MRS 固体培养基培养,37 ℃,连续培养48 h,观察菌落形态。并选取单个菌落于MRS 液体培养基中,37 ℃静置培养至对数期,取少量菌体用于革兰氏染色,莱卡显微镜下观察野生株和突变株间的形态差异。
1.2.5 噬菌体P2 对敏感菌株及突变株的吸附特性测定
根据Quiberoni 和Reinheimer 的试验方法[7],将敏感株与突变株分别以2%的接种量接至MRS-Ca 液体培养基中,37 ℃培养至对数期,然后加入噬菌体P2 按感染复数为0.5。对照组以只加同量噬菌体于无菌的MRS-Ca 液体培养基中,37 ℃,培养30 min。后对照组与试验组的培养液均经9 230 r/min 离心5 min。通过双层培养的方法测定梯度稀释后上清液中未吸附的噬菌体,吸附率可通过对照组与试验组上清液进行双层培养后,噬菌斑之差与对照组噬菌斑的比值计算。
1.2.6 细胞生理状态对吸附的影响
通过测定培养环境中未吸附的噬菌体数来检测活细胞和非活细胞对吸附的影响。将野生株与突变株按2%接种至MRS 液体培养基中37 ℃培养至OD600≈0.5 后,100 ℃沸水10 min 灭活IMAU10120 及突变株,通过平板计数检查其细胞的存活性,获得100%死亡的细胞,进行吸附率检测。对照组为噬菌体P2 吸附活的敏感株与突变株的效果。按感染复数0.5 加入噬菌体P2,放入37 ℃培养箱中培养30 min 后,对照组与试验组的培养液均经9 230 r/min 离心5 min。稀释上清液中未吸附的噬菌体,并通过双层培养的方法测定,空白组为只添加噬菌体的液体培养基,计算吸附率[9]。
1.2.7 植物乳杆菌噬菌体P2 吸附受体测定
1.2.7.1 细胞壁的制备
将普通制备细胞壁方法优化[10]
1)将植物乳杆菌野生株与突变株在MRS 液体培养基中培养,分别生长至OD600为0.5~0.8;
2)将液体4 615 r/min 离心5 min,除去上清液;
3)沉淀用10 mmol/L 的磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH6.8)缓冲溶液洗涤两次并离心(13 523 r/min,10 min);
4)以1 ∶1(体积比)的比例加入玻璃珠(直径为0.10 mm~0.15 mm)。然后将混合物涡旋振荡45 min,在此期间将悬浮液每30 s 在冰浴中冷却;
5)通过莱卡显微镜观察及MRS 平板涂布37 ℃培养的方法,检测菌体的存活情况及细胞破坏的效率;
6)连续4 次沉降(4 ℃,2 h)除去玻璃珠,并收集上清液;
7)5 652 r/min 离心10 min 除去完整的细胞及细胞碎片;
8)13 523 r/min 离心15 min 沉淀细胞壁并重悬于50 mmol/L 的Tris-HCl(pH 7.5)中,用DNA 酶(0.10 mg/mL)和RNA 酶(0.15 mg/mL)处理细胞壁,在37 ℃下作用30 min;
9)13 523 r/min 离心15 min 收集细胞壁,并在磷酸盐缓冲液(phosphate buffer saline,PBS)盐缓冲液中连续重悬浮洗涤10 次;
10)最后通过上述的离心纯化细胞壁,并在20 ℃下储存。
1.2.7.2 细胞壁吸附测试
分别把不同浓度的100 μL 的IMAU10120 野生株及突变株的细胞壁与100 μL 噬菌体P2 裂解液(106pfu/mL)混匀,置于37 ℃培养箱,吸附30 min;13 523 r/min 离心5 min,对上清液中未被吸附的噬菌体数进行检测,计算吸附率,以获得的细胞壁浓度具有最佳吸附率。(以吸附率高于90%的细胞壁浓度为噬菌体吸附的最佳细胞壁浓度)[11]。
1.2.7.3 细胞壁的化学和酶处理
将最佳浓度的突变株与敏感株的细胞壁悬浮液置于50 mmol/L 的Tris-HC(lpH7.5)中。分别与十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(1 %),溶菌酶(50 U/mL)和蛋白酶K(0.10 mg/mL)在37 ℃下处理30 min;三氯乙酸(trichloroacetic acid,TCA)(5%)在100 ℃下处理15 min。处理后的细胞壁用10 mmol/L 的PBS(pH 6.8)缓冲液连续洗涤5 次,13 523 r/min 离心5 min 收集细胞壁。测定处理后细胞壁的噬菌体吸附率,与未处理的细胞壁进行对照[11-12]。
1.3 数据处理
所有的数据菌使用9.1 Origin lab 和Microsoft Excel 2016 数据分析软件进行作图分析。独立试验均重复进行3 次以上。并且使用IBM SPSS Statistics 20 以显著性水平为0.05 进行数据统计分析,P<0.05 为显著,P>0.05 为不显著。
2 结果与分析
2.1 抗噬菌体菌株筛选结果
将保藏的L.plantarum IMAU10120 经3 代活化后,在含有噬菌体P2 的环境下可生长的为自发突变抗噬菌体植物乳杆菌,经3 次划线纯化后获得10 株正常生长的菌株,再经噬菌体富集环境下连续10 d 培养,在MRS 培养基中有8 株菌表现出稳定的遗传抗性,可正常生长。确定具有抗性的植物乳杆菌被称为噬菌体不敏感突变株(bacteriophage-insensitive mutants,BIMs)。选择抗噬菌体能力最强的一株进行研究。菌株在含有噬菌体P2 环境下生长结果见图1。

图1 噬菌体存在条件下强抗噬菌体突变株的生长情况Fig.1 The growth of mutant with strong resistance to phage under phage existence condition
2.2 抗噬菌体菌株形态观察
敏感株与突变株菌落形态见图2。

图2 L.plantarum IMAU10120 及突变株的菌落形态图Fig.2 The colony morphology of L.plantarum IMAU10120 and resistant strain
如图2 所示,IMAU10120 及抗噬菌体菌株的菌落均为凸起、呈圆形、表面光滑、边缘整齐、乳白色。
敏感株与突变株经革兰氏染色后显示的细胞形态见图3。

图3 L.plantarum IMAU10120 及突变株的细胞形态图Fig.3 The cellular morphology of L.plantarum IMAU10120 and resistant strain
如图3 所示,经革兰氏染色,细菌呈蓝紫色,证明野生株与突变株均为革兰氏阳性菌,为直短杆状,单个、成对或呈链状排列。L.plantarum IMAU10120 与其噬菌体突变株的菌落和细胞形态相比较无明显区别。
2.3 植物乳杆菌敏感株与突变株吸附特性比较分析
噬菌体P2 对敏感株与突变株的吸附效果见图4。
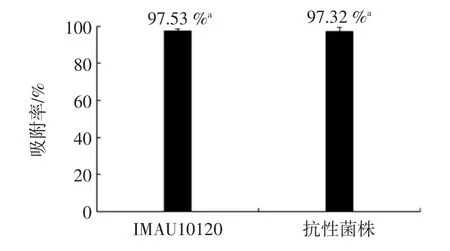
图4 L.plantarum MAU10120 及其噬菌体突变株吸附率Fig.4 The adsorption ratio of L.plantarum IMAU10120 and resistant strain
将L.plantarum IMAU10120 和突变株分别与噬菌体P2 混合在MRS-Ca 液体培养基中,37 ℃培养30 min,比较两者对噬菌体P2 吸附特性的差异,结果如图4所示。噬菌体P2 对敏感菌株和抗噬菌体突变株的吸附率在97%~98%,且无显著差异(P>0.05)。由此可以看出,突变株没有抑制噬菌体吸附的现象,其吸附受体未发生改变。
2.4 细胞生理状态对噬菌体P2 吸附能力的影响
敏感株与突变株在不同生理状态对噬菌体P2 吸附能力影响见图5。

图5 不同生理状态野生株与突变株的吸附率Fig.5 Adsorption rate of sensitive strains and mutants in different physiological states
L.plantarum IMAU10120 与突变株的活菌和非活菌与噬菌体P2 混合经37 ℃培养30 min 后,结果如图5 显示:超过96%的噬菌体在不同生理状态的敏感株与突变株的细胞上孵育30 min 后被吸附。敏感株与突变株的死细胞与活细胞的结果均无明显差异。存活野生株与突变株的吸附率分别为(97.44±0.96)%,(97.60±1.01)%,而死亡菌株的吸附率分别为(97.39±1.09)%和(96.87±0.26)%,无显着差异(P>0.05)。突变株与敏感株的细胞生理状态对于噬菌体P2 吸附功能无明显影响。
2.5 噬菌体P2 吸附受体测定
L.plantarum IMAU10120 细胞经机械破壁破碎后情况见图6。

图6 细胞破壁情况Fig.6 Cell wall breaking
植物乳杆菌为革兰氏阳性菌,细胞壁结构包括磷壁酸、肽聚糖和其他蛋白质,故采用玻璃珠破壁法反复4 次震荡、冰浴、沉降后,将破碎的细胞壁经革兰氏染色。通过图6 所示,观察植物乳杆菌突变株破碎情况,镜下显示无完整形态细胞壁。并通过平板划线法验证,48 h 内无菌落生长,表明突变株均全部死亡。
敏感株与突变株细胞壁经化学及酶法处理后经噬菌体侵染结果见表1。

表1 噬菌体P2 对经不同试剂处理的野生株及突变株细胞壁的吸附率Table 1 The adsorption ratio of wild strain and mutant strain cell wall by chemical and enzyme treatment
将破碎后的细胞壁经化学和酶法处理结果如表1所示,分别用SDS(1%)及蛋白酶K 处理细胞壁后,噬菌体P2 对野生株与突变株的吸附率与空白组相较均无显著差异(P>0.05),吸附率处于93%~97%之间。而溶菌酶处理后则明显降低了本试验中噬菌体的吸附率,野生株的吸附率下降至(81.37±1.88)%,抗性菌株至(83.61±2.20)%。此外,三氯乙酸(5%)作用细胞壁后,噬菌体P2 与菌株的结合能力下降愈加明显,突变株的吸附率下降了约64%,而敏感菌的吸附率仅为11%~12%。
3 讨论
近几年,发酵制品需求量日益增加,噬菌体是减弱发酵剂活性的主要因素之一。筛选出具有抗噬菌体能力的优良菌株对于提高发酵效率,改善产品风味等具有重要的意义。2018 年齐蕊名等通过次级感染法选育出6 株具有稳定抗性的抗噬菌体Lpla 植物乳杆菌突变株[13]。王慕华等通过自然选育法,分离了4 株(St1-4)兼具抗性及较好发酵性的非溶源性抗性菌[14]。国外将菌株的抗噬菌体性作为评价或筛选优良发酵剂菌株的重要标准。2014 年Marco 等对植物乳杆菌(ATCC 8014)自发抗噬菌体(ATCC 8014-B1 和ATCC 8014-B2)突变菌株(M1)的生物学及益生特性进行了研究,突变株与敏感株具有相同的免疫应答[6]。本试验同采用次级感染法,使L.plantarum IMAU10120 突变,获得抗噬菌体P2 突变株。优势是由于自发突变不涉及基因工程改造,具有简单、方便且低廉等特点。可培育出具有较强的遗传稳定性的商业替代株,应用于工业生产[15]。
通常噬菌体吸附在宿主细胞壁上完成初步侵染。本研究检测了抗性产生原因是否有由于受体蛋白缺失导致,结果显示:敏感株与突变株间吸附率无显著性差异,且作用明显。由此可以推断噬菌体抗性的产生并不是由于突变株吸附位点发生改变。
细胞壁提取方法通常包括:低温微纳米破壁技术、机械破壁法、化学渗透法、高压脉冲电场破壁法等[16-18]。本试验利用玻璃珠机械破碎法,该方法简单经济,适用于链球菌、乳杆菌、芽孢杆菌等[19]。但应先排除细胞生理状态这一干扰项。本研究采用100 ℃沸水致死细胞,对比敏感株与突变株的非活与活细胞吸附动力学差异,结果证明细胞生理状态基本不会影响噬菌体P2 的吸附能力。采用相同方法,Quiberoni 等对德氏乳杆菌(YAB、BYM、Ib3 和LL-H)研究时证明,吸附率同样无显著性差异,5 min 内超过98%的在不同生理条件下的细胞被吸附[11]。而德氏乳杆菌(Cb1)则显示出相反结果。可能是细胞经热处理后,噬菌体(Cb1/342)受体位点发生解体或细胞生理状态改变,缺乏细菌能量所致[10]。
自1994 年Valyasevi 发现化学和酶法(十二烷基硫酸钠、溶菌酶、蛋白酶K 和三氯乙酸)处理细胞壁,可应用于受体鉴定以来,该方法逐步得到认可[12]。SDS(1%)可破坏蛋白质分子间的非共价键,除去细胞壁表面蛋白膜组分或与细胞质膜共价结合的蛋白质[10-12]。溶菌酶可水解不溶性粘多糖成为可溶性多肽,包括膜上锚定的脂磷壁酸结构或肽聚糖结构[20]。蛋白酶K 可水解蛋白质中的肽链连接[12]。TCA(5 %)可去除与肽聚糖相关的细胞壁中的可溶性成分(磷壁酸、多糖等)[12]。方伟探究保加利亚乳杆菌受体结果显示,敏感株(KLDS1.1016 和KLDS1.1028)及突变株(BIM08和BIM02)经蛋白酶K、SDS 处理后,噬菌体(phildb)吸附率未发生显著变化。而溶菌酶、TCA 处理后敏感株和突变株的吸附率分别下降了50%~60%及10%~30%。说明噬菌体的吸附受体与肽聚糖连接的细胞壁聚合物相关[9]。同样,Quiberoni 用SDS 和蛋白酶K 作用德氏乳杆菌(YSDY、Ab1、LB-Ib3)与突变株的细胞壁,发现噬菌体(BYM、YAB、Ib3、IB539)的吸附率均无显著降低(P>0.05),TCA 作用后吸附率降低至22%以下,而溶菌酶处理时,吸附率几乎为0。原因可能是由于溶菌酶可溶解肽聚糖,TCA 可提取出革兰氏阳性菌中与肽聚糖相关细胞壁聚合物[7]。结论与本试验结果类似,突变株经SDS、蛋白酶K 处理后,吸附率与空白组相差无异,而经溶菌酶水解后,敏感株与突变株的吸附率分别下降了18.63%和16.39%,TCA 作用后,吸附率分别下降了88.28%,64.76%。由此可推测细菌上由肽聚糖连接的细胞壁聚合物(多糖或磷壁酸)为噬菌体P2 的吸附受体。
由于抗噬菌体菌株产生抑制性的原因有很多种,可因细胞结构改变、代谢途径改变或由于被侵染后自发死亡[6]。孔健等通过克隆并分析乳酸乳球菌中限制和修饰酶基因LlaBIII 发现具有CRISPR 序列的乳酸乳球菌可有效防止噬菌体感染[21]。McGrath 等发现宿主菌乳酸乳球菌亚种c2 中的质粒pNP40 编码的蛋白可阻止φc2 噬菌体DNA 注入[22]。本研究中突变株受体结构未改变,因此抗性机理可能是由于参与DNA 复制、转录、翻译等相关基因及代谢调节等相关基因突变导致的,究其原因可能是:1)具有CRISPR(获得性免疫)系统;2)阻止DNA 注入;3)质粒丢失;4)抑制蛋白质合成等[22-23]。所以未来可探究抗性菌的全基因组序列,从突变基因和代谢通路角度解释其抗性机理。
4 结论
通过次级感染法使敏感株自发突变出1 株具有抗噬菌体P2 的植物乳杆菌突变株。其具有与敏感株无显著性差异的吸附特性,证明受体结构未发生变化。且通过改变生理状态,判断出噬菌体P2 吸附特性不受菌株生理条件影响。且采用化学或酶法处理敏感株与突变株的细胞壁检测出噬菌体的吸附受体可能与磷壁酸或磷壁酸-肽聚糖聚合物有关。知此特性,可为培育抗噬菌体性工程菌提供理论基础和数据支持,以期降低工业生产环境中噬菌体污染的威胁,获得更稳定的相关产品。

