基于DNA酶表面增强拉曼的皮蛋中痕量Pb2+检测方法
庞永丰,罗杨合,2,吴凤莲,2,伍淑婕,聂辉,段振华,2,黎小椿,*
(1.贺州学院食品科学与工程技术研究院,广西贺州542899;2.大连工业大学食品学院,辽宁大连116034)
铅是一种对人体有害的重金属元素。当铅在人体的累积量超过一定量时,就会对人体造成严重损害。同时铅会损害儿童神经系统发育,进而会导致其智能指数下降10 分~20 分[1]。通过调查研究了解到,目前部分耕地受到了重金属的污染[2]。因此,对重金属的检测和预防,并运用一些科学、灵敏、稳定、简便和快速的检测方法对重金属进行定量检测,具有重要的研究意义。
目前,常用于对样品中重金属铅的检测方法分别为:原子荧光法[3]、原子吸收分光光度法[4]、电感耦合等离子体质谱法[5]、激光诱导击穿光谱法[6]、双硫腙比色法[7]以及表面增强拉曼散射光谱法(surface-enhanced Raman spectroscopy,SERS)[8]。其中,原子荧光法的优点是检出限相对较低,灵敏度较高,共存物质的干扰较小,对重金属检测的线性范围较宽,可以同时对多种元素进行检测;缺点是在对样品检测过程中,会产生荧光淬灭效应以及散射光等问题的干扰。原子吸收分光光度法的优点是选择性高,干扰少,灵敏度高,准确度高;缺点是不能对多元素同时分析,对难熔元素测定的灵敏度不高。电感耦合等离子体质谱法的优点是对样品中的物质测定较为准确、快速,且灵敏度较高,共存物质的干扰较小;缺点是对于电离电位高的元素灵敏度低。激光诱导击穿光谱法的优点是可以远程和实时对元素进行在线检测,并且可以进行多元素同时检测;缺点是检测较慢,不能对元素进行准确的定量分析。双硫腙比色法优点是操作简便、快速和稳定性好;缺点是双硫腙的添加量不易控制,造成误差较大。与上述其它方法相比较,SERS 法具有操作简便、检测快速、灵敏度高、分析准确等优点,是一种理想的重金属检测新方法。Mark S.Frost 等[9]成功地证明了SERS方法是一种检测在水介质中Pb2+的高灵敏度方法。试验结果表明,SERS 具有高灵敏度(LOD25 ng/L),在很宽的线性范围内(25 ng/L~1 000 ng/L)Pb2+离子可以准确地被检测出来。所以建立精确SERS 法定量分析重金属铅具有重要研究意义。
SERS 法常被用于重金属离子的分析与检测[10-12]。其主要原因是SERS 技术可以提供化学和生物分子结构方面的指纹信息,同时也可以对痕量物质进行检测。近年来,基于DNA 酶裂解反应SERS 法检测分析物非常受研究人员的关注,因为其可以用于提高对物质检测的灵敏度、选择性以及检测速度[13-15]。Wang 等[16]通过试验探究,建立了一种测定Pb2+的DNA 酶传感器SERS 探针的新方法,其原理是当体系中加入Pb2+后,Pb2+可切割DNA 的底物链使得纳米金共轭物与金基底分离,使得拉曼信号变弱。且在一定Pb2+的浓度范围内,Pb2+的浓度与SERS 信号强度的变化,呈现良好的线性关系,从而可对Pb2+进行痕量分析检测。但目前对于Pb2+的SERS 定量分析方法相对较少,基于DNA 酶裂解反应与银纳米粒子、罗丹明6G(rhodamine 6G,Rh6G)结合并应用于对重金属Pb2+的SERS 定量检测分析方法尚未见报道。
研究发现,将SERS 与适配体和DNA 酶相结合,有助于对痕量物质更好地进行检测分析。因此,本文以性质稳定的液相银纳米溶胶为基底,建立痕量重金属铅离子的DNA 酶SERS 定量分析新技术,并用于皮蛋中痕量重金属铅离子的检测分析,既具有科学的理论技术创新,同时又具有良好的应用前景。
1 材料与方法
1.1 主要仪器
633 nm DXR smart 智能拉曼光谱仪:美国赛默飞世尔公司,激光为633 nm,功率为3.0 mW,采集时间为10 s;MR Hei-Tec 加热型磁力搅拌器:德祥科技有限公司;Evolution300 型紫外可见分光光度计:美国热电(上海)科技仪器有限公司;F-4600 荧光分光光度计:日立高新技术公司;WX-8000 微波消解仪:上海屹尧仪器科技发展有限公司;XMTD-8222 恒温水浴锅:上海精宏实验设备有限公司;1524R 高速离心机:珠海黑马医学仪器有限公司;扫描电镜(scanning electronic microscope,SEM):日本日立公司。
1.2 主要试剂
AgNO3(分析纯):广东光华科技股份有限公司;NaBH4(分析纯):天津市光复精细化工研究所;NaCl(分析纯)/HCl(36%~38%)/10 g/L 柠檬酸三钠:汕头西陇化工厂有限公司;5.23×10-5mol/L 罗丹明6G(Rh6G):美国MERCK 公司;三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钠(disodium ethylenediamine tetraacetic acid,EDTANa2):成都市科龙化工试剂厂。
混合溶液:依次加入3.72 mL 0.2 mol/L EDTANa2、5 mL 2 mol/L NaCl、0.5 mL 0.2 mol/L Tris,混匀后定容到16 mL,以EDTANa2计算其浓度为4.65×10-2mol/L。
pH 7.2 的Tris-HCl 缓冲液:依次加入5.0 mL 0.2 mol/L Tris、9.0 mL 0.1 mol/L HCl,混合均匀后定容到20 mL。
1.3 双链DNA(dsDNA)的制备
在15 mL 的比色管中,依次加入0.5 mL 0.144 μmol/L的ssDNA、0.5 mL 0.144 μmol/L 的Taq 酶、360 μL 2 mol/L的NaCl、1.45 mL pH 7.2 的Tris-HCl、5.19 mL 的超纯水,混匀后于80 ℃水浴锅中水浴加热15 min。水浴完毕取出,将其自然冷却1.5 h,然后保存于4 ℃冰箱。
1.4 银纳米粒子溶液制备
量取40.0 mL 超纯水于100 mL 锥形瓶中,用磁力搅拌器搅拌(500 r/min),依次加入3.5 mL 10 g/L 柠檬酸三钠溶液和0.385 mL 2.4×10-2mol/L AgNO3,搅拌混匀后,逐滴缓慢滴加4.0 mL 0.5 g/L NaBH4,溶液颜色从浅黄色→深黄色→黄色,继续搅拌反应15 min 后,定容于50 mL 棕色容量瓶,得到19.9 mg/L 银纳米粒子(AgNPs)溶液,于4 ℃冰箱保存。
1.5 皮蛋消解液的制备
微波消解皮蛋:称量1.242 0 g 的皮蛋加入到微波消解罐中,然后依次加入5 mL 的浓硝酸和2 mL 30%的过氧化氢,将微波消解仪的温度设定为100 ℃,压力分别为3、6、9atm,微波功率分别为1000、1000、2000W。加热时间分别设定为5、7、5 min,进行微波消解,然后进行加热赶酸,再将加热后的溶液定容到25 mL 棕色容量瓶中。量取2 mL 皮蛋微波消解液,进行高速离心,取上清液,过滤,然后取1 mL 皮蛋消解滤液样品稀释20 倍,得2.484 mg/mL 皮蛋消解液。
1.6 试验方法
在5 mL 刻度试管中,依次加入120 μL 9 nmol/L dsDNA 溶液,一定量的Pb2+溶液,混匀25 ℃下静置8 min后加入10 μL 4.65×10-2mol/L 混合溶液,混匀后加入400 μL 19.9 mg/L 银纳米粒子溶液,摇匀后加入70 μL 5.23×10-5mol/L 的Rh6G 溶液,定容至2.0 mL。取反应液于石英皿中,然后将其过测定613 cm-1处的SERS峰强度I,不加Pb2+做空白为I0,计算ΔI=I-I0。
1.7 试验原理
在pH 7.2 的Tris-HCl 缓冲液和0.09 mol/L NaCl介质中,单链DNA(ssDNA)和DNA 酶在80 ℃条件下,杂交成双链DNA(dsDNA)。在dsDNA 和混合溶液存在下,AgNPs 发生聚集,聚集的AgNPs 与Rh6G 相互作用,在613 cm-1处出现较强的SERS 特征峰。Pb2+可将dsDNA 裂解切割,释放出ssDNA,形成比表面积和粗糙度均增大的AgNPs-ssDNA-Pb2+大分子缔合物。随着Pb2+浓度的增大,释放出的ssDNA 增多,形成的Ag-NPs-ssDNA-Pb2+增多,AgNPs-ssDNA-Pb2+与Rh6G 作用增强,导致613 cm-1处的SERS 峰强度增大。
2 结果与讨论
2.1 SERS 光谱
Pb2+-dsDNA-AgNPs 体系的SERS 光谱见图1。

图1 Pb2+-dsDNA-AgNPs 体系的SERS 光谱Fig.1 Raman scattering Spectra of Pb2+-dsDNA-AgNPs system
当无Pb2+存在时,dsDNA 不能保护AgNPs 在混合溶液存在下发生聚集,聚集的AgNPs 与Rh6G 结合较弱,在613 cm-1拉曼位移处出现SERS 特征峰。当加入Pb2+,形成比表面积和粗糙度均增大的AgNPs-ssDNAPb2+大分子缔合物,AgNPs-ssDNA-Pb2+与Rh6G 结合,在613 cm-1处有较强的SERS 峰。随着Pb2+浓度的增大,613cm-1处的SERS 峰线性增强,故本文选择613 cm-1处进行测定,结果见图2。

图2 Pb2+-dsDNA-AgNPs 体系的SERS 光谱Fig.2 Raman scattering Spectra of Pb2+-dsDNA-AgNPs system
2.2 吸收光谱
紫外-可见吸收测纳米银图见图3,Pb2+-dsDNAAgNPs 体系的吸收光谱图见图4。

图3 紫外-可见吸收测纳米银图Fig.3 Ultraviolet absorption determination of silver nanoparticle

图4 Pb2+-dsDNA-AgNPs 体系的吸收光谱图Fig.4 Absorption spectra of Pb2+-dsDNA-AgNPs system
球形AgNPs 溶胶呈黄色,由图3 可知其吸收峰主要在394 nm。AgNPs 溶胶聚集后呈灰蓝色,Rh6G 溶液呈橙红色,图4 中530 nm 处的吸收峰是AgNPs 聚集体与Rh6G 作用的结果。在Pb2+存在的条件下,Pb2+可裂解切割dsDNA,释放ssDNA,形成比表面积和粗糙度均增大的高褶皱度叶子状AgNPs-ssDNA-Pb2+大分子缔合物。随着Pb2+浓度增加,形成的AgNPs-ssDNAPb2+缔合物增多,AgNPs 聚集体减少,AgNPs-ssDNAPb2+与Rh6G 作用增强,体系中AgNPs 聚集体的灰蓝色减少而Rh6G 的橙红色增强,故530 nm 的吸收峰增强。此结果与SERS 光谱一致。
2.3 共振散射光谱
Pb2+-dsDNA-AgNPs 体系的共振散射光谱如图5所示。

图5 Pb2+-dsDNA-AgNPs 体系的共振散射光谱图Fig.5 Resonance scattering spectra of Pb2+-dsDNA-AgNPs system
在dsDNA 和混合溶液存在下,AgNPs 发生聚集,在545 nm 处有一个较强的共振散射光谱峰。当加入Pb2+后,Pb2+可裂解切割dsDNA,释放ssDNA,ssDNA 吸附在AgNPs 表面,形成比表面积和粗糙度均增大的高褶皱度叶子状AgNPs-ssDNA-Pb2+大分子缔合物,Ag-NPs 聚集体减少,导致545 nm 处的共振散射峰强度降低。其共振散射值随Pb2+的加入量增大而降低。此结果与SERS 光谱一致。
2.4 SEM 表征
扫描电镜图见图6。
通过扫描电镜(SEM)结果表明所制备的AgNPs形状是球形,其平均尺寸约为90 nm(图6a)。在0.54 nmol/L dsDNA-3.98 mg/L AgNPs-2.325×10-4mol/L混合溶液的存在下,AgNPs 颗粒聚集(图6b)。当加入Pb2+后,Pb2+可裂解切割dsDNA,释放出ssDNA,ssDNA吸附在AgNPs 表面,形成比表面积和粗糙度均增大的高褶皱度叶子状AgNPs-ssDNA-Pb2+大分子缔合物(图6c)。AgNPs-ssDNA-Pb2+大分子缔合物具有高SERS 活性,这与试验分析原理一致。

图6 测银纳米的扫描电镜图Fig.6 Scanning electron microscopy of silver nanoparticles
2.5 Pb2+-dsDNA-AgNPs 体系的条件优化
2.5.1 AgNPs 浓度的影响
银纳米粒子浓度的影响见图7。
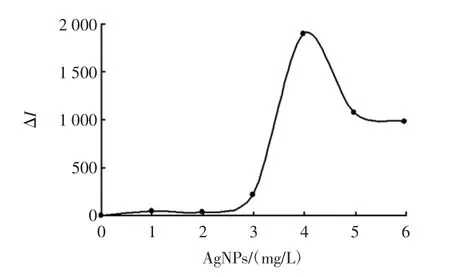
图7 银纳米粒子浓度的影响Fig.7 Effects of concentration of silver nanoparticles
探讨AgNPs 浓度对Pb2+-dsDNA-AgNPs 体系的影响,当体系中没有加入AgNPs 时,SERS 信号很弱,几乎为0。当AgNPs 的加入量逐渐增大时,SERS 信号的变化值ΔI 也在逐渐增大。当AgNPs 的浓度为3.98 mg/L时,ΔI 达到最大值,故选择AgNPs 的浓度为3.98 mg/L。
2.5.2 混合溶液浓度的影响

图8 混合溶液的影响Fig.8 Effects of mixed solution
混合溶液的影响见图8。如图8 所示,以AgNPs 为基底,当体系中没有加入混合溶液时,SERS 信号的变化量ΔI 较弱。当混合溶液的加入量逐渐增大时,SERS信号的变化值ΔI 也在逐渐增大。当混合溶液的浓度为2.325×10-4mol/L 时,ΔI 达到最大值,由于随着混合溶液浓度的增大,所含的氯化钠浓度也随之增大,Ag-NPs 颗粒聚集过大,导致ΔI 值逐渐减小,故选择混合溶液的浓度为2.325×10-4mol/L。
2.5.3 dsDNA 浓度的影响
探讨dsDNA 浓度对Pb2+-dsDNA-AgNPs 体系的影响结果见图9。

图9 dsDNA 浓度的影响Fig.9 Effects of dsDNA concentration
AgNPs 为基底,当体系中没有加入dsDNA 时,SERS 信号很弱。当dsDNA 的加入量逐渐增大时,SERS 信号的变化值ΔI 也在逐渐增大。当dsDNA 的浓度为0.54 nmol/L 时,ΔI 达到最大值,故选择dsDNA 的浓度为0.54 nmol/L。
2.5.4 Rh6G 浓度的影响
探讨Rh6G 浓度对Pb2+-dsDNA-AgNPs 体系的影响,结果见图10。以AgNPs 为基底,当体系中没有加入Rh6G 时,SERS 信号很弱,几乎为0。随着Rh6G 浓度不断增大,SERS 信号的变化量ΔI 不断增大。当Rh6G的浓度为1.830 5×10-6mol/L 时,ΔI 达到最大值,因此选择Rh6G 的浓度为1.830 5×10-6mol/L。

图10 Rh6G 浓度的影响Fig.10 Effects of Rh6G concentration
2.5.5 加样顺序对测Pb2+体系的影响
探讨加样顺序Pb2+-dsDNA-AgNPs 体系的影响,结果见图11。
由图11 可知,当加样顺序为“dsDNA+Pb2++AgNPs+混合溶液+Rh6G”时,线性关系较好。
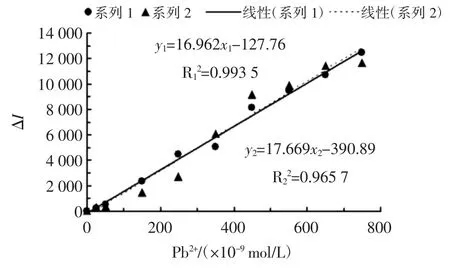
图11 加样顺序对体系的影响Fig.11 Effects of sample order on system
2.5.6 共存物质的影响
根据试验方法探讨在Pb2+-dsDNA-AgNPs 体系中,共存离子的存在条件下对测定结果的影响,结果见图12。

图12 共存物质对体系的影响Fig.12 Effects of coexisting substances on the system
当Pb2+浓度为5.0×10-7mol/L 时,6.5×10-6mol/L Ba2+,3.9×10-6mol/L Cu2+,2.5×10-6mol/L K+,8.3×10-6mol/L Co2+,2.5×10-6mol/L Ca2+,5.0×10-6mol/L Fe3+,2.0×10-7mol/L Hg2+,1.5×10-5mol/L Ni2+,1.2×10-5mol/L Ag+,5.0×10-6mol/L Mn2+,1.5×10-5mol/L 异亮氨酸、天冬氨酸、精氨酸等干扰物质对Pb2+的测定无干扰,且相对误差在±10%内。
2.6 Pb2+-dsDNA-AgNPs 体系的稳定性和重现性
探究Pb2+-dsDNA-AgNPs 体系的稳定性和重现性,结果见表1。
按试验方法,同一批次的AgNPs 测定2.5×10-7mol/LPb2+,同组平行测定10 次。不同批次的AgNPs 测定2.5×10-7mol/L Pb2+,同组平行测定10 次。结果表明,同一批次的AgNPs 测定2.5×10-7mol/L Pb2+,平均值均在误差范围10%之内,不同批次的AgNPs 测定2.5×10-7mol/L Pb2+,平均值均在误差范围10%之内,体系具有一定的稳定性和重现性。

表1 Pb2+-dsDNA-AgNPs 体系*的重现性和稳定性Table 1 Reproducibility and stability of Pb2+-dsDNA-AgNPs system*
2.7 工作曲线
Pb2+的标准曲线见图13。
根据试验方法,以AgNPs 作为基底,在最佳试验条件下做工作曲线,Pb2+浓度与ΔI 的线性回归方程为ΔI=16.962x-127.97,R2=0.993 5,如图13 所示;Pb2+的检测范围在2.5×10-8到7.5×10-7mol/L 之间。本试验方法是一种较好的快速检测Pb2+的新方法。
2.8 与测定铅的国标分析方法比较

图13 Pb2+的标准曲线Fig.13 Standard curve of Pb2+
通过将DNA 酶SERS 测定痕量重金属(Pb2+)与测定铅的国标分析方法比较,得出结果如表2 所示,用国标法检测痕量重金属铅,有其优点和不足,而DNA 酶SERS 法,则是在其优点的基础上,弥补了其不足之处。
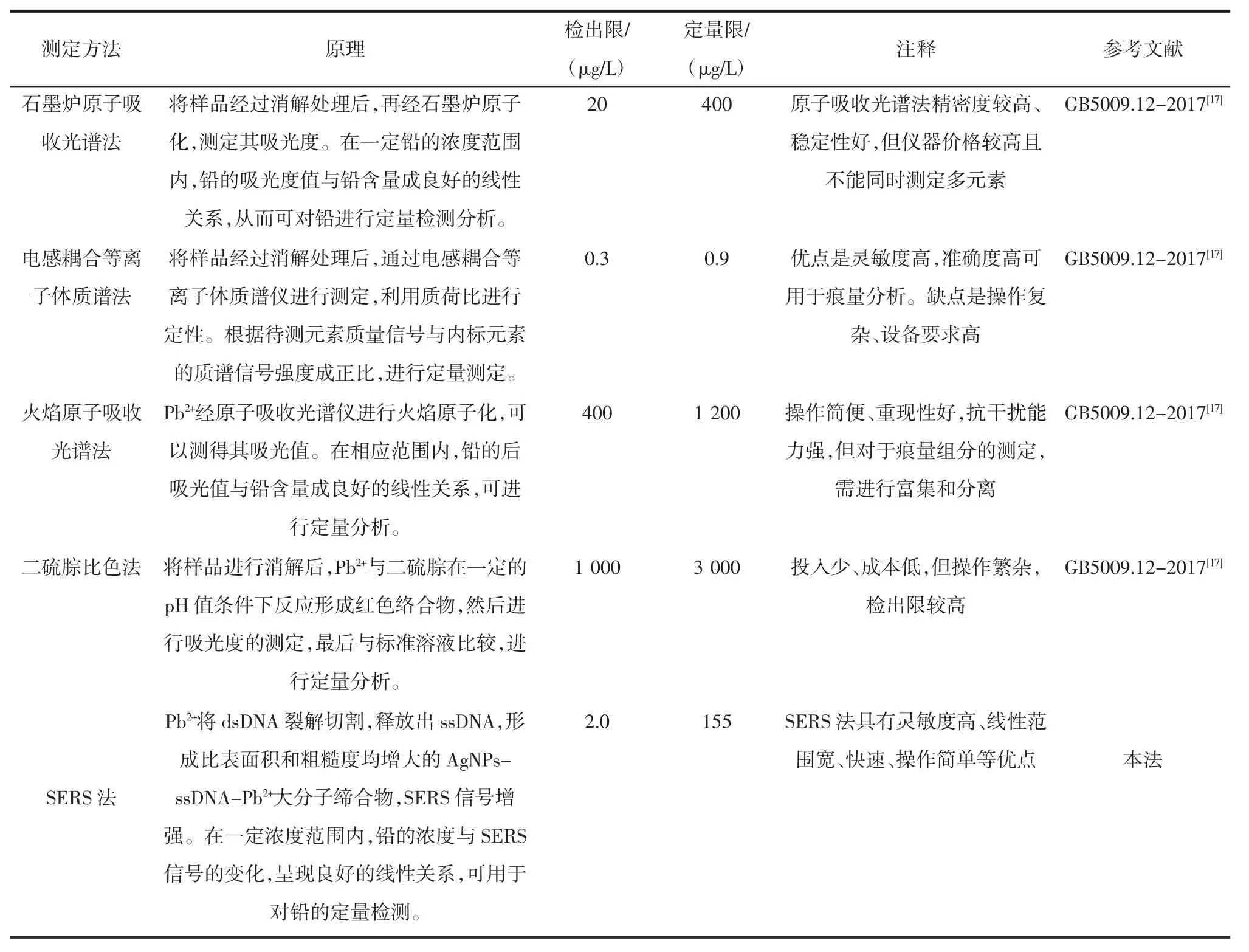
表2 测定Pb2+的国标分析方法比较Table 2 Comparison of GB analytical methods for determination of Pb2+
2.9 测定皮蛋中的重金属铅离子
取2.484 mg/mL 的皮蛋消解液样品,以AgNPs 作为基底,按试验方法测定铅离子含量,结果见表3。
结果表明,相对标准偏差均在10%以内,回收率在99.5%~107.7%之间。

表3 Pb2+-dsDNA-AgNPs 体系测定皮蛋中的Pb2+Table 3 Pb2+-dsDNA-AgNPs system for determination of Pb2+in preserved eggs
3 结论
通过采用还原法可快速制备黄色球形纳米银。在一定条件下,将ssDNA 和DNA 酶杂交形成dsDNA。在dsDNA 和混合溶液存在条件下,AgNPs 发生聚集,聚集的AgNPs 与Rh6G 作用较强,在613 cm-1处出现较强的SERS 特征峰。Pb2+可将dsDNA 裂解切割,释放出ssDNA,形成比表面积和粗糙度均增大的AgNPs-ssDNA-Pb2+大分子缔合物。随着Pb2+浓度的增大,释放出的ssDNA 增多,形成的AgNPs-ssDNA-Pb2+增多,Ag-NPs-ssDNA-Pb2+与Rh6G 作用增强,导致613 cm-1处的SERS 峰强度增大。在选定条件下,Pb2+在2.5×10-8~7.5×10-7mol/L 浓度之间,与其SERS 峰强度的变化值呈良好线性关系,ΔI=16.962x-127.97,R2=0.993 5,Pb2+的最低检出浓度为1.0×10-8mol/L。用建立的方法测定皮蛋中的Pb2+,相对标准偏差(RSD)均在10%以内,回收率在99.5%~107.7%之间。由此可知,该方法有望在检测农产品重金属中,得以广泛应用。

