灵芝固态发酵豆渣的抗氧化特性变化研究
申春莉,沙见宇,李曼,张锦丽
(山东农业大学食品科学与工程学院,山东泰安271000)
豆渣是加工豆浆或豆腐后的副产物。中豆委2011年统计的数据显示,中国生产豆腐所产生的豆渣约为1 304.6 万吨~1 423.2 万吨。大部分豆渣作为饲料或被丢弃,造成了资源的浪费。但是,干豆渣中含有25.4%~28.4%粗蛋白、9.3%~10.9%脂肪、40.2%~43.6%不溶性纤维、12.6 %~14.6 %可溶性纤维和3.8 %~5.3%可溶性碳水化合物,另外豆渣中含有异黄酮、皂苷、磷脂等功能成分[1],可作为微生物的优质培养基[2],经微生物发酵后的豆渣成为菌质。
食药用菌在固态发酵豆渣过程中会产生复杂的酶系统,为自身生长等生理活动提供营养物质。同时,食药用菌可以产生多种功能性成分,使豆渣的利用率提高。国内外对食药用菌固态发酵的研究多集中在生产某一活性成分方面,例如,Li 等[2-3]用羊肚菌作为发酵微生物,固态发酵生产多糖,并研究了其物理化学特征的变化;Shi 等[4-6]利用香菇固态发酵豆渣生产多酚,利用灵芝、金针菇固态发酵豆渣生产多糖,姚珩等[7]利用羊肚菌半固态发酵豆渣生产多糖。
豆渣经食药用菌发酵过程中活性成分及抗氧化特性变化的研究鲜有报道。本研究以灵芝作为发酵菌株,采用固态发酵的形式发酵豆渣,研究发酵过程中多酚、异黄酮、三萜化合物、还原糖含量的变化,并以总还原力、羟基自由基清除力、DPPH 自由基清除力、ABTS+自由基清除力为指标,对灵芝-豆渣菌质的抗氧化活性进行评价,为豆渣功能性食品的研发提供理论依据和技术支持。
1 材料与方法
1.1 材料与设备
1.1.1 供试菌株及原料
灵芝(Ganoderma lucidum)菌株:山东农业大学菌物试验基地;新鲜豆渣:加工早餐豆浆的剩余物,购于山东农业大学学一餐厅。
1.1.2 设备
DHG-9070A 电热鼓风干燥箱:上海一恒科学仪器有限公司;SPX-250BSH 生化培养箱:上海新苗医疗器械制造有限公司;SHA-B 水浴振荡器:常州智博瑞仪器制造有限公司;R-1001 旋转蒸发仪:郑州长城科工贸有限公司;TD25-WS 离心机:长沙平凡仪器仪表有限公司;KQ5200E 超声清洗器:昆山超声仪器有限公司;UV755B 分光光度计:上海佑科仪器仪表有限公司;HH-6 水浴锅:国华电器有限公司。
1.1.3 试剂
葡萄糖、浓硫酸、冰醋酸:天津市永大化学试剂有限公司;琼脂、福林-酚试剂:北京索莱宝科技有限公司;苯酚、邻苯三酚:天津市大茂化学试剂厂;DPPH、ABTS:上海华蓝化学科技有限公司;香草醛:天津科密欧化学试剂有限公司;高氯酸:天津市鑫源化工有限公司;二硝基水杨酸、氢氧化钠、硫酸镁、磷酸二氢钾、亚硫酸钠:天津市凯通化学试剂有限公司;酒石酸钾钠:莱阳市康德化工有限公司;大豆苷、大豆苷元、染料木素、染料木苷(均为色谱纯):上海源叶生物科技有限公司。
1.1.4 培养基
固体平板培养基:葡萄糖2%、蛋白胨2%、马铃薯浸膏0.4%、KH2PO40.3%、硫酸镁0.15%、琼脂2%。
液体培养基:葡萄糖2%、蛋白胨2%、马铃薯浸膏0.4%、KH2PO40.3%、硫酸镁0.15%。
固态发酵培养基:将新鲜豆渣105 ℃烘干备用。使用时,将豆渣的含水量调节至60%,分装与250 mL 三角瓶中,每瓶30 g 豆渣,将封口膜置于三角瓶瓶口,牛皮纸封口,121 ℃灭菌2 h。
1.2 菌种活化与培养
将在试管中保存的灵芝菌丝体转移至固体平板培养基上活化,26 ℃恒温培养箱培养7 d 备用。
1.3 种子发酵与固态发酵
取250 mL 三角瓶分装75 mL 液体培养基,接种5 个直径1 cm 的菌苔,于摇床26 ℃、150 r/min 振荡培养6 d~7 d。
用移液管吸取4.5 mL 发酵种子液(接种量15%),转移至固态发酵培养基,用玻璃棒搅拌均匀,封口膜封口,26 ℃生化培养箱中培养11 d,隔天取样。
1.4 样品制备
将菌质从三角瓶中取出,用液氮研磨,取研磨后的菌质10 g,其中5 g 用于测定含水量,另外5 g 菌质用于活性成分及抗氧化特性的测定。
将5 g 新鲜菌质中加入20 mL 浓度为70%的乙醇超声提取30 min,离心,取上清,重复提取2 次,合并上清液,减压浓缩,定容至25 mL。
1.5 菌质还原糖、三萜、多酚测定
还原糖的测定参考曹金霞[8]的方法;多酚含量测定采用福林酚试剂法[9];三萜含量测定采香草醛-高氯酸法[10]。
1.6 异黄酮含量测定
制备浓度为2、4、6、8、10 μg/mL 的大豆苷、染料木苷、大豆苷元、染料木素标准混合溶液,0.45 μm 有机膜过滤后进行高效液相色谱法(high performance liquid chromatography,HPLC)分析。以色谱峰面积对进样浓度做线性回归分析,建立大豆异黄酮标淮品的标准曲线。不同发酵时间的菌质提取液过0.45 μm 的滤膜,置于1.5 mL 进样瓶中。
色谱柱:Inertsil ODS-3 C18(4.6×250 mm)。流动相:A-超纯水(0.1%乙酸),B-乙腈(0.1%乙酸)。梯度洗脱:0~5 min:15%~18%B;5 min~15 min:18%~21%B;15 min~18 min:21%~25%B;18 min~25 min:25%~28 %B;25 min~28 min:28 %~31 %B;28 min~35 min:31 %~40 %B;35 min~40 min:40 %B;40 min~55 min:40 %~15 %B;55 min~80 min:15 %B。流动相流速:1 mL/min。检测器:示差折光检测器。柱温箱温度:40 ℃。进样量:10 μL。检测波长254 nm,260 nm。
1.7 抗氧化测定
DPPH 自由基清除力参考李汶潓等[11]的方法;羟自由基清除能力参考李致瑜等[12]方法;ABTS+自由基清除力参照范金波等[13]的方法;总还原力-普鲁士蓝法参考林琳[14]的方法测定。
1.8 数据统计与处理
应用Excel 2010 和IBM SPSS Statistics 22 数据处理软件对数据进行单因素方差分析(one-way ANOVA),均值多重比较采用Tukey 法,P<0.05 表示差异显著。
2 结果与分析
2.1 菌质中的三萜、还原糖和多酚含量变化
菌质中还原糖的变化可以反映菌体生长过程中大分子物质的降解。发酵过程中还原糖、多酚以及三萜含量变化情况见图1。

图1 发酵过程中还原糖、多酚以及三萜含量变化情况Fig.1 Changes in the content of reducing sugar,polyphenols and triterpenoids in the fermentation process
由图1 可知,1 d~5 d 时还原糖含量呈上升趋势,由1.64%增加为5.74%,可能是灵芝生长过程中以大分子碳水化合物为碳源,诱导产生了大量的胞外酶(纤维素酶、半纤维素酶、果胶酶等),将纤维素等大分子物质降解为小分子物质,从而使还原糖含量增加[15],菌体消耗的还原糖的量低于胞外酶分解水解产生的还原糖的量;5 d~7 d 时还原糖含量由5.74%下降为5.25%,推测原因为菌体以还原糖作为碳源,供菌体合成次生代谢产物,菌体消耗的还原糖的量高于胞外酶分解水解产生的还原糖的量;7 d~11 d 时还原糖含量由5.25%增加至6.47%,推测原因为菌体消耗的还原糖的量低于胞外酶分解水解产生的还原糖的量。
由图1 可知,1 d~3 d 时多酚含量降低,由67.66 μg/g下降至63.71μg/g;3 d~5 d 时多酚含量升高,由63.71μg/g上升至84.91 μg/g;5 d~7 d 时多酚含量下降,由84.91 μg/g下降至74.10 μg/g;7 d~11 d 时多酚含量上升,由74.10 μg/g上升至102.79 μg/g;与未发酵豆渣相比,多酚含量升高了52%。菌质分泌代谢产物抵挡环境的氧化胁迫,分泌次生代谢产物的能力与自身的生长密切相关[16]。
由图1 可知,1 d~5 d 时三萜含量呈上升趋势,由2.09 mg/g 增加至3.94 mg/g,推测原因为灵芝菌丝体生长产生;5 d~11 d 时三萜含量呈下降趋势,由3.94 mg/g下降至1.22 mg/g,推测原因为:灵芝以三萜类化合物作为代谢底物或代谢的中间物质被分解转化。菌质中的三萜类化合物包含两部分:灵芝三萜、大豆皂苷。灵芝三萜是灵芝中分离得到的主要有效成分之一,其脂溶性较高[17]。灵芝三萜具有良好的抗氧化性,具有清除超氧阴离子自由基、羟自由基、DPPH 自由基、过氧化氢自由基的能力,同时也具有与还原力和铁离子螯合能力[18]。
2.2 菌质醇提物中的异黄酮含量变化
大豆异黄酮是大豆生长过程中形成的一类次级代谢产物,是大豆中重要的生理活性物质。大豆异黄酮中主要含有4 种成分,分别是大豆苷元、染料木素、大豆苷和染料木苷。大豆异黄酮97%左右以糖苷形式存在,其它部分以苷元形式存在[19]。灵芝-豆渣菌质中异黄酮的含量变化如图2、图3 所示。
1 d~3 d 时,大豆苷、染料木苷的含量下降,大豆苷含量由557.92 μg/g 下降至136.95 μg/g,染料木素含量由1143.25μg/g 下降至146.14 μg/g;1 d~3 d 时,大豆苷、染料木素含量上升,大豆苷含量由1 643.12 μg/g 上升至1 660.45 μg/g,染料木素含量由2 480.59 μg/g 上升至2 523.76 μg/g。3 d~7 d 时,4 种异黄酮的含量均呈下降趋势;7 d~11 d 时,异黄酮含量接近0。豆渣中的异黄酮主要以配糖体形式存在,发酵后,微生物产生的纤维素酶系中β-1,4-葡萄糖苷酶降解配糖体生成异黄酮配基。但从发酵前后来看,总大豆异黄酮含量下降,这与姚英政[20]的研究结果一致。推测原因为异黄酮作为灵芝发酵的底物被降解或转化。

图2 异黄酮标准品和菌质异黄酮的高效液相色谱图Fig.2 HPLC chromatograms of isoflavone standards and isoflavones in fermented okara

图3 灵芝发酵豆渣过程中菌质中的异黄酮含量变化Fig.3 Changes of isoflavones content of fungal substance in Ganoderma lucidum-fermented okara
2.3 菌质醇提物的抗氧化活性变化
不同的抗氧化方法具有不同的反应机理,选择不同的抗氧化方法是为了更为确切和全面的评价谷物多酚提取物的抗氧化活性。灵芝-豆渣菌质醇提物(稀释25 倍)的DPPH 自由基清除力、羟基自由基清除力、ABTS+自由基清除力、总还原力如图4 所示。
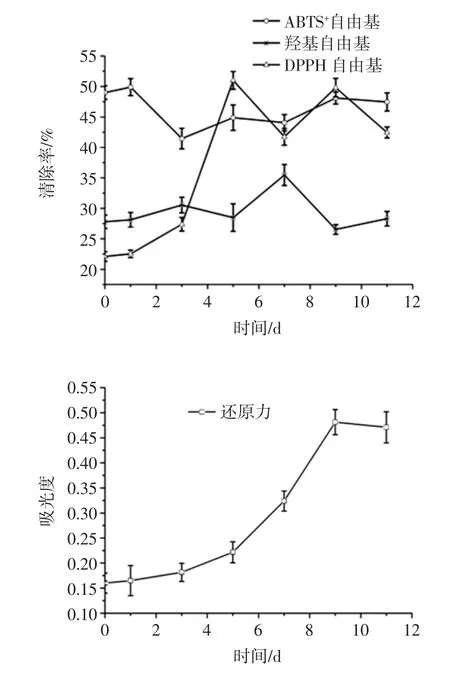
图4 发酵过程中菌质抗氧化活性变化情况Fig.4 Changes in antioxidant activity in fungal substance during fermentation
发酵的1 d~3 d 时菌质醇提物的DPPH 自由基清除率呈上升趋势,由22.54%上升至51.00%;5 d~11 d时菌质醇提物的清除能力呈波浪型变化,第9 天出现1 个峰值,清除力为49.80%。菌质醇提物DPPH 自由基清除率的变化规律与菌质中的还原糖和多酚含量变化规律一致,说明二者在DPPH 自由基清除力方面起主要作用。夏乐晗等研究发现杏果实发育过程中总酚含量与清除DPPH·的能力呈显著正相关[21],与本研究结论相似。多糖中的鼠李糖和三萜也具有较高的DPPH自由基清除力[22-23],本研究发现在发酵前期三萜对DPPH 自由基清除力可能具有一定贡献,还原糖的种类对DPPH 自由基清除力的影响还需要进一步研究。
羟基自由基清除力呈波浪式变动。发酵前5 d,羟基自由基清除力变化较小,5 d~7 d 时羟基自由基清除力快速上升,在第7 天达到峰值,清除力为35.46 %;7 d~9 d 时清除力下降,由35.46%下降至28.30%;9 d~11 d时清除力略有增加。羟自由基是一种氧化能力很强的自由基,寿命很短,几乎可氧化细胞内的一切有机物和无机物,破坏膜系统,引发一系列连锁反应,有氧化效率高、反应速度快等特点,对生物体危害极为严重[22]。
第1 天发酵菌质的ABTS+自由基清除率最大,为49.89%,1 d~3 d 时菌质醇提液对ABTS+自由基的清除能力下降,由49.89%降为41.45%,3 d~11 d 时清除能力缓慢上升,11 d 时菌质醇提物的自由基清除力为47.46%。ABTS+自由基清除能力的不同表明发酵产物的抗氧化性与其抗氧化物的种类和含量有关。在发酵过程中,发酵产物的种类、比例以及含量都会随着发酵时间的进行而变化,因此捕获自由基的能力可能有变化[16]。
随着发酵时间的延长,总还原力呈上升趋势,吸光度由0.165 增加至0.481,第9 天还原力达到最大值;9 d~11 d 时还原力略有下降。菌质醇提取物的总还原力与还原糖的变化规律相一致。还原酮类可提高总还原力。
3 结论
本试验利用灵芝为发酵菌株,以鲜豆渣为原料,纯种固态发酵。发酵后,三萜及多酚含量升高;糖苷型异黄酮在发酵前期转化为苷元型异黄酮,发酵中后期,4 种异黄酮含量降低;菌质的抗氧化能力发生变化,其中发酵后菌质的DPPH 自由基清除力、羟自由基清除力、总还原力提高,ABTS+自由基清除力下降。
灵芝发酵豆渣过程中可以产生多酚、三萜等活性成分,发酵后豆渣的活性成分增加,抗氧化活性提高,可以作为天然的抗氧化剂。

