2011~2018年四川省遂宁市农村人群早期食管癌内镜筛查分析*
杨彬,龙晓奇,荆晓娟,陈袁
629000 四川 遂宁,四川省遂宁市中心医院 消化内镜室
食管癌是环境致癌物、慢性炎症、遗传、细胞代谢异常和病毒等因素导致的发生于消化系统的高发恶性肿瘤,约占所有消化系统肿瘤的40%~50%,主要发病于50岁以上人群,肿瘤细胞呈浸润性生长导致患者预后较差[1-3]。研究表明,食管癌患者预后与分期密切相关,Ⅰ期患者5年生存率为90%,而Ⅳ期仅为10%,因此,早期诊断是延长患者存活时间的关键,但是食管癌发病较为隐匿,缺乏明显特异的症状和体征,因明显症状而就诊者80%以上属中晚期[4-6]。内窥镜是筛查食管癌的首选方法,现选取我院2011年7月~2018年6月无痛内窥镜筛查人群(来源于遂宁市射洪县安居区农村40~69岁人群)共计14 439例为研究对象,分析内窥镜检查在食管癌诊断中的应用价值,探讨食管癌发生的危险因素,旨在为食管癌早期诊治提供依据,具体如下。
1 资料与方法
1.1 一般资料
选取我院2011年7月~2018年6月接收的无痛内窥镜筛查人群(来源于遂宁市射洪县、安居区农村40~69岁人群)共计14 439例为研究对象,其中男性8 129例,女性6 310例,年龄42~67岁,平均(52.3±1.64)岁。纳入对象年龄在40~69岁之间。该研究经医院伦理委员会审核批准后实施,患者及其家属均知情同意。排除标准:①严重心、肾、肝脏等器官功能障碍性疾病患者;②身体虚弱不能耐受,或因重症呼吸道疾病、咽喉壁脓肿等不能合作者;③服用抗凝药物或有出血倾向患者,无肿瘤家族史。
1.2 方 法
1.2.1 内窥镜检查 受检者取左侧卧位,内镜诊疗前开通静脉通道,给予0.1%丙泊酚静脉滴注;待患者进入睡眠状态后,将奥林巴斯H290系列高清内镜经口导入,合理调整角度,奥林巴斯CV290主机(带内镜窄带成像术)监视食管全貌;从距门齿16cm开始仔细观察食管黏膜并辅以1.2%碘液20ml对全食管粘膜进行染色,仔细观察每1cm的食管黏膜状态;关键部位行图像采集,对于碘液不着色区即不染区病灶大小及多少而定取材数量,未发现可疑病灶不取活检;食管黏膜染色后表现为:正常食管黏膜被染成棕褐色,病变部位呈现不同程度的黄色区域[7]。
1.2.2 病理诊断 所有活检组织均以4μm石蜡切片保存,37℃温箱过夜,60℃烤箱2h。然后二甲苯切片脱蜡,无水乙醇梯度脱水,之后严格按照说明书操作步骤用苏木素-伊红染色(hematoxylin and eosin, HE)法进行染色,同时以试剂盒中的阳性切片作为染色的阳性对照,阴性对照片同样运用HE法染色,按照《中国癌症筛查及早诊早治技术方案》的要求进行病理组织学诊断。病理诊断标准[8]:正常为病理诊断未见下异常者;基底细胞增生:上层基底细胞层增生厚度≥上皮全层的15%,细胞核增大,但细胞核无显著性异型性,细胞排列无极向紊乱。低级别上皮内瘤变:轻度不典型增生:异型增生的细胞主要分布在上皮的基底层或≤上皮全层的1/3;中度不典型增生:异型增化的细胞达到上皮中层或≤上皮全层的2/3。高级别上皮内瘤变:上皮全程几乎全层被异型增生细胞所取代,上皮基底膜结构完整清晰。早期食管癌:包括黏膜内浸润癌和黏膜下浸润癌,无淋巴结转移证据。以病理检查结果为“金标准”,分析无痛胃镜筛查诊断食管癌的灵敏度、特异度、阴性预测值与阳性预测值。
1.2.3 危险因素分析 采用病历记载及随访登记统计记录所有入选病例的临床资料,包括患者性别、年龄、居住环境、文化水平、吸烟、饮酒等,统计分析食管癌发生的因素。
1.3 统计学处理

2 结 果
2.1 内镜筛查及病理诊断情况
14 439例筛查对象,内镜检查发现食管重度异型增生及更高级别病变199例,检出率1.38%,其中早期食管癌173例(早诊率87%),重度异型增生14例,进展期食管癌12例。内镜筛查诊断食管癌的灵敏度为96.34%(184/191),特异度为99.9%(14 233/14 248),阳性预测值为92.46%(184/199),阴性预测值为99.95%(14 233/14 240),详见表1。食管癌筛查检出率逐年降低,且男性检出率高于女性,除2015年外,差异均具有统计学意义(P<0.05),(表2)。
表1 内镜筛查结果与确诊结果比较
Table 1. Comparison between Results of Endoscopic Screening and Diagnostic Results
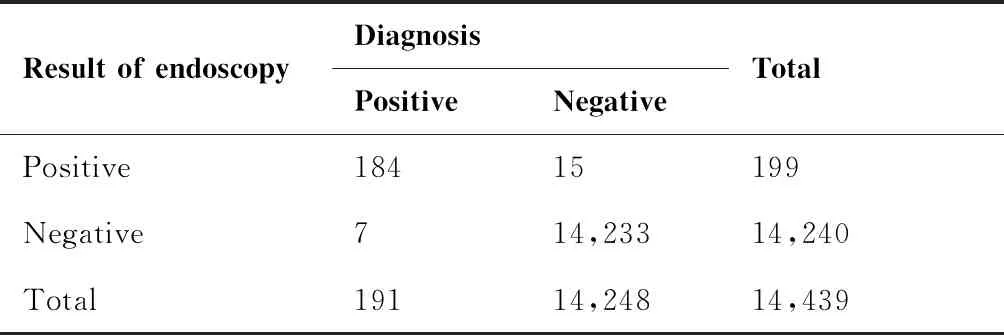
Result of endoscopy DiagnosisPositiveNegativeTotalPositive18415199Negative714,23314,240Total19114,24814,439
2.2 食管癌发生的危险因素分析
单因素分析与多因素Logistic回归分析提示:年龄≥55岁、男性、吸烟、饮酒、不良饮食习惯是食管癌发生的危险因素(P<0.05)(表3、4)。
表2 食管癌发病基本情况分析
Table 2. Incidence of Esophageal Cancer

YearNumber of cases with endoscopy (male/female)Esophageal cancer(%)Detection rate in males(%)Detection rate in females(%)20111,026(502/524)20(1.95)14(2.79)6(1.15)20122,582(1,269/1,313)48(1.86)36(2.84)12(0.91)20132,136(1,438/698)36(1.69)31(2.16)5(0.72)20141,725(943/782)24(1.39)18(1.91)6(0.77)20151,929(1,201/728)29(1.50)19(1.58)10(1.37)20161,126(602/524)11(0.98)9(1.50)2(0.38)20172,004(1,143/861)15(0.75)10(0.87)5(0.58)20181,911(1,031/880)16(0.84)11(1.07)5(0.57)Total14,439(8,129/6,310)199(1.38)148(1.82)51(0.81)
表3 食管癌危险因素的单因素分析
Table 3. Univariate Analysis of Risk Factors of Esophageal Cancer
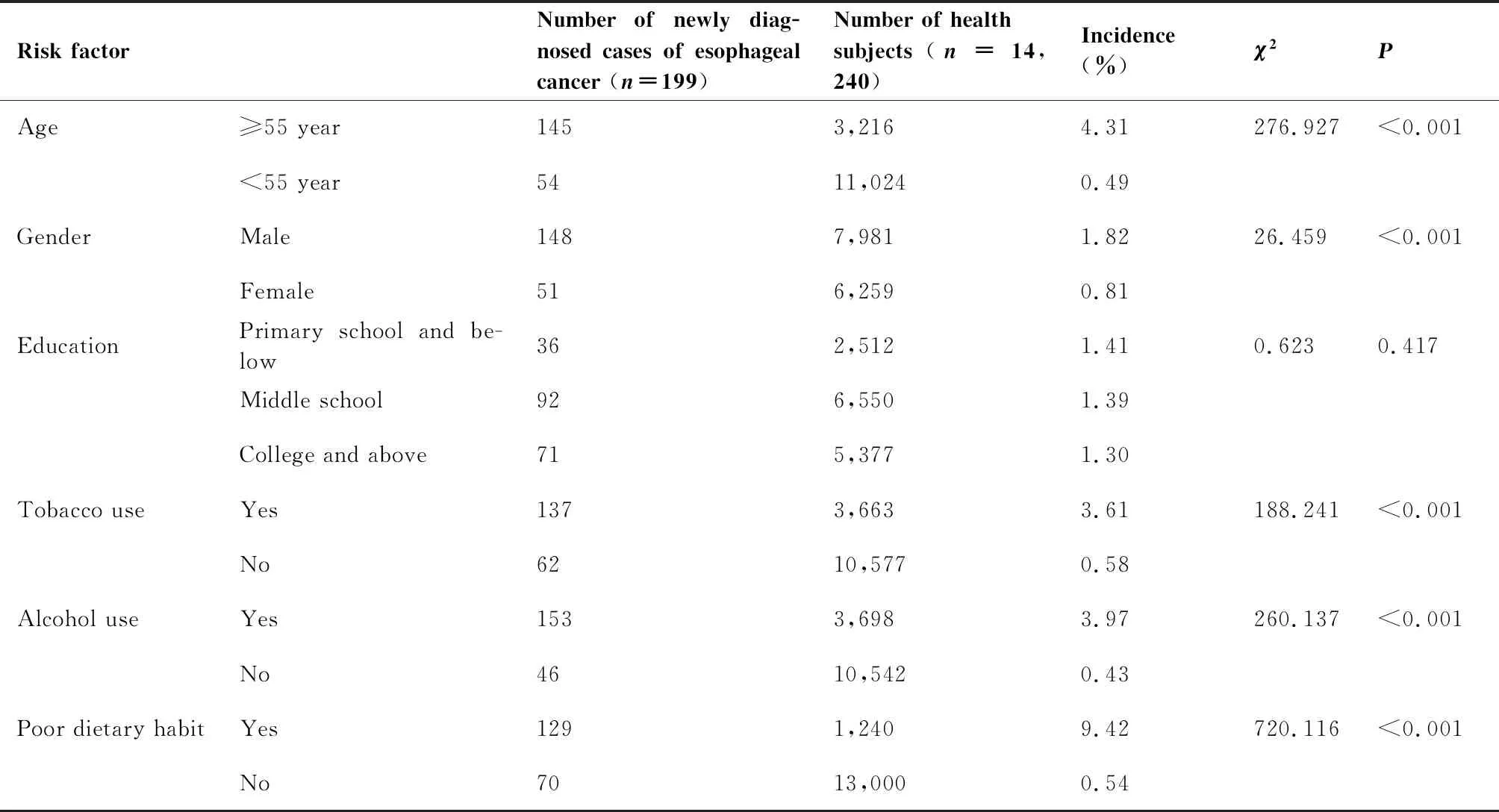
Risk factorNumber of newly diag-nosed cases of esophageal cancer (n=199)Number of healthsubjects(n=14,240)Incidence(%)χ2PAge≥55 year1453,2164.31 276.927<0.001<55 year5411,0240.49 GenderMale1487,9811.82 26.459<0.001Female516,2590.81 EducationPrimary school and be-low362,5121.41 0.6230.417Middle school926,5501.39 College and above715,3771.30 Tobacco useYes1373,6633.61 188.241<0.001No6210,5770.58 Alcohol use Yes1533,6983.97 260.137<0.001No4610,5420.43 Poor dietary habitYes1291,2409.42720.116<0.001No7013,0000.54
表4 食管癌危险因素的多因素Logistic回归分析
Table 4. Multivariate Logistic Regression Analysis of Risk Factors of Esophageal Cancer
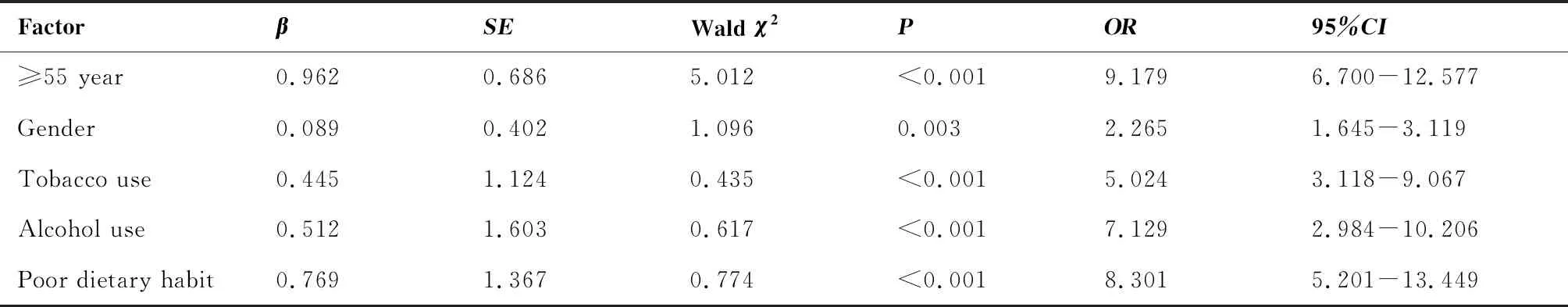
FactorβSEWald χ2POR95%CI≥55 year0.9620.6865.012<0.0019.1796.700-12.577Gender0.0890.4021.0960.0032.2651.645-3.119Tobacco use0.4451.1240.435<0.0015.0243.118-9.067Alcohol use 0.5121.6030.617<0.0017.1292.984-10.206Poor dietary habit0.7691.3670.774<0.0018.3015.201-13.449
3 讨 论
研究表明,随着环境污染加重与生活节奏加快,食管癌发生率呈现增长趋势,如英国食管癌发生率从1985年的0.36%上升为2012年的0.65%,美国食管癌发生率增长了0.5%,从1980年的4/1 000人次增加到2012年的9/1 000人次,中国食管癌发生率也从20年前的0.42%上升到了0.76%,但是食管癌发生率在种族、地区之间存在差异,欧洲食管癌的发生率为8/1 000,中国人为1/300,美国白人为1/88,非裔美国人为1/70,日本发生率为1.3 /1 000[9-12]。目前,食管癌的治疗仍以外科手术切除病灶为首选,可快速有效清除原发灶和转移灶,初次肿瘤细胞减灭术的治疗效果及患者生存率逐年提高,但外科手术主要适合于中早期食管癌患者,对于初次就诊就已为晚期的患者,手术治疗往往难以达到预期治疗效果。此外,食管癌患者病情进展快,患者预后及五年生存率均不理想,病死率高,因此,早期诊断和治疗是延长患者存活时间的关键。
随着“人群筛查”与“机会性筛查”的推动,内窥镜筛查结合碘染色增强病灶与正常组织的对比,取得近乎等同于病理学的诊断图像,具有较高的诊断准确率,有助于发现早期癌症和癌前病变,且患者顺应性好,被逐渐用于食管癌的早期筛查[13-14]。相关文献可知,40~60岁自然人群的食管重度不典型增生及以上病变检出率为1.37%~2.82%,早诊率约80%,如河南地区2009年~2013年,食管癌的总检出率为1.50%,早期癌检出率为84.96%[15-17]。四川省遂宁市中心医院执行“国家重大公共卫生专项上消化道癌早诊早治项目”2011年~2018年无痛内窥镜筛查遂宁市射洪县、安居区农村40~69岁人群共计14 439例,筛查发现食管重度异型增生及以上病变(早期+进展期食管癌)检出率1.38%,结果表明遂宁市部分地区食管癌检出率仍较高。此外,早期食管癌检出率为87%,且灵敏度、特异度均高于90%,提示内镜检查对于食管癌具有较高的早诊率、灵敏度与特异度,与文献[15]报道相一致。
食管癌是多种因素参与的复杂多样的生物学过程,病因和发病机制较为复杂,环境污染、吸烟、职业暴露、既往慢性炎症疾病、人口老龄化、肿瘤家族史等均与食管癌发生具有关系,是一种与遗传、自身免疫及环境因素有关的多因素疾病。目前,根据诱发因素针对高危人群可以通过持续质量改进给予预防措施有助于避免其发生,如部分地区将病因学预防研究落实到了具体层面,采取改变不良饮食习惯(不食用霉变食物)、改造有害生活环境(饮用水)和改良饮食营养卫生等预防食管癌发生[18-19]。本研究结果显示年龄≥55岁、男性、饮酒、吸烟是食管癌发生的危险因素。进一步分析其原因,中老年人群,尤其是男性人群,由于各种基础疾病以及长期处于不良环境因素状态下(较长时间的吸烟饮酒史、长期高脂高糖饮食等),全身免疫机能低下等造成抗氧化失衡,会影响消化道内皮组织的正常生理功能,活化并聚集炎症细胞,直接导致消化道炎症反应进程加速。同时氧化/抗氧化失衡过程中出现的活性氧激活核因子KB等物质,该类物质能调控与诱导组织释放炎症介质,并且相关的酰基转移酶应激性失活,激素受体水平降低,不断促进炎症反应,使其成为食管癌高发人群。因此,针对高危人群应开展有针对性防治措施,包括给予定期筛查、健康教育,做好三级预防,从真正意义上让居民认识到食管癌筛查的重要性以及让居民了解食管癌防治的相关知识,降低食管癌发生率[20-22]。但是本研究总样本量相对较少,且病例样本来源地较单一,在以后的研究中会相应地扩大样本量及样本来源,前瞻性研究进一步证实内镜筛查诊断食管癌价值。
综上所述,内镜筛查有助于提高食管癌早诊率,通过内镜筛查技术的普遍开展以及危险因素的预防控制,提高防癌意识,有助于预防食管癌发生,改善患者预后。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

