百香果茎尖组织培养体系的建立①
赵家桔 高 玲 李莉萍 张如莲 高锦合刘迪发 徐 丽 应东山
(1 中国热带农业科学院热带作物品种资源研究所 海南海口571101;2 海南省南繁生物安全与分子育种重点实验室 海南海口571101)
百香果(Passiflora edulis)有较高的市场价值,种植前景良好。目前我国热区已将百香果种植业列为“短、平、快”的精准扶贫项目[1]。但我国百香果优质苗木较为缺乏,存在品种单一,产量低,品质、抗病性差等问题。百香果种植中90%的种苗都是采用无性繁育方法获得。无性繁育中的扦插繁殖种苗存在变异大、品种易退化、病害增加、产量降低等问题[2]。在百香果产业发展过程中,病毒病很大程度上制约了其发展[3]。由于频繁的跨地区苗木销售及引种种植,百香果病害日益加剧[4]。种苗携带有茎基腐病菌、马铃薯Y病毒属的百香果木质化病毒、黄瓜花叶病毒等[5],豇豆蚜传花叶病毒[6]和大戟曲叶病毒[7],影响了百香果种植业和加工业的发展,给产业的持续发展带了巨大风险。针对百香果种苗带病毒问题,组织培养技术已经成为目前最有效去除病毒的方法,其效率高、周期短;同时能克服生产上无性繁殖率低,繁殖速度慢等缺点。许多学者对百香果的离体再生培养展开了研究,并取得一定成果。根据文献报道,百香果不同器官部位,如茎节间、腋芽、叶片、子房、子叶、下胚轴、卷须、胚乳[8-11]均可作外植体材料进行快繁体系的建立;极少文献报道利用腋芽为外植体[12-13],通过不同的外植体诱导,可得到愈伤组织或不定芽。陈发兴[10]试验比较了百香果不同部位的萌芽率,发现叶盘和卷须诱导不定芽比较困难,而叶柄相对容易,茎段萌芽率可达100%。杨冬业等[11]研究表明,叶片萌芽极其困难,茎段的出芽率达100%。本研究利用组织培养对百香果茎尖进行脱毒研究,旨在为百香果产业可持续健康发展提供优质健康种苗,进而促进百香果产业的发展。
1 材料与方法
1.1 材料
试验于2018年2月至2019年2月在中国热带农业科学院热带作物品种资源研究所内进行。材料采自中国热带农业科学院热带作物品种资源研究所新品种标准与测试中心资源圃,品种为“黄金百香果”。
MS 基本培 养 基:4.43 g/L MS 粉,30 g/L 蔗糖及7 g/L琼脂,pH 5.8,经121℃,0.1 MPa、30 min高温高压灭菌后备用。
初代(诱导培养基)培养基:4.43 g/L MS 粉,30 g/L 蔗糖,7 g/L 琼脂,6-BA 2.0 mg/L,GA30.5 mg/L,NAA 0.1 mg/L,pH 5.8,经121℃,0.1 MPa、30 min高温高压灭菌后备用。
继代增殖培养基:4.43 g/L MS 粉,30 g/L 蔗糖及7 g/L 琼脂,6-BA 1.5 mg/L,NAA 0.1 mg/L,pH 5.8,经121℃,0.1 MPa、30 min 高温高压灭菌后备用。
生根培养基:2.17 g/L 1/2 MS 粉,30 g/L 蔗糖及7 g/L 琼脂,NAA 0.1 mg/L,IBA 0.1 mg/L,pH 5.8,经121℃,0.1 MPa、30 min 高温高压灭菌后备用
1.2 方法
在黄金百香果生长旺盛时,以其顶芽或带腋芽茎段为外植体材料,剪取50 cm 左右的百香果嫩梢,留腋芽及顶芽,截成2~3 cm 的茎段。茎段先用自来水冲洗2~3 次,再用蒸馏水冲洗1 次,在无菌环境中用无菌水冲洗两遍,用75%酒精消毒30 s,无菌水洗涤一次,随后按照表1 中处理组A1~A4 进行消毒处理,处理时在消毒剂中滴加2~3滴吐温,消毒期间不断地晃动三角瓶,使消毒剂充分与材料接触,消毒剂处理后用无菌水冲洗5~6 次,每次冲洗3 min,用滤纸吸干茎段表面的水分。于解剖镜下剥取茎尖(0.5~1.0 mm)作为外植体,接种于初代培养基中。

表1 不同消毒时间的处理
1.2.1 培养条件
培养温度(25±1)℃,光照强度2000 lx 左右,光照时长12 h/d。
1.2.2 初代培养
按照第一步筛选的消毒时间剥取茎尖接种于不同浓度的GA3,NAA和6-BA 1.0~2.0 mg/L 处理的培养基上,每个处理接种20 个大小较为一致的茎尖。在初代培养基上培养35 d 后,转接到继代增殖培养基中,每瓶接种2 个芽尖,每处理接种60个芽尖,培养30 d,观察芽增殖情况,以选取最佳浓度激素组合。
1.2.3 继代增殖培养
待初代培养后得到的无菌外植体茎尖长至5~7 cm时,切段继代培养,每段0.5 cm左右,带一个节间,接种到激素组合为6-BA+NAA 的MS 培养基(每升培养基附加30 g蔗糖,7 g琼脂)中进行继代培养,每两个月继代一次,反复继代4~5次之后,统计其增殖系数和玻璃化程度,重复3次。
1.2.4 生根培养
挑选健康、长势好且均匀的组培苗进行生根诱导,长度2~3 cm 的增殖芽,将嫩芽从基部切下,接 入0.05、0.1、0.15、0.2 mg/L NAA 配 合0.1 mg/L IBA 的1/2 MS 的培养基中进行壮苗生根,培养25 d进行结果统计分析。
1.2.5 练苗移栽
待组培苗根长到2~3 cm 时,进行练苗5~7 d左右。移栽到育苗钵内,以透气性、保水性较好的腐殖土为基质,苗不仅生长旺盛,移栽成活率也高。
1.2.6 计算方法及数据处理
接种后7~15 d分别统计污染率、褐化率、存活率,相关计算公式如下:
污染率=污染外植体数/接种外植体总数×100%
褐化率=外植体褐化数/接种外植体总数×100%
存活率=(外植体接种总数-外植体污染数-褐化及被杀死的外植体数)/外植体接种总数×100%
采用SPSS 22.0对数据进行处理分析。
2 结果与分析
2.1 不同消毒时间对百香果茎尖的影响
对黄金百香果外植体的消毒时间设置不同组合,统计结果发现,在0.1%HgCl2作消毒剂的处理组,污染率随着消毒时间的延长而降低,并且呈现显著差异,褐化率则随着消毒时间的延长而升高,但是3个试验组的结果无显著差异。处理组A3的存活率较高,但是随着消毒时间的增长,10和12 min的试验组无显著差异。
根据各处理组污染率、褐化率和存活率的分析,处理组A3 为黄金百香果外植体的最佳消毒方式,具体操作为75%乙醇消毒30 s,0.1 HgCL2消毒10 min,可以获得较低的污染率、褐化率以及较高的存活率(表2)。
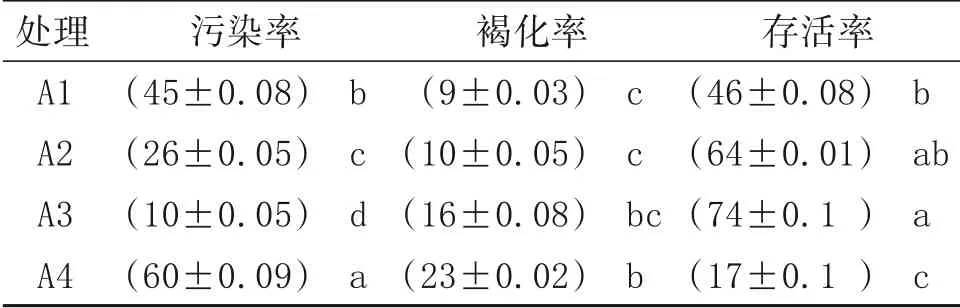
表2 不同消毒时间对百香果茎尖的影响 单位:%
2.2 初代培养丛生芽诱导
在培养基中添加GA3茎尖萌动早,长势较快,不易分化成从生芽;不同6-BA 浓度处理的茎尖萌发慢,且不同6-BA 浓度对外植体生长和分化有明显影响。6-BA 浓度很小时,愈伤组织不易分化成从生芽。随着6-BA 浓度的增加,愈伤化越早,越容易形成愈伤组织;分化类型随着6-BA 浓度的增加,丛生芽越多。当6-BA 浓度为2 mg/L 时,外植体芽易形成愈伤组织,且愈伤组织大量生长,易分化成为丛生芽且较健壮(表3)。由此认为,培养基MS+6-BA 2.0 mg/L+GA30.5 mg/L+NAA 0.1 mg/L是最适初代培养基。

表3 不同培养基对百香果茎尖丛生芽诱导情况
2.3 继代增殖培养
观察NAA 浓度为0.1 mg/L,6-BA 浓度分别为0.5、1.0、1.5和2.0 mg/L 继代 培养 上培 养4 周后的增殖生长状况,结果发现,在6-BA 浓度为1.5 mg/L 的增殖培养基中的茎尖长势快,叶片粗壮,颜色浓绿(图1-A);而6-BA 浓度为1.0 mg/L的增殖培养基中茎尖苗长势缓慢,叶片细,植株矮小(图1-B)。
2.4 生根培养
诱导组培苗生根的重要条件是生根培养基,植物调节剂是提高百香果组培苗不定根的关键因素。把丛生芽(图2)切割成单株小苗,接入不同生根培养基,25 d 后观察。由表4 可知,生根培养基以1/2 MS 附加0.1 mg/L NAA和IBA 为最好,在此培养基上诱导的根粗壮,数目多,生长良好(图3)。
2.5 炼苗移栽
炼苗(图4)是组培苗生根不可缺少的环节。将经生根壮苗培养获得根长为2~3 cm 的苗,移入室外遮阴棚炼苗5~7 d,然后将培养瓶瓶盖打开,在自然光下锻练2~3 d。经过锻炼的幼苗用摄子轻轻地取出,放入浓度为0.1%多菌灵溶液中浸泡5 min,再用清水冲洗2~3次,把根部的培养基冲洗干净,栽入体积比椰糠∶表土∶蛭石=2∶1∶1 的混合基质中,浇足定根水,放置于遮阳棚内,保持湿润,移栽后待10~15 d 新根与新叶长出,移栽成活率可达95%以上。
3 讨论与结论
以百香果茎尖为材料,在解剖镜下剥取茎尖,茎尖需要在短时间内诱导出大量的丛生芽,以芽生芽的方式建立再生体系是最快捷的途径,再进行生根诱导,以便短时间内可以得到大量的植株[11,14],从而加快百香果繁殖速度,有利于脱毒苗及优良种源的繁殖与保存。本试验结果表明,最佳的消毒方式为75%的酒精溶液消毒30 s后再用0.1%HgCl2消毒10 min,这与焦楠[13]的最佳消毒方式类似,具体操作为75%乙醇消毒30 s,0.1%氯化汞消毒12 min,可以获得较低的污染率、褐化率以及较高的存活率。最适初代培养基为MS+6-BA 2.0 mg/L+GA30.5 mg/L+NAA 0.1 mg/L,有利于丛生芽的诱导。本研究通过添加不同浓度的6-BA和NAA,对百香果茎尖初代培养基进行了筛选,发现2.0 mg/L 6-BA 可使百香果茎尖诱导出大量愈伤组织;在培养基中添加GA3,茎尖萌动早,长势较快;最适继代培养基为MS+6-BA 1.5 mg/L+NAA 0.1 mg/L,适宜芽的增殖且利于壮苗;最适生根培养基为1/2 MS+NAA 0.1 mg/L+IBA 0.1 mg/L,形成的苗健壮,生根率高达95%。本试验采用1/2 MS 作为基础培养基效果较好,这与前人研究一致[11,13,15]。史沉鱼等「14]在诱导百香果生根时发现,活性炭的加入可促进二级根的生成。
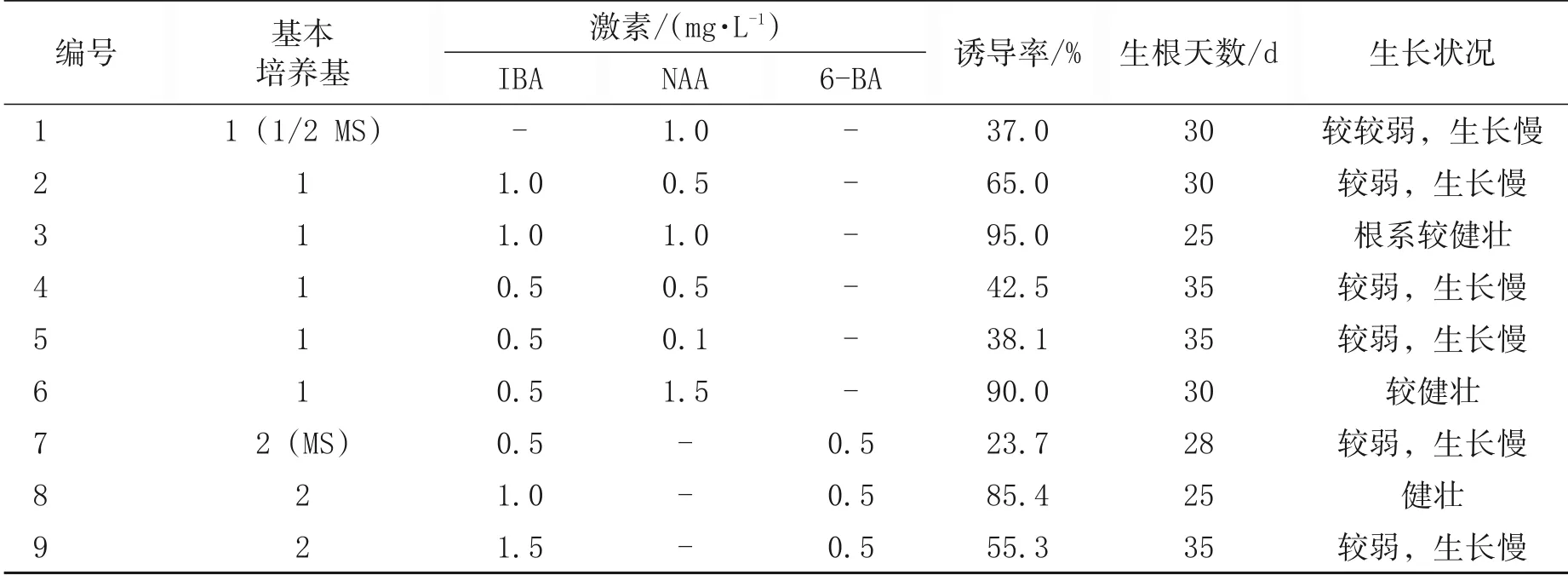
表4 不同培养基对百香果生根诱导的影响
茎尖培养的成功率主要取决于茎尖的大小,茎尖过大,脱毒不彻底;茎尖过小,则容易引起褐化。本文认为切取茎尖控制在0.5~1.0 mm 有利于其成活。继代次数不能超过5次,长期继代的试管苗有可能再感染病毒,还会引起芽变的可能。因此,脱毒试管苗组织快繁,需二年更换一次基础苗,以提高试管苗的质量。试管苗要及时进行继代培养,因为长时间培养,不能及时转移,容易出现“玻璃化”苗。

