贵州高原型喀斯特次生林C、N、P生态化学计量特征与储量
刘立斌,钟巧连,倪 健,3,*
1 浙江师范大学化学与生命科学学院,金华 321004 2 中国科学院普定喀斯特生态系统观测研究站,安顺 561000 3 中国科学院地球化学研究所环境地球化学国家重点实验室,贵阳 550081
生态化学计量学是在化学计量学的基础上,结合生态学的基本原理,分析生态相互作用过程中多种化学物质平衡的一门科学,对生态系统能量流动、物质循环和养分限制等生态过程具有重要的指示作用,是研究碳(C)、氮(N)、磷(P)等元素在这些生态过程中耦合关系的有利工具[1-6]。自把生态化学计量学运用到生态学研究以来,国内外就植被生态系统生态化学计量特征及其分布格局开展了大量研究[3,5,7-10]。
喀斯特是由地下水和地表水对碳酸盐类岩石(白云岩和石灰岩等)的溶蚀和改造作用而形成的具有特殊结构和功能的地貌,生态敏感度高、环境容纳量低和稳定性差[11]。其中,以贵州、广西和云南为中心的我国西南喀斯特地区是世界三大喀斯特地貌集中分布区之一,面积较大且代表性强。研究表明,在我国西南喀斯特地区开展植物和土壤生态化学计量研究,对深入了解喀斯特植被生态系统的养分循环、植物生长演替、适应策略,植被恢复与重建以及对石漠化生态系统的治理具有重要意义[12-14]。一方面,喀斯特地区土壤元素含量与非喀斯特地区具有相同的特征,如随着植被正向演替,表层土壤的有机C、全N和全P含量显著增加[15-16];N/P 显著升高,而C/N 和C/P显著下降[17]。另一方面,喀斯特作为特殊的生态系统,其植物和土壤元素含量又表现出其独特的特征,如同一喀斯特生态系统中,无石漠化环境的土壤C、N含量显著高于石漠化环境土壤[14];喀斯特地区绝大部分植物属于P制约型植物[18],而黔中喀斯特地区植物主要受N的限制[13,19-20]。可见,喀斯特植物的生长可能会同时受到N、P元素的制约。然而,大多数喀斯特地区生态化学计量研究仅涉及植物叶片、凋落物和土壤[21],植物其他组分(如木本植物的干、皮、枝、根)的研究非常少见[13],亦没有关于木质残体的研究。受制于喀斯特植被生物量估算研究的困难性,喀斯特植被N、P储量的研究尚未见报道,且C储量的研究较少[22-23]。而且,前人进行喀斯特植被C储量研究时所设置的样地面积较小(通常为400—900 m2),在生境高度异质的喀斯特地区,其研究结果具有很大的不确定性。因此,喀斯特植被各组分生态化学计量的全面研究,以及基于大样地的喀斯特植被C、N、P储量的全面估算非常必要且紧迫。
本研究以云贵高原面上喀斯特次生常绿落叶阔叶混交林为研究对象,测定和分析了森林所有组分(乔木树干、树枝、树皮和树叶,灌木枝干、枝皮和叶片,草本地上部分,植物根系,凋落物和木质残体以及土壤)的C、N、P生态化学计量特征,并在此基础上结合生物量估算研究[24],全面估算了生态系统C、N、P储量。本研究可为喀斯特地区植被恢复与重建以及区域碳循环研究提供基础。
1 材料与方法
1.1 研究区概况
天龙山(105°45′50″ E,26°14′45″ N,1550 m)地处我国西南贵州省普定县,是普定喀斯特生态系统观测研究站所属的后寨河流域的代表性山体,属典型的高原型喀斯特地貌。根据普定县气象站1961—2013年的观测数据,该地区年平均温度15.2 ℃,最热月7月的平均温度为23.0 ℃,最冷月1月的平均温度为5.2 ℃,极端高温和极端低温分别为34.7 ℃(2005年5月16日)和-11.1 ℃(1977年2月9日);≥5 ℃积温为3743 ℃;多年平均降水量为1341 mm,降水的年内分配不均匀,超过70%的降水量集中在5月至9月期间;年平均日照时数仅1189 h,日照百分率仅为26.3%。
天龙山永久监测样地面积为2 hm2(200 m×100 m,水平投影面积),坡向为南坡,平均坡度为31°,局部坡度可高达80°。平均石灰岩岩石裸露率为44.7%,局部坡度可高达98%。土壤多为棕色石灰土,土层较薄,平均厚度为44.8 cm,但土壤养分丰富。植被类型为保存较好的次生常绿落叶阔叶混交林,处于演替的次顶极阶段。乔木冠层高度6—10 m,盖度73.1%,胸径(DBH)≥1 cm植株的平均DBH为5.4 cm。生物量前10位的优势树种包括窄叶石栎(Lithocarpusconfinis)、化香树(Platycaryastrobilacea)、云南鼠刺(Iteayunnanensis)、安顺润楠(Machiluscavaleriei)、云贵鹅耳枥(Carpinuspubescens)、短萼海桐(Pittosporumbrevicalyx)、猫乳(Rhamnellafranguloides)、朴树(Celtissinensis)、香叶树(Linderacommunis)和白蜡树(Fraxinuschinensis)[18]。林下植被盖度约30%,其中灌木生物量前3位的优势物种为刺异叶花椒(Zanthoxylumdimorphophyllum)、倒卵叶旌节花(Stachyurusobovatus)和异叶鼠李(Rhamnusheterophylla);优势草本植物包括多种苔草(Carex)、矛叶荩草(Arthraxonlanceolatus)和单芽狗脊蕨(Woodwardiaunigemmata)等[24]。
1.2 林分调查与生物量全面估算
根据生物多样性森林永久监测样地建设的技术规范,对天龙山样地进行了全面调查。将2 hm2大样地划分为200个10 m×10 m的样方,记录每个样方的坡度、坡向、岩石裸露率和植被盖度等小生境信息,然后对每个样方内DBH≥1 cm的木本植物进行标记、挂牌和定位,并记录其种名、胸径、高度(长度)和冠幅信息。在大样地内随机选取10个10 m×10 m的样方,调查样方内乔木幼苗、灌木和藤本植物(DBH<1 cm)的种名、高度(长度)、基径与盖度和草本植物的种名、高度与盖度。
我们利用生物量方程、样方收获、土柱挖掘和数据引用等方法对天龙山样地的生物量进行了全面估算,其中乔木地上生物量为134.61 Mg/hm2,灌木和藤本地上生物量为2.72 Mg/hm2,草本地上生物量为0.36 Mg/hm2,植被根系生物量为20.27 Mg/hm2,凋落物死生物量为8.6 Mg/hm2,木质残体死生物量为8.96 Mg/hm2[18]。根据普定喀斯特生态系统观测研究站赵家田砍伐样地数据(未发表),乔木树干、树枝、树皮和树叶分别占其地上生物量的50.95%、33.87%、9.43%和5.75%;灌木(含藤本)枝干、枝皮和叶片分别占其地上生物量的66.24%、12.26%和21.50%。我们利用以上生物量比例计算每一株木本植物各器官的生物量。
1.3 样品采集与元素测定
样地内的10个优势乔木树种和3个优势灌木物种(见研究区概况),每个物种选取5株不同DBH或基径的健康植株。乔木树干利用瑞典产Haglof生长锥在树木胸径位置钻取;乔木树枝和灌木枝干利用枝剪剪取;乔木和灌木的皮用小刀刮取;乔木和灌木叶片利用高枝剪和枝剪获取;草本地上部分利用镰刀沿地面割取(10个1m×1 m小样方)。获取根系生物量的根系样品用于根系C、N、P元素的测定。在样地内随机选取10份凋落物样品和10份木质残体样品用于元素测定。在样地的上部、中部和下部分别挖掘3个土柱(共9个),根据样地土壤平均深度,每个土柱内土壤样品按0—10 cm、10—20 cm、20—30 cm和>30 cm采集,挑除样品内的石砾、植物根系和土壤动物等。同时,利用土壤容重测定采样器(200 cm3)测得各层次土壤的容重。
将所有的植物和土壤样品烘干、粉碎并利用0.25 mm的过滤筛过滤。植物样品全C和全N利用元素分析仪测定,全P利用电感耦合等离子体发射光谱法测定。土壤有机C利用重铬酸钾氧化-外加热法测定,全N利用元素分析仪测定,全P利用电感耦合等离子体发射光谱法测定。
1.4 生态系统C、N、P储量的计算
每一株木本植物地上部分的C、N、P储量用其各器官(干、皮、枝、叶)的生物量乘以各自元素含量(非优势物种元素含量为10个优势树种或3个灌木优势物种含量的平均值)。草本地上部分、植物根系、凋落物和木质残体用元素含量乘以各自生物量。各层土壤C、N、P储量利用土壤覆盖率(55.3%)、土壤容重、土壤厚度、土壤中石砾含量和土壤元素含量计算得到。
1.5 数据分析
所有的统计分析均使用SPSS 19.0进行。显著性水平为0.05/0.01。
2 结果与分析
2.1 喀斯特森林各组分C、N、P生态化学计量特征
10个优势乔木C含量在各器官的差异较小,仅树干显著(P<0.05)高于树皮,具体表现为树干>树枝>树叶>树皮(表1)。N含量和P含量在各器官差异较大且规律一致,均表现为树叶>树皮>树枝>树干,树叶N、P含量显著(P<0.01)高于其他器官,树皮和树枝又显著(P<0.01)高于树干(表1)。因此,C/N和C/P表现为树干显著(P<0.01)高于其他器官,树枝和树皮显著(P<0.01)高于树叶;而N/P在各器官间差异不显著(P>0.05)。N含量在各树种间的差异最大,化香树树干的N含量是香叶树的4.58倍;朴树的树皮N含量是白蜡树的4.19倍。其次是P含量,香叶树的树皮P含量是白蜡树的2.97倍。C含量在各树种间差异较小(表1)。
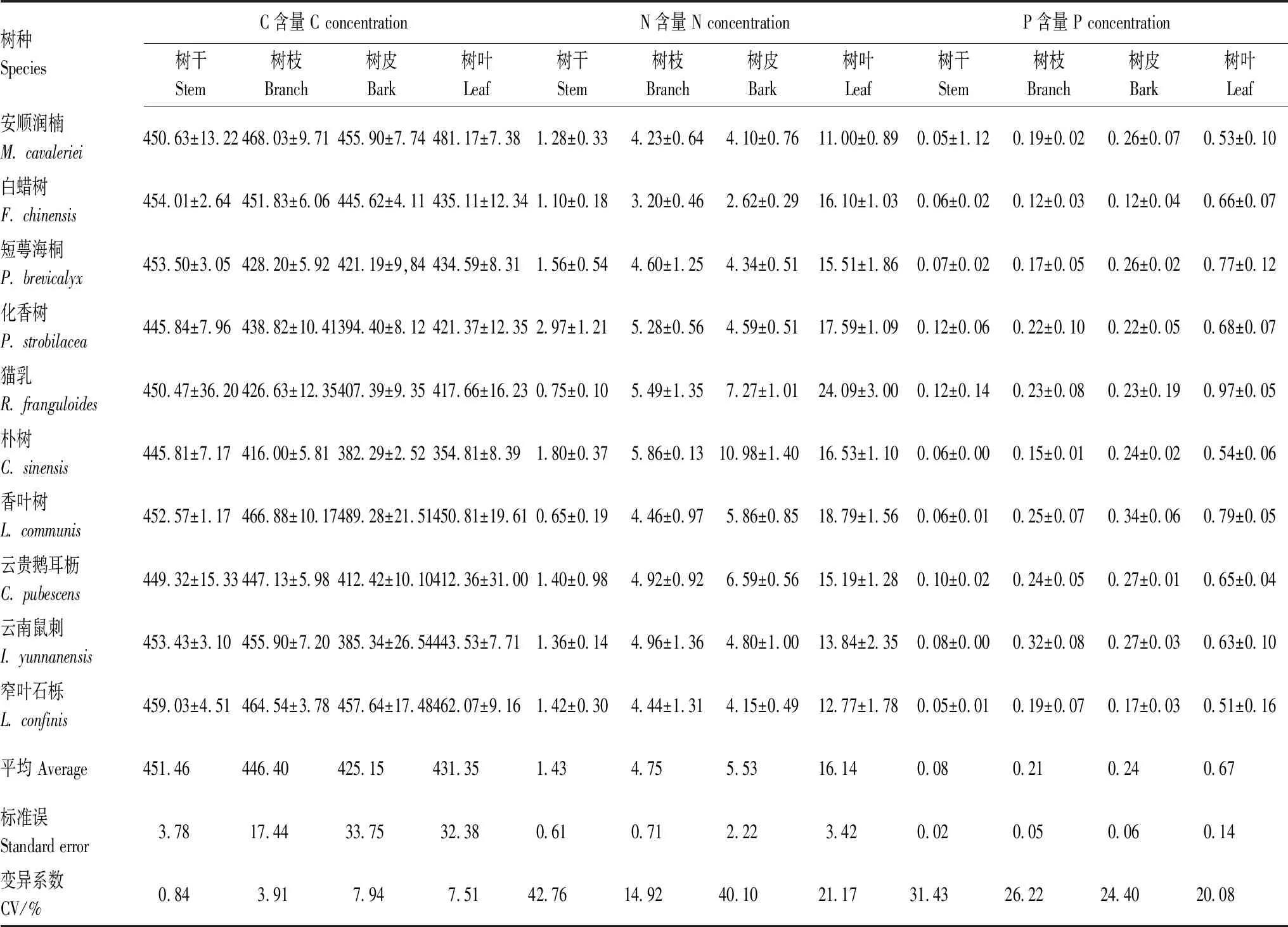
表1 优势乔木树种各器官C、N、P含量/(g/kg)Table 1 C,N and P concentrations /(g/kg) in stem,branch,bark and leaf of dominant tree species
灌木地上各器官C含量表现为枝干>枝皮>叶片,枝干显著(P<0.01)高于枝皮和叶片。而N含量和P含量在这些器官中的排序正好相反,表现为叶片>枝皮>枝干,叶片的N、P含量显著(P<0.01)高于枝皮,后者又显著(P<0.01)高于枝干。C/N和C/P表现为枝干显著(P<0.01)高于枝皮和叶片。而N/P在各器官间差异不显著(P>0.05)。草本地上部分C含量与乔木和灌木叶片接近,N含量略低于乔木和灌木叶片,而P含量略高于乔木和灌木叶片(表2)。与地上部分相比,植物根系的C含量较低,N、P含量及C/N、C/P、N/P与乔木树皮与树枝接近(表2)。凋落物和木质残体的C含量较高,与乔木树干和灌木枝干接近,而N、P含量处于中间水平(表2);凋落物和木质残体的N/P显著(P<0.01)高于植物活体。土壤C、N、P含量均随土壤深度的增加而降低,最表层(0—10 cm)土壤的C、N、P含量和N/P显著(P<0.05)高于深层土壤(表2);C/N和C/P在各土层间差异不显著(P>0.05)。
2.2 喀斯特森林C、N、P储量
植物地上部分C、N、P储量分别为61.96 Mg/hm2、0.54 Mg/hm2和0.024 Mg/hm2。其中乔木的C、N、P储量分别为60.58 Mg/hm2(占植物地上部分C储量的97.77%)、0.52 Mg/hm2(96.08%)和0.023 Mg/hm2(95.82%),显著高于林下植物的C(1.38 Mg/hm2)、N(0.021 Mg/hm2)和P(0.001 Mg/hm2)储量。植物根系C、N、P储量较低,分别占植物C、N、P储量的11.56%、15.58%和16.53%。凋落物和木质残体的C、N、P储量分别为8.06 Mg/hm2、0.18 Mg/hm2和0.004 Mg/hm2。森林土壤C、N、P储量分别为94.30 Mg/hm2、4.42 Mg/hm2和1.16 Mg/hm2。大约60%的土壤C(53.96 Mg/hm2)、P(0.69 Mg/hm2)储量和超过70%的土壤N储量(3.18 Mg/hm2)存储在0—20 cm土层中(表3)。

表2 植物各组分、凋落物、木质残体和土壤C、N、P含量(g/kg)及生态化学计量特征Table 2 C,N and P concentrations (g/kg)and stoichiometry characteristics in live vegetation,litter,woody debris and soils
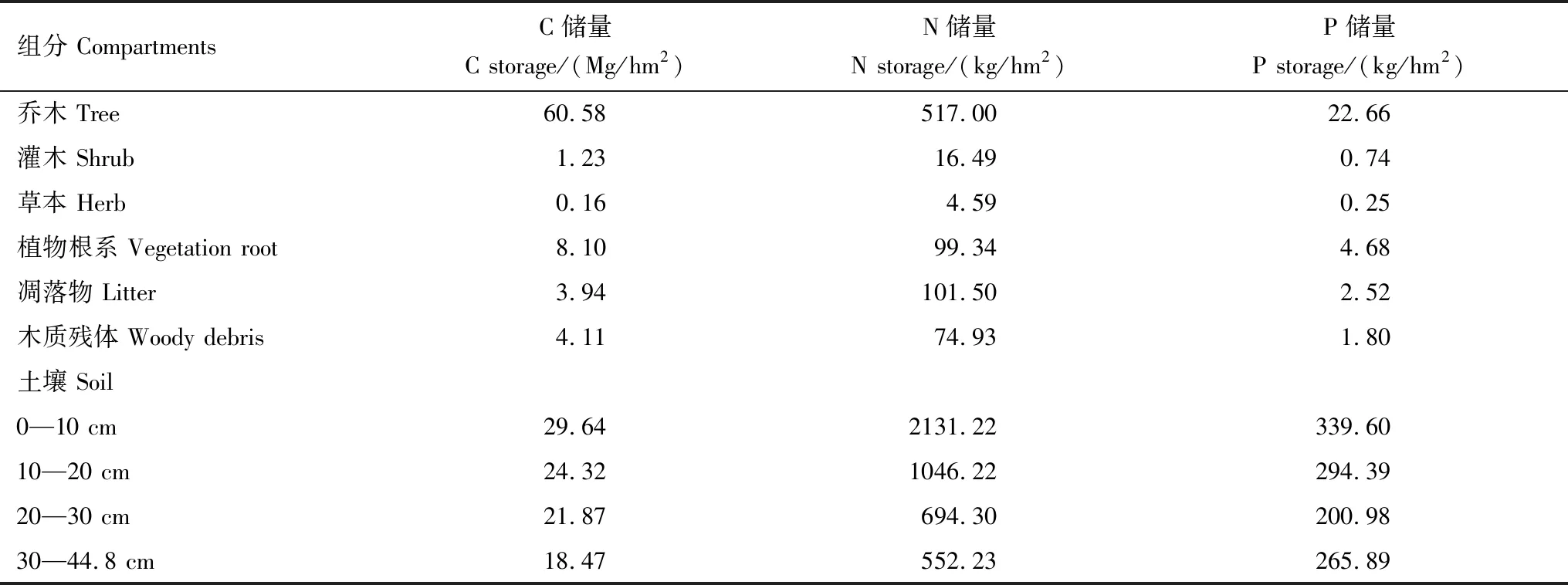
表3 植物、凋落物、木质残体和土壤C、N、P储量Table 3 C,N and P storages in live vegetation,litter,necromass and soils
高原型喀斯特次生常绿落叶阔叶混交林的生态系统C、N、P储量分别为172.42 Mg/hm2、5.24 Mg/hm2和1.19 Mg/hm2。大部分森林C(54.69%)、N(84.46%)、P(97.26%)存储于土壤中。植物C(70.06 Mg/hm2,40.63%)、N(0.64 Mg/hm2,12.17%)、P(0.028 Mg/hm2,2.37%)储量较小。凋落物和木质残体C、N、P储量则更小,二者C、N、P储量之和仅占总生态系统C、N、P储量的4.67%、3.37%和0.36%(表3)。
3 讨论
3.1 喀斯特植被C、N、P生态化学计量特征与储量研究不确定性分析
本研究首次全面研究了贵州高原型喀斯特次生常绿落叶阔叶混交林各组分C、N、P含量及其生态化学计量特征,并在生物量全面估算的基础上,估算了该喀斯特森林的C、N、P储量。但本研究也存在一些不足之处:
同一物种不同个体相同器官(种内变异)以及不同土柱相同土层内土壤C、N、P含量差异较大,例如,同一土层的土壤N含量最大可相差56倍。因此,未来有必要开展更多植物与土壤(尤其是后者)样品采集与测定工作,才能保证生境高度异质的喀斯特植被C、N、P含量及其生态化学计量特征的准确性。
植物各器官C、N、P含量及生物量各异,例如乔木树叶的N、P含量最高,而其生物量比重最小;树干N、P含量最低,而生物量比重最大。因此,非常有必要精确估算植物各器官的生物量。利用当地已有的生物量方程仅能计算得到各植株地上总生物量[24],本研究利用的乔木和灌木各器官生物量比例,是同一流域内林龄及生境相似的喀斯特森林所有乔木或灌木的总的比例,并未得到各物种各器官的生物量比例,而各物种甚至各植株各器官的生物量比例均存在差异。因此,虽然本研究所使用的方法可以较准确地估算喀斯特植被的C、N、P储量,但基于一个总的生物量比例来计算所有物种各器官的生物量,从而估算整个喀斯特森林生态系统C、N、P储量的方法还是存在一定误差。由于当地植被已被当地政府保护,不能进一步砍伐标准木,确定各物种干、皮、枝、叶在整个植株中所占的生物量比例,以及构建各物种各器官的生物量方程,仍需寻找各器官生物量精确估算的新途径。
本研究在估算土壤C、N、P储量时,所利用的土壤深度是为25个土柱的平均深度。而各土柱土壤深度同样差异较大,最深的可达123 cm,最浅的仅为10 cm。土壤C、N、P储量在整个森林生态系统中所占比例最大(表3),相对准确的土壤平均深度是土壤乃至整个生态系统C、N、P储量估算的保障。因此,挖掘更多的土柱以更加准确地确定土壤深度,是未来喀斯特生态系统C、N、P储量估算的必要工作。
3.2 喀斯特植被C、N、P生态化学计量特征与储量研究与全国及全球研究比较
高原型喀斯特植物叶片C含量在423.78—434.20 g/kg之间,低于全球陆生植物叶片平均C含量(464 g/kg)[3],同时也处于我国植物叶片C含量范围(423.8—530.2 g/kg)的较低水平[8-10,13,20-21,25-28]。但总体来看,喀斯特森林植物叶片C含量(423.8—530.2 g/kg)[13,20-21,27-28]与非喀斯特植物叶片C含量(450.0—470.3 g/kg)[8-10,25-26]并没有表现出显著(P>0.05)差异,但前者变异程度高于后者,也反映喀斯特生境高度异质的特点。高原型喀斯特植物叶片N含量在12.81—16.14 g/kg之间,与其他喀斯特植物叶片N含量研究结果一致(7.71—17.28 g/kg)[13,20,27-28],普遍表现出喀斯特植物叶片N含量显著(P<0.05)低于我国陆地植物叶片平均值(18.6 g/kg)[29]和全球植物叶片平均值(20.09 g/kg)[30]。高原型喀斯特植物叶片P含量在0.66—0.71 g/kg之间,与其他喀斯特植物叶片P含量研究结果一致,均显著(P<0.05)低于全球尺度的平均值(1.77 g/kg)[30];但与我国陆地植物叶片平均值(1.21 g/kg)[29]差异并不显著(P>0.05),反映出我国植物叶片P含量与全球尺度相比显著偏低的特点[31]。N和P对生物的生长、发育和行为起重要作用,植物的最适生长需要一定值的N/P,当植物叶片N/P<14时,植物生长表现为受N限制;当N/P>16时,表现为受P限制;当14 与其他喀斯特森林土壤研究结果一致,高原型喀斯特森林土壤C含量显著(P<0.05)高于非喀斯特森林,但二者N、P含量差异并不显著[10,21,27,33],导致喀斯特森林土壤C/N和C/P均高于全国平均水平(C/N:11.9;C/P:61),而N/P与全国平均水平(5.2)接近[34]。 尽管喀斯特森林土壤C含量较高,但受制于喀斯特森林土壤浅薄、土壤总量较低,其C储量依然低于非喀斯特森林土壤,而N、P储量则更是远低于非喀斯特森林土壤[35-36]。加之喀斯特森林植物生物量与碳储量较低[24],喀斯特森林表现为低C、N、P储量森林[24,35-36]。 喀斯特植被生态系统是一种脆弱的生态系统,一经人为干扰与破坏,极易发生逆行演替,甚至导致石漠化的发生[37]。在我国西南地区,喀斯特原生林,甚至是喀斯特次生林,仅零星分布于一些自然保护区或偏远山区。而石漠化重灾区面积约占该区国土面积的22%;另外,荒草地、藤刺灌丛和灌木林地等退化植被面积超过该区总植被面积的30%[38],直接导致我国西南喀斯特地区植被涵养水源、生物多样性保护和C固存等功能较弱。因此,喀斯特地区植被恢复工作迫在眉睫。 植物和土壤N、P含量及C/N、C/P是限制植物生长及固C潜力的重要因素[30,39-40]。本研究结果表明,高原型喀斯特次生林植物叶片和土壤N、P含量较低,C/N与C/P高于我国和全球平均水平,喀斯特地区N、P元素匮乏。有学者对我国西南非喀斯特林地进行人为施加N肥干扰,发现可增加植物叶片和土壤中的C含量[41];另外,也有学者对我国西南喀斯特地区退化草地进行人为施加N、P和钾肥的尝试,发现植物的生物量可大幅增加[42]。因此,在进行喀斯特破坏生态系统的恢复与重建时,可借鉴此法,适当施加N肥和P肥,从而促进喀斯特地区植物生长,并达到喀斯特植物与土壤增汇的目的。 森林是陆地上最大的碳库,其碳储量占陆地总碳储量的30%—50%[43-46]。喀斯特森林植物与土壤C储量虽低于同气候带的非喀斯特森林,但远高于荒草地、藤刺灌丛和灌木等退化植被[22,24,47]。Liu等[23]在后寨河流域的研究表明,如若流域内退化植被可以恢复成顶极森林,流域地上生物量碳库在50—100年后可增加92.5%,在140—200年后可增加4.4倍。全球喀斯特地貌面积高达2200万km2,占全球陆地面积的14.8%[37]。因此,喀斯特地区潜在碳汇能力巨大,增加喀斯特地区碳汇对维持全球碳平衡及缓解温室效应带来的全球气候变化具有重要意义。 我国西南喀斯特植被C、N、P生态化学计量特征与储量研究数据匮乏,研究结果不确定性大。本研究全面分析了贵州高原型喀斯特次生林所有组分的C、N、P生态化学计量特征,并结合大样地生物量估算数据全面估算了该喀斯特森林生态系统C、N、P储量。得到喀斯特森林植物叶片N、P含量低,土壤C含量高,生态系统C、N、P储量低的结论。研究可为喀斯特地区生态系统功能恢复与C、N、P生物地球化学循环提供基础数据。3.3 对喀斯特地区植被恢复和碳循环的启示
4 结论
————水溶蚀岩石的奇观

