系统性轻链型淀粉样变性异常浆细胞特征分析
撒 琪 任贵生 徐孝东 郭锦洲 陈文萃 赵 亮 刘志红 黄湘华
系统性轻链型淀粉样变性(AL),是由单克隆免疫球蛋白轻链错误折叠形成淀粉样蛋白在组织器官沉积,造成组织结构破坏、器官功能障碍并进行性进展的疾病[1]。可累及全身多个器官,临床表现多样,预后差,临床诊断主要依赖于组织活检[2-4]。单克隆免疫球蛋白主要来源于骨髓中异常克隆性浆细胞,利用多参数流式细胞术(multiparametric flow cytometry,MFC)检测AL患者骨髓浆细胞,识别恶性浆细胞对疾病的诊断和治疗具有重要意义,且相对于组织活检,骨髓穿刺创伤较小。目前,AL单克隆浆细胞表型特征,不同浆细胞病之间浆细胞数量与免疫表型差异尚未十分明确,缺乏大样本研究。
本研究回顾性观察AL患者的临床特征,利用MFC对骨髓浆细胞进行检测,通过比较AL与非AL的具有肾脏意义的单克隆免疫球蛋白血症(MGRS)、MM患者骨髓浆细胞数量及表型差异,分析AL单克隆浆细胞数量、免疫表型特征,探究两者与疾病风险分层的关系。
对象和方法
研究对象2015年5月至2018年9月在东部战区总医院国家肾脏疾病临床医学研究中心住院治疗的AL患者119例,对照组非AL的MGRS患者 49例,MM患者 19例。所有患者均有以下表现:(1)存在蛋白尿和(或)肾功能不全[估算的肾小球滤过率(eGFR)<60 ml/(min·1.73m2)];(2)血液/尿液/组织中检出单克隆免疫球蛋白或骨髓检查发现浆细胞异常增生。
临床及实验室指标收集患者性别、年龄、24h尿蛋白、血白蛋白、球蛋白、尿素氮、血清肌酐、尿酸、碱性磷酸酶、白细胞、血红蛋白、血小板、免疫球蛋白(IgG、IgA、IgM)、血游离轻链差值(dFLC)、N-末端脑钠肽前体(NT-proBNP)、肌钙蛋白T(TnT)、血免疫固定电泳等实验室检查结果及器官受累情况。
相关定义AL及器官受累诊断标准参照《系统性轻链型淀粉样变性诊断和治疗指南》(2016年)[1],肾脏:24h尿蛋白定量>0.5g,以白蛋白为主;心脏:心脏超声平均心室壁厚度>12 mm,排除其他心脏疾病;或是在无肾功能不全及心房颤动时NT-proBNP>332 ng/L;肝脏:无心力衰竭时肝上下径(肝叩诊时锁骨中线上测量的肝上界到肝下界的距离)>15 cm;或碱性磷酸酶大于正常值上限的1.5倍;外周神经:临床出现对称性双下肢感觉运动神经病变。MGRS诊断参考相关文献[5-6],多发性骨髓瘤(MM)诊断参考《中国多发性骨髓瘤诊治指南(2017年修订)》[7]。
研究方法
仪器与试剂MoFlo XDP超速流式细胞分选系统(Beckman Coulter公司),配置488 mm和633 mm激光器,采用六色荧光标记技术,用RPE-TR、APC、APC-Cy7、RPC-Cy7、CD117-UV1、RPE-Cy5分别标记胞膜CD19、CD38、CD45、CD56、CD117、CD138抗体。荧光标记的κ和λ游离轻链抗体。以上试剂及溶血素、细胞固定液和透膜液均购自Beckman Coulter公司。
样品制备无菌操作抽取患者骨髓液,取0.2 ml涂片进行骨髓形态学检测;另取2 ml于肝素抗凝管中4℃低温保存,于48h内进行红细胞裂解,CD19、CD38、CD45、CD56、CD117、CD138、κ和λ抗体染色处理待测。
形态学检测骨髓涂片经瑞氏—吉姆萨染色,光镜下观察并分类计数200个有核细胞。
MFC检测用流式细胞仪(MoFlo XDP,Beckman Coulter公司)分析样品。每次记录至少10万个细胞。用BD CellQuest Pro软件对数据进行分析。根据前向散射(FSC)和侧向散射(SSC)指定骨髓有核细胞的阈值门控以排除红细胞,死细胞和细胞碎片。采用CD38/CD138设门策略圈定双阳性细胞,分析该群细胞其他表面抗原的表达情况。
统计学分析使用《SPSS18.0》软件进行统计学分析。正态分布计量资料以均数±标准差表示,非正态分布计量资料以中位数(四分位间距)表示,计数资料以例数(百分比)表示。计量资料组间比较采用独立样本t检验,计数资料组间比较采用χ2检验。P<0.05为差异有统计学意义。
结 果
一般资料本研究纳入AL患者119例,男性61例,女性58例,中位年龄55岁。对照组纳入非AL的MGRS 49例(包括伴单克隆免疫球蛋白沉积的增生性肾小球肾炎27例,单克隆免疫球蛋白沉积病16例,轻链沉积病3例,重链沉积病2例,轻重链型淀粉样变性1例),MM 19例。所有患者基线临床特征见表1。
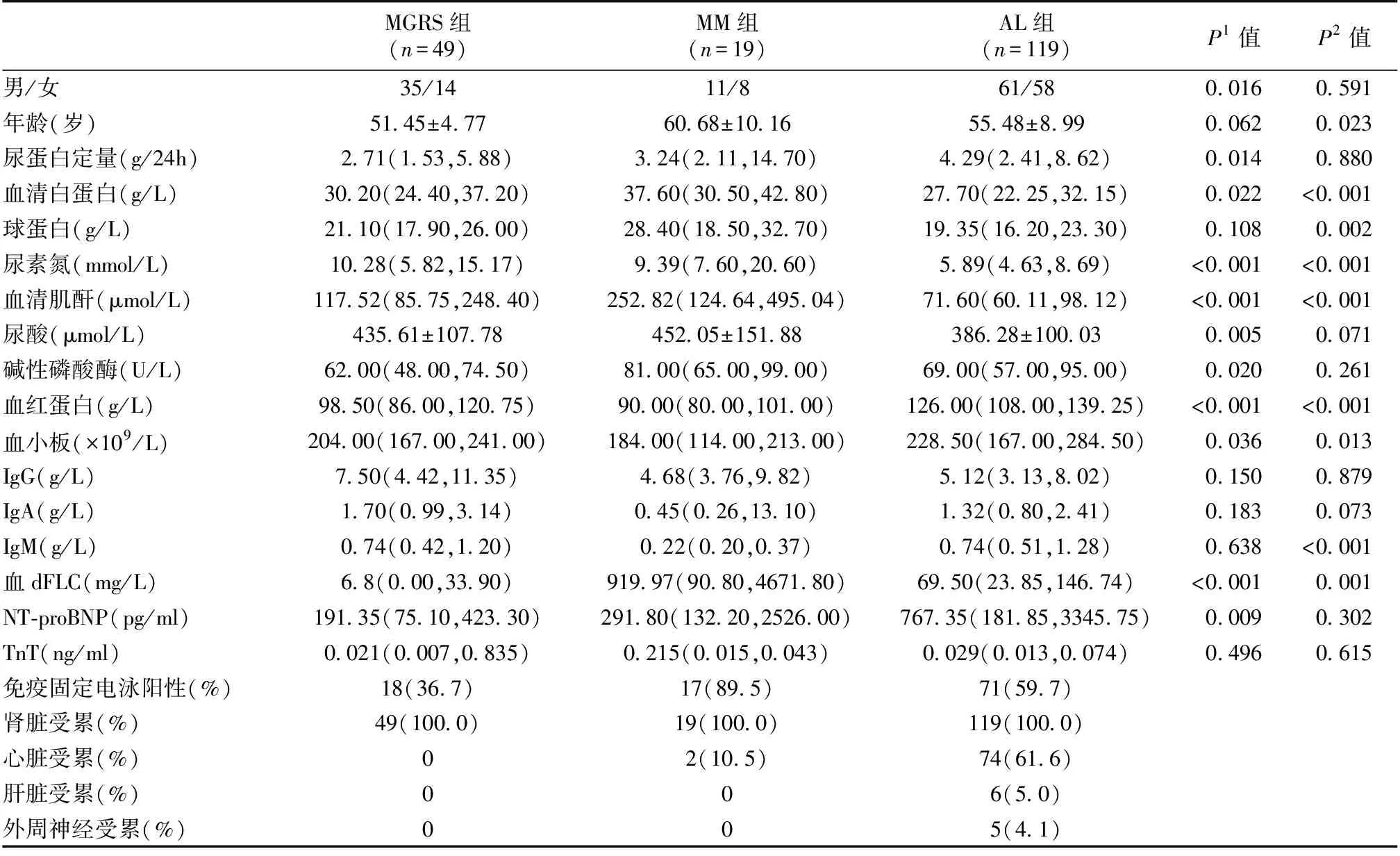
表1 三组患者临床基线资料
AL:系统性轻链型淀粉样变性;MGRS:具有肾脏意义的单克隆免疫球蛋白血症;MM:多发性骨髓瘤;dFLC:游离轻链差值;NT-proBNP :N-末端脑钠肽前体;TnT:肌钙蛋白T;P1:AL组vs非AL的MGRS组;P2:AL组vsMM组
浆细胞数量特征AL患者骨髓形态学检测总浆细胞比例2%(0.5%,4%),MFC检测总浆细胞比例0.61%(0.3%,1.21%),其中单克隆浆细胞比例0.42%(0.07%,0.99%)。无论是形态学检测还是MFC检测,AL患者骨髓浆细胞数量高于MGRS(P<0.001),低于MM(P<0.001);MFC检测单克隆浆细胞数量也呈现上述规律(表2)。
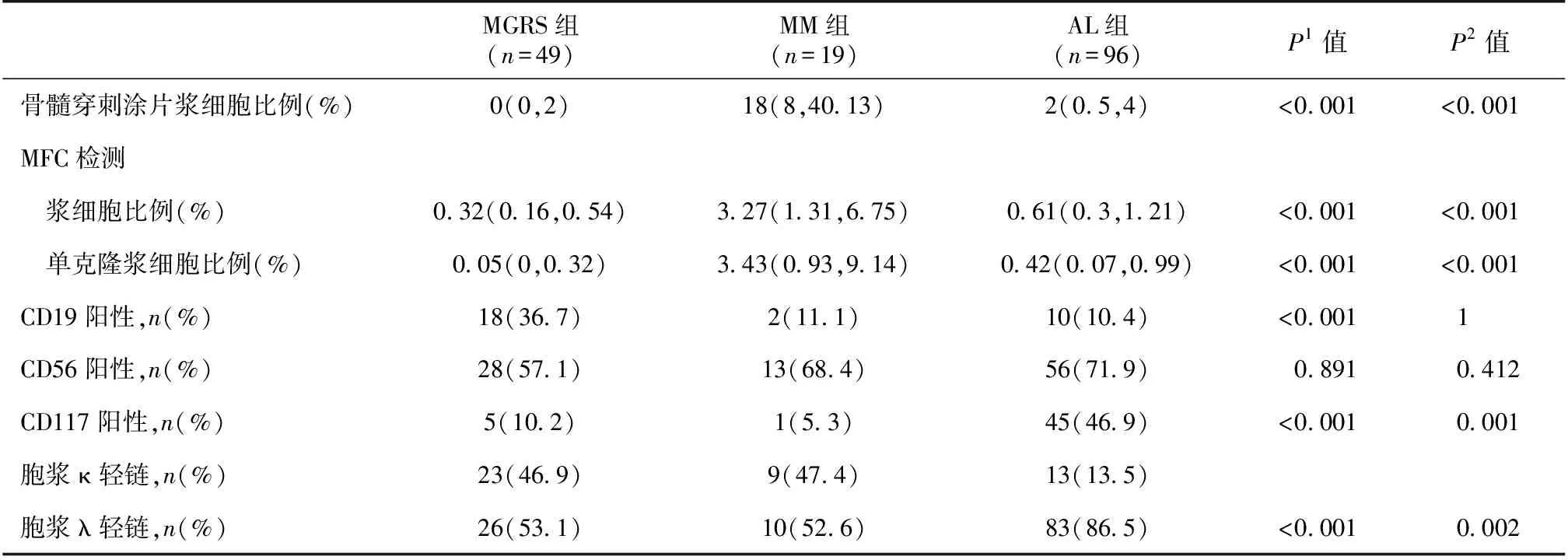
表2 3组患者浆细胞数量及单克隆浆细胞抗原表达情况
AL:系统性轻链型淀粉样变性;MM:多发性骨髓瘤;MGRS:具有肾脏意义的单克隆免疫球蛋白血症;MFC:多参数流式细胞术;P1:AL组vs非AL的MGRS组;P2:AL组vsMM组
浆细胞免疫表型特征119例AL患者中有96例(80.7%)检测出轻链限制性,其中83例(86.5%)限制性表达λ轻链,单克隆浆细胞免疫表型主要为CD19-(89.6%,86/96)、CD56+(71.9%,69/96)、CD117-(53.1%,51/96)。
与MM、MGRS相比,AL单克隆浆细胞表面CD117阳性率明显较高(P=0.001);且限制性表达λ轻链更为显著(P=0.002)(表2)。此外,与MGRS相比,AL单克隆浆细胞表达CD19的比例更低(P<0.001)。
AL患者单克隆浆细胞数量与免疫表型的相关性分析根据单克隆浆细胞表面CD19、CD56、CD117抗原分子表达情况对浆细胞数量进行分组比较,发现CD19阴性组患者MFC检测骨髓浆细胞数量为0.77%(0.42%,1.43%),明显高于CD19阳性组0.36%(0.16%,0.83%)(P=0.013)(表3)。CD56、CD117组内差异无统计学意义。
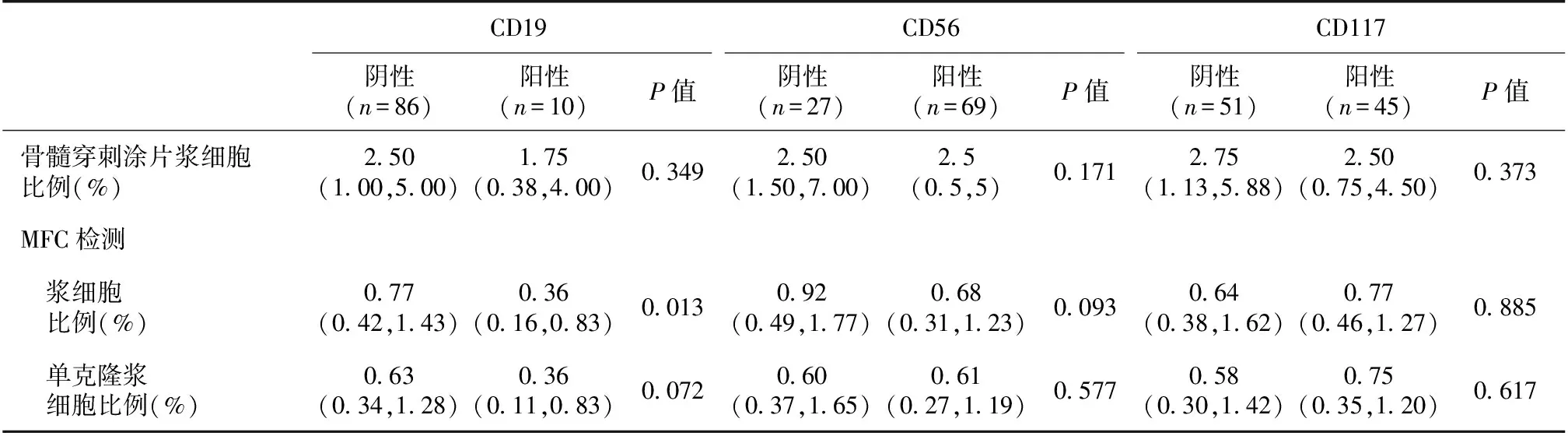
表3 AL患者单克隆浆细胞数量与免疫表型的相关性
AL:系统性轻链型淀粉样变性;MFC:多参数流式细胞术
AL疾病风险分层与浆细胞数量、免疫表型的关系根据Mayo分期系统(修订版)[8],将AL淀粉样变性患者分为Ⅰ~Ⅳ期。MFC检测单克隆浆细胞比例最高的为Ⅳ期0.98%(0.6%,1.37%),最低为Ⅱ期0.53%(0.29%,1.03%)Ⅳ期与Ⅱ期两组差异有统计学意义(P=0.033);而形态学检测四组患者骨髓浆细胞差异无统计学意义(表4)。比较单克隆浆细胞表面抗原表达情况,CD117在Ⅰ~Ⅳ期患者中的阳性率分别为61.3%、33.3%、30.8%、75%。CD117在Ⅳ期患者中阳性率明显高于Ⅱ、Ⅲ期患者(P=0.032,P=0.021);在Ⅰ期患者中比例也较高,与Ⅱ期患者相比差异有统计学意义(P=0.029)。

表4 AL患者Mayo分期(修订版)[8]与单克隆浆细胞抗原表达情况
AL:系统性轻链型淀粉样变性;MFC:多参数流式细胞术
讨 论
AL是一种浆细胞疾病,其特征是骨髓中存在一群产生κ或λ轻链的克隆性浆细胞,其过度产生错误折叠的免疫球蛋白轻链形成不溶性纤维在组织器官沉积,从而对机体造成损害[9]。单克隆浆细胞准确识别和特异性表型分析对AL淀粉样变性的疾病诊断、疗效和预后评估具有重要作用。由于异常克隆的浆细胞数量少,形态变化小,且与正常浆细胞共存,用传统的骨髓涂片形态学检测很难识别[10]。MFC免疫表型分析已经广泛应用于白血病、淋巴增殖性疾病的诊断和监测[9],在MM中有较为成熟的应用。近年来越来越多的研究关注到在MFC在AL型淀粉样变性中的潜在价值,免疫表型分析与轻链限制性检测可有效识别恶性浆细胞,辅助临床诊断。但是,目前尚缺乏大样本的研究,关于克隆性浆细胞的数据尤其是免疫表型特征的数据仍然有限,未能明确定义AL单克隆浆细胞免疫表型谱;免疫表型与患者临床特征、疾病进展风险及预后的关系有待深入探索。
本研究共收集119例AL、49例非AL的 MGRS、19例MM患者骨髓进行MFC检测。AL患者中有96例(80.7%)检测到浆细胞轻链限制性,其中83例(86.5%)限制性表达λ轻链;对比免疫固定电泳结果119例AL患者有71例(59.7%)检测到单克隆条带,MFC检测浆细胞轻链限制性灵敏度明显更高(P<0.001)。AL单克隆浆细胞免疫表型主要为CD19-(89.6%,86/96)、CD56+(71.9%,69/96)、CD117-(53.1%,51/96)。与Hu等[11]报道51例AL患者CD117阳性率为68.6%略有不同的是,本研究中CD117的阳性率仅46.9%,超过一半的患者(53.1%)骨髓单克隆浆细胞CD117为阴性。与MM、MGRS患者相比,AL患者骨髓单克隆浆细胞表面CD117的阳性率更高。CD117是具有酪氨酸激酶活性的造血生长因子受体,正常骨髓浆细胞一般不表达CD117。以往研究发现在MM中CD117阳性与良好的预后相关[12-14]。在AL淀粉样变性中,CD117是否与预后相关尚需进一步的探究。
浆细胞数量对于AL型淀粉样变性的疾病诊断和预后评估也具有重要意义。对比AL、MM、非AL的 MGRS三组间的浆细胞负荷,无论是形态学检测还是MFC检测,AL骨髓浆细胞数量高于MGRS而低于MM;MFC检测单克隆浆细胞数量同样是AL高于非AL的 MGRS而低于MM。这一结果与Diao等[15]的研究一致。此外,本研究发现单克隆浆细胞CD19表达缺失的患者骨髓浆细胞数量高于表达CD19的患者(P=0.013),提示CD19缺失的单克隆浆细胞恶性程度高于CD19阳性单克隆浆细胞。CD19是表达与B淋巴细胞及滤泡树突状细胞的表面蛋白,在B细胞成熟并最终分化为浆细胞的整个过程中都有表达[16]。CD19是B细胞受体(B cell receptor,BCR)复合体的组成之一,发挥降低B细胞分裂及分化所必需的抗原浓度阈值的作用[17]。正常浆细胞通常表达CD19,在一项685例MM的研究中发现只有4%的患者表达CD19[18]。因此,CD19可作为鉴别正常与异常浆细胞的标志。另一项研究发现在MM中CD19缺失与疾病进展相关[19]。但CD19在AL中是否与疾病进展相关尚无报道。
为进一步探究浆细胞数量、免疫表型与疾病风险分层之间的关系,本研究根据2012年Mayo分期系统对AL患者进行分组[8]。 MFC检测单克隆浆细胞数量最高的为Ⅳ期患者,揭示疾病风险等级高的患者浆细胞负荷高,且相较于数量最低的Ⅱ期患者差异有统计学意义(P=0.033);而形态学检测浆细胞数量在4组患者中未能发现统计学差异。提示通过MFC检测AL患者骨髓中单克隆浆细胞数量可预测患者的疾病风险。有趣的是,不同分期患者CD117呈现差异表达,在Ⅰ期和Ⅳ期患者阳性率较高。
本研究尚存在不足之处:(1)对照组纳入的MM病例数相对不足,在疾病间比较时可能存在偏倚;(2)仅从横断面分析浆细胞数量及表型特征,缺乏治疗后的监测;(3)对患者观察随访时间短,不同表型患者生存及预后是否存在差异尚需进一步探究。
小结:利用MFC可有效测定AL患者骨髓中浆细胞数量,识别浆细胞克隆性。对单克隆浆细胞数量的检测和免疫表型的分析在AL的诊断、鉴别诊断与疾病风险评估中具有重要意义,有极大的临床应用价值。

