荔枝核多酚纯化工艺优化研究
周秋艳 唐方华 刘展梅 彭涛 施颖杰

摘要 [目的]以荔枝核为原料,优化荔枝核多酚纯化工艺,提高荔枝多酚资源利用率。[方法]以多酚纯度以及收率为衡量指标,通过对比7种大孔树脂的静态吸附与解吸,确定纯化荔枝核多酚的最佳树脂;通过大孔树脂动态吸附与洗脱,考察吸附量、洗脱溶剂、洗脱溶剂用量、洗脱速度等因素,确定荔枝核多酚纯化的最佳工艺。[结果]筛选出大孔树脂LSA-12作为最佳纯化材料,LSA-12纯化荔枝核多酚的最佳工艺为吸附量1∶4.61(g∶mL)(总固形物∶树脂体积)、洗脱溶剂70%乙醇、洗脱溶剂用量1.5 BV、洗脱速度1.0 BV/h。在该条件下,所得荔枝核多酚平均纯度为71.98%,平均收率为80.93%。[结论]大孔树脂LSA-12纯化荔枝核多酚效果良好,该工艺可在生产中推广应用。
关键词 荔枝核多酚;纯化;大孔树脂;静态吸附与解吸;动态吸附与洗脱
中图分类号 TQ 914.1文献标识码 A
文章编号 0517-6611(2019)23-0196-03
doi:10.3969/j.issn.0517-6611.2019.23.057
开放科学(资源服务)标识码(OSID):
Study on Purification Process of Polyphenols from Litchi Seed Polyphenols
ZHOU Qiu yan1, TANG Fang hua1, LIU Zhan mei2 et al
(1.Extraction and Fermentation Laboratory of Nuspower Greatsun(Guangdong) Biotechnology Co., Ltd., Guangzhou, Guangdong 510900;2.Guangzhou Nanyang Polytechnic College, Guangzhou, Guangdong 510925)
Abstract [Objective] Using litchi seed as raw material, optimize the purification process of litchi seed polyphenols and improve the utilization rate of litchi polyphenols. [Method] Based on the purity and yield of polyphenols, the best resin for purifying litchi core polyphenols was determined by comparing the static adsorption and desorption of seven macroporous resins. Based on the dynamic adsorption and elution of macroporous resin, the adsorption process, elution solvent, elution solvent dosage and elution rate were investigated to determine the optimal process for purification of litchi seed polyphenols. [Result] The macroporous resin LSA 12 was selected as the best purification material. The optimal process for purifying litchi seed polyphenols by LSA 12 was: adsorption amount 1∶4.61(g∶mL) (total solids∶resin volume), elution solvent 70% ethanol, elution solvent 1.5 BV, elution rate 1.0BV/h. Under this optimal condition, the average purity of litchi seed polyphenols was 71.98%, and the average yield was 80.93%. [Conclusion] The macroporous resin LSA 12 has a good effect in purifying litchi seed polyphenols, and the process can be applied in production.
Key words Litchi seed polyphenols;Purification;Macroporous resin;Static adsorption and desorption;Dynamic adsorption and elution
荔枝核是我國传统的中药材,为无患子科植物荔枝(Litchi chinensis Sonn.)的成熟种子,性甘、微苦、温,归肝、肾经。现代研究表明,荔枝核含有皂甙、植物多酚、淀粉、蛋白质、脂肪酸、挥发油及矿物元素等化学成分[1],除了具有改善肝损伤作用之外[2],还具有抑制肿瘤[3-4]、抗氧化[5]、抗病毒[6]等作用,可用于治疗糖尿病及其并发症[7],以及治疗乳腺增生[8]、保护神经元[9]。多酚类化合物广泛存在于植物中,具有抗氧化、抗肿瘤、抗炎、抑菌、预防老年痴呆和心血管疾病等诸多生理活性[2]。然而,目前国内研究荔枝多酚类物质主要是集中在荔枝皮部位,关于荔枝核活性物质的研究主要集中在具有抗血糖功效的皂苷类物质上。
笔者以干燥荔枝核为原料,采用大孔树脂对荔枝核多酚类物质分离纯化工艺进行研究,旨在为建立荔枝核多酚分离纯化工艺提供理论依据,同时为拓展荔枝深加工产品领域、综合利用荔枝资源提供有效途径。
1 材料与方法
1.1 原料和试剂
“淮枝”品种荔枝核,取自广州市从化区明珠市场的荔枝整果。
没食子酸:中国食品药品检定研究院;福林酚:中国食品药品检定研究院;大孔树脂:LSA-12、XDA-8、LX-T28、LX-8、D101,西安蓝晓科技新材料股份有限公司;大孔树脂:DM21、DM28,艾美科健(中国)生物医药有限公司;95%乙醇:分析纯,天津市大茂化学试剂厂;甲醇:分析纯,天津市大茂化学试剂厂;碳酸钠:分析纯,天津市大茂化学试剂厂。
1.2 主要仪器设备
DMF-10A多功能摇摆式粉碎机(浙江省温岭市铭大药材机械设备有限公司);DMF-4B手提式高速中药粉碎机(浙江省温岭市铭大药材机械设备有限公司);2WAJ阿贝折射仪(上海仪电物理光学仪器有限公司);LT-1002电子天平(常熟市天量仪器有限责任公司);ATX224分析天平(岛津制作所);TD-5M离心机(山东博科科学仪器有限公司);SP-752PC紫外分光光度计(上海光谱仪器有限公司);5 L旋转蒸发器(上海大颜仪器设备有限公司);EXRE-2002旋转蒸发器(巩义市宇翔仪器有限公司);DHG-9240A电热鼓风干燥箱(上海一恒科学仪器有限公司);DZF-6053真空干燥箱(上海一恒科学仪器有限公司)。
1.3 荔枝核提取浓缩液的制备
新鲜荔枝核60 ℃烘8 h,粉碎至粗粉,备用→荔枝核第1次提取:温度60 ℃、70%乙醇、料液比1∶8,提取60 min;药渣第2次提取:温度60 ℃、70%乙醇、料液比1∶6,提取60 min;合并提取液→60 ℃减压浓缩至无醇→浓缩液4 000 r/min离心6 min,得荔枝核提取浓缩液,冷藏保存,备用。
1.4 繪制没食子酸标准曲线
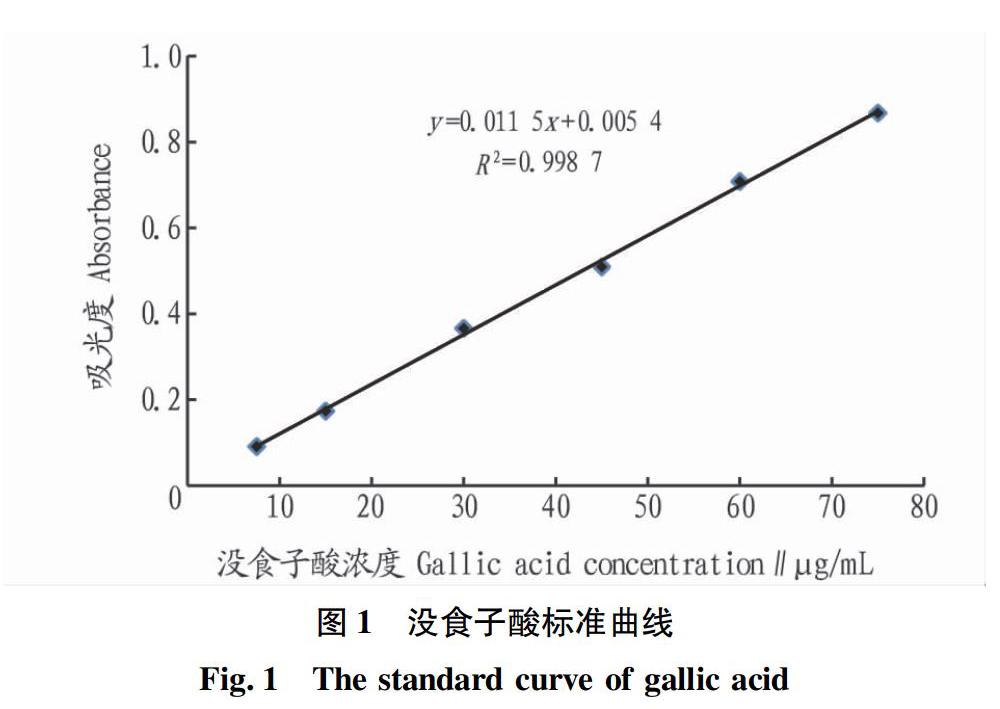
准确称取(0.110±0.010)g 没食子酸,用蒸馏水溶解,然后定容至100 mL,即为没食子酸标准储备溶液。准确量取1.0、2.0、3.0、4.0、5.0 mL标准储备溶液于100 mL容量瓶中,定容,摇匀,得浓度分别为10、20、30、40、50 μg/mL没食子酸工作液。准确量取1.0 mL没食子酸工作液于刻度试管中,分别加入5.0 mL 10%福林酚试剂,摇匀,反应3~8 min内,加入4.0 mL 7.5% Na2CO3溶液,加水定容、摇匀,室温下放置60 min,于765 nm波长下,用紫外可见分光光度计测得吸光度,绘制标准曲线。空白用蒸馏水代替没食子酸标准溶液。
1.5 多酚的检测
称取待检测样品于10 mL离心管中,加入在70 ℃中预热过的70%甲醇溶液5 mL,搅拌均匀,立即移入70 ℃水浴10 min,冷却至室温,于离心机3 500 r/min转速离心10 min,将上清液转移至10 mL容量瓶中。沉淀再加入5 mL 70%甲醇溶液,重复以上操作。合并提取液定容至10 mL,摇匀,再准确量取1.0 mL于100 mL容量瓶中,摇匀,待测。从100 mL容量瓶中准确量取1.0 mL样品溶液于刻度试管中,分别加入5.0 mL 10%福林酚试剂,摇匀,反应3~8 min,加入4.0 mL 7.5% Na2CO3溶液,摇匀,室温下放置60 min,空白用水代替样品溶液。在765 nm波长下测得样品吸光度,记录并计算样品中多酚的含量。
1.6 大孔树脂的预处理
用95%乙醇浸泡大孔树脂24 h,使其充分溶胀,之后将大孔树脂装柱,用95%乙醇冲洗,直至洗出液加适量纯化水后无白色浑浊现象出现,再用纯化水洗至无醇,即可使用。
1.7 大孔树脂的静态吸附
称取荔枝核提取浓缩液,用纯化水稀释至固形物≤5%,得稀释液,备用;将预处理好的型号为LSA-12、XDA-8、LX-T28、LX-8、D101、DM21、DM28树脂分别各取5份,每份重量为16.0 g,共计35份,分别置于250 mL锥形瓶中,然后分别加入100 mL荔枝核提取浓缩液的稀释液,于摇床中振荡吸附12 h(振速为150 r/min)后抽滤,并用纯化水冲洗树脂至抽滤液无色为止,合并同一树脂型号的抽滤液,分别向抽滤后树脂加入200 mL体积分数为70%的乙醇,振荡解吸12 h后分别收集抽滤液,检测,计算荔枝核多酚纯度和收率,确定分离纯化荔枝核多酚的大孔树脂。
1.8 大孔树脂的动态吸附
称取荔枝核提取浓缩液,用纯化水稀释至固形物≤5%,得稀释液,备用;采用大孔树脂法对荔枝核多酚进行纯化。通过静态吸附试验,将筛选出的树脂湿法装柱进行试验,确定大孔树脂吸附量,考察洗脱溶剂、洗脱溶剂用量、洗脱速度等因素对多酚纯度以及收率的影响。
2 结果与分析
2.1 没食子酸标准曲线
以没食子酸浓度(x,μg/mL)为横坐标,以吸光度(y)为纵坐标,绘制标准曲线,得标准曲线方程:y=0.011 5 x+0.005 4(R2=0.998 7),标准曲线见图1。
2.2 大孔树脂的静态吸附和筛选
7种大孔树脂对荔枝核多酚含量的影响见图2。由图2可以看出,LSA-12、LX-8、DM21、DM28的荔枝核多酚纯度较高,分别为73.00%、67.92%、60.69%、65.11%;LSA-12、XDA-8、D101、DM21、DM28的荔枝核多酚收率较高,分别为82.35%、88.59%、91.46%、92.55%。综合考虑,选择大孔树脂LSA-12进行下一步试验。

