便携式食品直链和支链淀粉速测仪的研制
谭 亮,马家麟,冀 恬,王虹蕾,王 婷,李玉林
(1.中国科学院 西北高原生物研究所 公共技术服务中心,青海 西宁 810001;2.中国科学院 西北高原生物研究所 青海省青藏高原特色生物资源研究重点实验室,青海 西宁 810001)
紫外可见分光光度计是一种历史悠久、覆盖面广、适用于多领域的分析仪器,在有机化学、生物化学、药品分析、食品检验、医药工业、环境保护和生命科学等领域的科研、生产中得到了广泛的应用[1-4]. 单波长双光束分光光度计是经单色器分光后经反射镜分解为强度相等的两束光,一束通过参比池,一束通过样品池. 光度计能自动比较两束光的强度,此比值即为试样的透射比,经对数变换将它转换成吸光度并作为波长的函数记录下来. 其优点是两束光同时分别通过参比和样品池,吸光度的大小不受入射光强度的影响,可以减少或消除因光源强度不稳定而引入的误差[5-8].
实验室目前使用的Varian Cary 300 Bio型单波长双光束分光光度计存在的主要问题是使用空白溶液作参比,因此需要在样品池中同时安装参比和样品池,增加了分光光度计的体积尺寸,不易于形成便携式小型的体积构造. 此外,根据双波长比色原理,测定食品中的淀粉时,虽然可检测得到直链淀粉、支链淀粉和总淀粉3组数据,但每个样品均需要分别测定4次两种淀粉在检测和参比波长处的吸光度(一个样品需要切换波长反复比色4次),在进行大批量样品的检测时,操作费时、效率低. 因此,我们开发研制了用于测定食品中直链和支链淀粉的便携式速测仪. 测定时直接使用设定好的直链和支链淀粉各自的检测和参比波长,只需测定两次即可得到ΔA直和ΔA支. 检测大批量样品时,节省了操作时间,检测效率得到很大的提高. 此外,无需用空白溶液作参比,没有参比池,节省出多余的空间,其体积尺寸适于设计成小型的便携式淀粉速测仪.
1 工作原理
依据等吸收双波长消去比色法原理:吸收光谱重叠的a、b两组分混合物中,若要消除b的干扰以测定a,可从b的吸收光谱上选择两个吸光度相等的波长λ1和λ2,测定混合物的吸光度差值,然后根据ΔA值来计算a的含量. 我们设计的便携式淀粉速测仪将同一光源发出的光分成两束,分别经过两个单色器后,得到两束不同波长λ1和λ2的单色光. 利用切光器或斩波器将两束光汇集成一条光路,并以一定的频率交替照射同一吸收池引起脉冲信号,然后经过光电倍增管和电子控制系统接收转化为两种波长的吸光度差ΔA,最后由显示器显示出来. 在同一吸收池中,样品溶液本身就是自己的参比对照溶液,无需再用空白溶液作参比,只需测定两次即可得到ΔA直和ΔA支,极大提高了大批量样品的检测效率. 因省去原有参比池,适于设计成小型的淀粉速测仪,便于携带并可现场快速检测. 研制前后仪器的工作原理如图1所示.
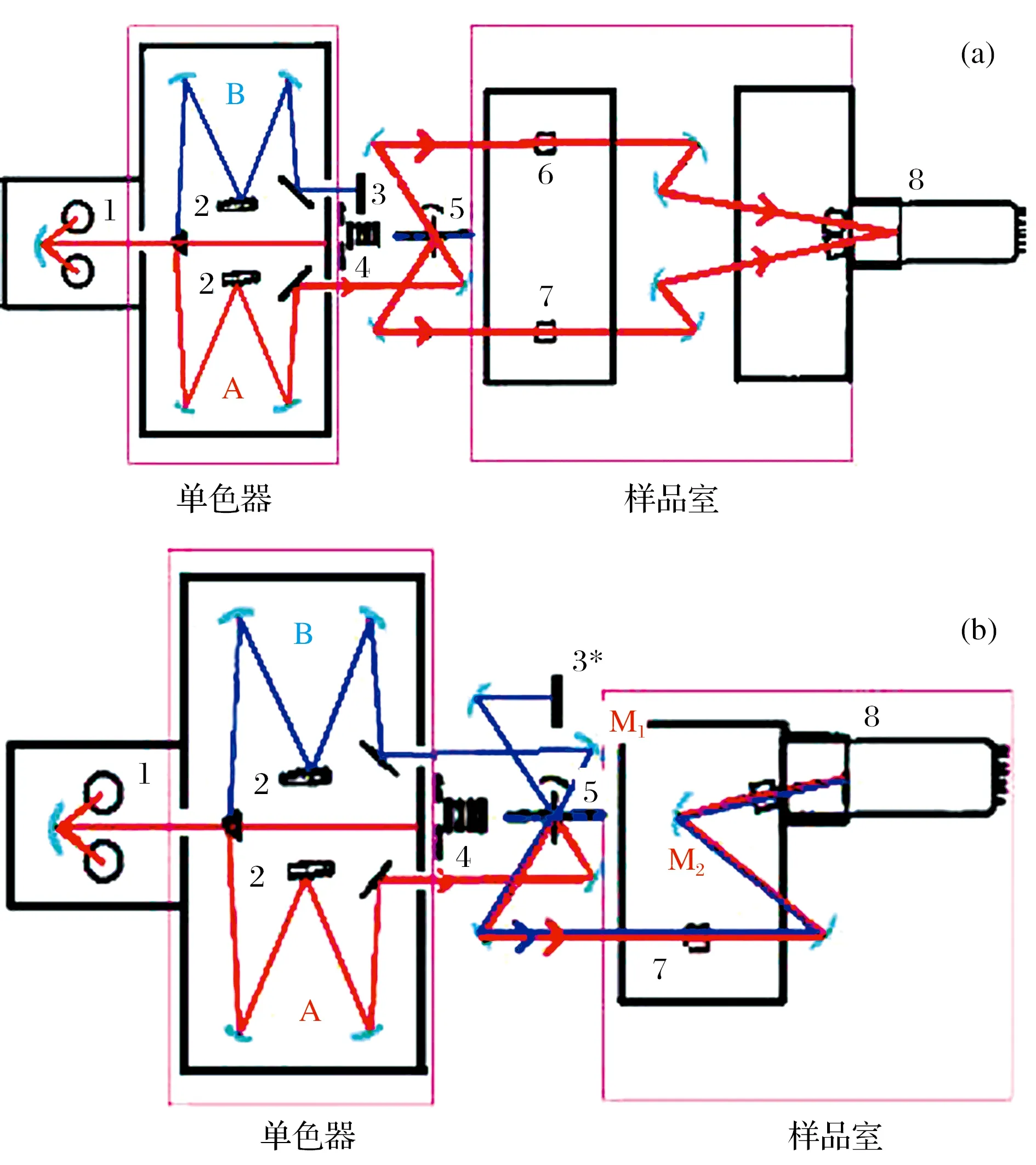
图1 实验室单波长双光束分光光度计(a)、研制的双波长分光光度计(b)工作原理图Fig. 1 Principle diagram of single wavelength and double beam spectrophotometers (a), development of dual-wavelength spectrophotometer (b)(1) 光源, (2) 光栅, (3、3*) 光闸, (4) 滤光片, (5) 斩波器, (6) 参比池, (7) 样品池, (8) 光电倍增管
2 仪器装置各模块及可实现功能
便携式食品直链和支链淀粉速测仪外观如图2所示. 整个仪器装置主要包含4个模块:(1)光路模块:包括光源、滤色片、狭缝、光栅和样品池,由主芯片STM32通过控制4台步进电机控制光路. 光源的光束经过两个单色器,经过滤光片、入射狭缝、准直镜、光栅、物镜和出射狭缝分为两束单色光之后,通过斩波器和光闸将两个单色器产生的不同波长的光线,汇集成一条光路,交替通过样品池引起脉冲信号,并被光电倍增管交替接收转化为两种波长的吸光度差ΔA. (2)检测模块:光束通过样品池后,经过光电池、放大电路和A/D转换器的转换后变为电信号并放大,其结构简单,进一步减小了仪器的体积,降低仪器成本. 将模拟电信号转换为数字信号之后输给主芯片STM32,由它实现数据处理与分析,最后的分析结果通过液晶显示屏输出,实现人机交互. (3)硬件模块:集检测模块、LCD液晶显示屏、按键扩展、RS232串口通信、打印机扩展和电池缺电自动报警(电源监控模块)于一体[9]. 该仪器具有灵活的工作电源模式,具有电池、直流电源和交流220 V三种供电方式,适合不同场合使用. 仪器本身具有电池缺电自动报警功能,防止在电池缺电的情况下,检测出不准确的结果. 此外,点击“保存”按键可以自动保存检测结果,并可将检测数据导入到电脑. 仪器可选配台式微型打印机,点击“打印”按键可实现快速自动打印检测结果. (4)软件模块:系统的软件采用C51语言编写,通信部分的PC机软件采用VC++6.0. 软件模块具有数据采集、处理、显示、打印、通信和按键等. 其中,前期工作已经采用双波长比色法确定出食品直链和支链淀粉的测定和参比波长[10],并在该仪器的研制过程中直接将波长参数集成在仪器的MCS-51系列单片机系统中,试验时无需再次进行设定,只需通过点击“选择”按键,即可切换选择直链和支链淀粉的测定,通过点击“检测”按键,即可自动在液晶显示屏上显示出直链淀粉在两个波长下的吸光度值差值ΔA直和支链淀粉在两个波长下的吸光度差值ΔA支,或者直链和支链淀粉在两个波长下的透光率差值.

图2 便携式食品直链和支链淀粉速测仪外观图Fig. 2 Appearance figure of portable speed measuring apparatus for amylose and amylopectin in food
3 应用实例
3.1 直链和支链淀粉测定和参比波长的确定
将质量浓度均为1.0 mg/mL的直链和支链淀粉标准溶液加入碘试剂显色后的,吸收曲线叠加于同一个坐标系里(450~900 nm),如图3所示. 依据溶液中某溶质在两个波长下均有吸收,则两个波长的吸收差值与该溶质浓度成正比的原理,通过等吸收双波长消去法确定两种淀粉各自的测定和参比波长. 当测定直链淀粉含量时,选择直链淀粉吸收峰波长λ2作为测定波长,在这一波长位置作x轴的垂线,此直线与干扰组分支链淀粉的吸收光谱相交于某一点(吸光度为A支2),再从该点作一条平行于x轴的直线,此直线又与支链淀粉的吸收光谱相交于等吸收点(吸光度为A支1,A支1=A支2),则选择该交点相对应的波长λ1作为直链淀粉的参比波长,从而消除在测定波长λ2处支链淀粉对直链淀粉含量测定的干扰. 同理,当测定支链淀粉含量时,选择支链淀粉吸收峰波长λ4作为测定波长,在这一波长位置作x轴的垂线,此直线与干扰组分直链淀粉的吸收光谱相交于某一点(吸光度为A直4),再从该点作一条平行于x轴的直线,此直线又与直链淀粉的吸收光谱相交于等吸收点(吸光度为A直3,A直3=A直4),则选择该交点相对应的波长λ3作为支链淀粉的参比波长,从而消除在测定波长λ4处直链淀粉对支链淀粉含量测定的干扰.
由试验结果可知:直链淀粉的测定和参比波长分别为λ2=563 nm和λ1=511 nm,支链淀粉的测定和参比波长分别为λ4=542 nm和λ3=722 nm.
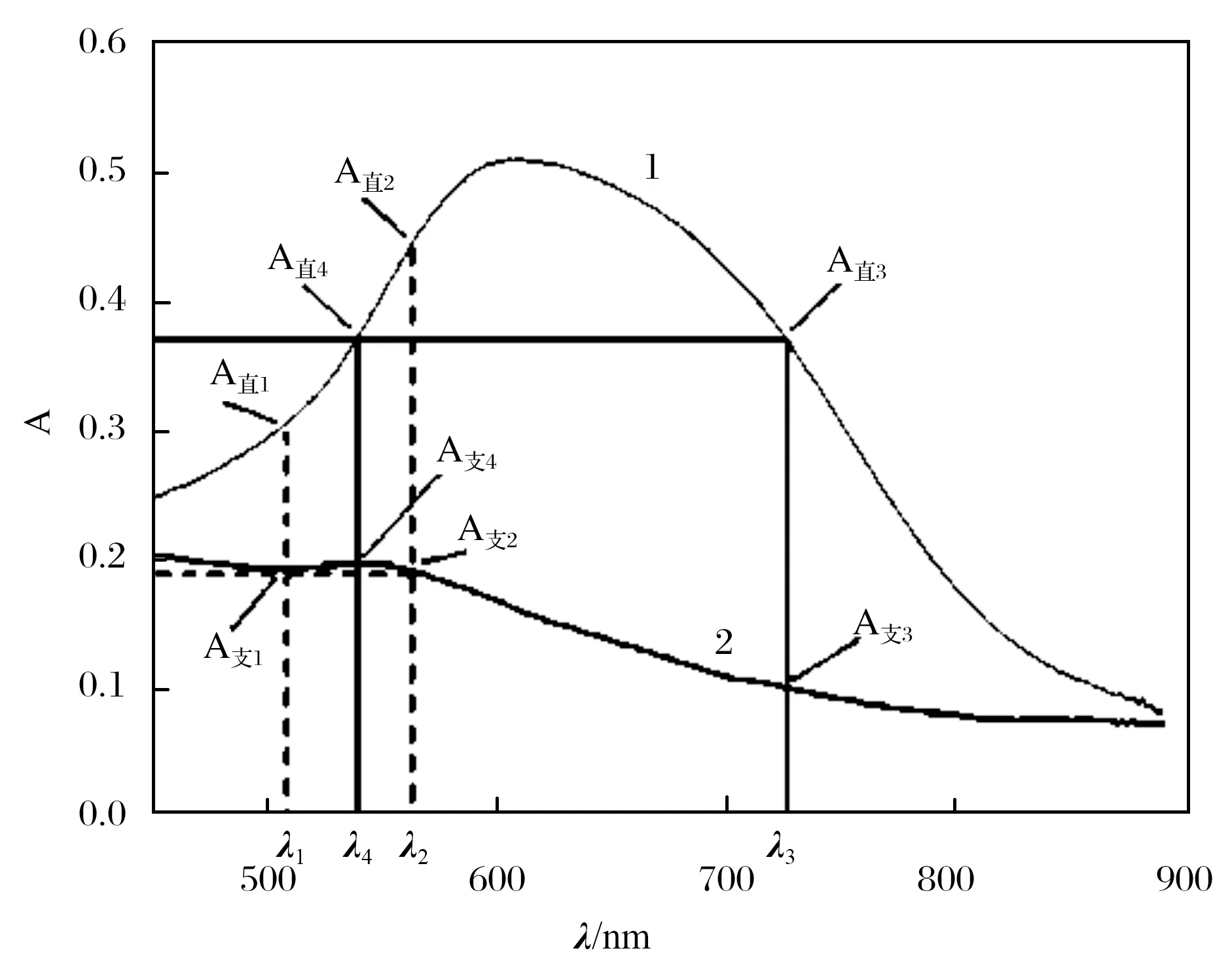
图3 直链和支链淀粉吸收曲线叠加扫描图(450~900 nm)Fig. 3 Superposition of scanning spectrum of absorption curve of amylose and amylopectin (450~900 nm)(1) 直链淀粉吸收曲线, (2) 支链淀粉吸收曲线
3.2 方法学验证
3.2.1 线性关系考察
直链淀粉双波长标准曲线:准确移取质量浓度为0.990 1 mg/mL的直链淀粉标准溶液0.2、0.3、0.4、0.5、0.6 mL,分别置于6个25 mL容量瓶中,加入15 mL蒸馏水,并以浓度为1 mol/L的冰乙酸溶液调节pH为3.5,然后加入0.25 mL碘试剂,再加蒸馏水定容至25 mL,摇匀,静置15 min后,以两吸光度差值即ΔA直=Aλ2-Aλ1=A563 nm-A511 nm为纵坐标,直链淀粉质量(m)为横坐标,绘制直链淀粉双波长标准曲线,如图4所示. 由图4可知,直链淀粉的质量在0.198~0.594 mg范围内呈良好的线性关系,回归方程为y=0.309 9x-0.016 5,R2= 0.999 1.

图4 直链淀粉双波长标准曲线Fig.4 Dual-wavelength standard curve of amylase
支链淀粉双波长标准曲线:准确移取质量浓度为0.999 5 mg/mL的支链淀粉标准溶液0.5、1.0、1.5、2.0、3.0 mL,分别置于6个25 mL容量瓶中,按照“3.2.1”所述步骤进行,以两吸光度差值即ΔA支=Aλ4-Aλ3=A542 nm-A722 nm为纵坐标,支链淀粉质量(m)为横坐标,绘制支链淀粉双波长标准曲线,如图5所示. 由图5可知,支链淀粉的质量在0.50~3.00 mg范围内呈良好的线性关系,回归方程为y=0.136 6x- 0.019 9,R2=0.999 5.

图5 支链淀粉双波长标准曲线Fig. 5 Dual-wavelength standard curve of amylopectin
3.2.2 精密度
准确移取一份已制备好的淀粉提取液(采自青海玉树的四长二短芒白青稞)1.0 mL置于25 mL容量瓶中,按照“3.2.1”所述步骤进行,于511、542、563、722 nm 4个波长处重复测定吸光度A511 nm、A542 nm、A563 nm、A722 nm共6次,计算直链和支链淀粉含量的RSD值,确定检测精密度. 测定结果:青稞淀粉提取液中直链和支链淀粉含量的RSD分别为0.62%和0.45%,表明检测精密度良好.
3.2.3 稳定性
准确移取一份已制备好的淀粉提取液(采自青海玉树的四长二短芒白青稞)1.0 mL置于25 mL容量瓶中,按照“3.2.1” 项下所述步骤进行,室温下放置,于511、542、563、722 nm 4个波长处每隔1 h测定吸光度A511 nm、A542 nm、A563 nm、A722 nm各一次,计算直链和支链淀粉含量的RSD值,确定检测溶液的稳定性. 结果表明青稞淀粉测定液在12 h内稳定性良好,直链和支链淀粉含量的RSD分别为1.1%和1.3%.
3.2.4 重复性
准确移取5份已制备好的同一淀粉提取液(采自青海玉树的四长二短芒白青稞)各1.0 mL置于5个25 mL容量瓶中,按照“3.2.1” 所述步骤进行,于511、542、563、722 nm 4个波长处测定吸光度A511 nm、A542 nm、A563 nm、A722 nm,计算直链和支链淀粉含量的RSD值,确定检测重复性. 结果青稞淀粉提取液中直链和支链淀粉含量的RSD分别为1.5%和1.8%,结果表明检测重复性良好.
3.2.5 回收率
采用加样回收法,称取已粉碎过250 μm孔径筛并且已知直链和支链淀粉含量的青稞样品(采自青海玉树的四长二短芒白青稞)粉末9份,每份50 mg(准确至±1 mg),分别按低、中、高浓度精密加入直链淀粉(0.990 1 mg/mL)和支链淀粉标准溶液(5.005 mg/mL)2.5、5.0、7.5 mL,每一浓度3份,按照“3.2.1” 所述步骤进行,于511、542、563、722 nm 4个波长处测定吸光度A511 nm、A542 nm、A563 nm、A722 nm,计算直链和支链淀粉含量的平均回收率和RSD值,确定检测的回收率. 结果如表1、2所列. 由表1、2可见,直链和支链淀粉含量的平均回收率分别为91.14%和91.73%,RSD分别为1.70%和2.25%,表明检测具有良好的准确性.

表1 直链淀粉回收率试验结果(n = 9)Table 1 Results of recovery test of amylose (n = 9)
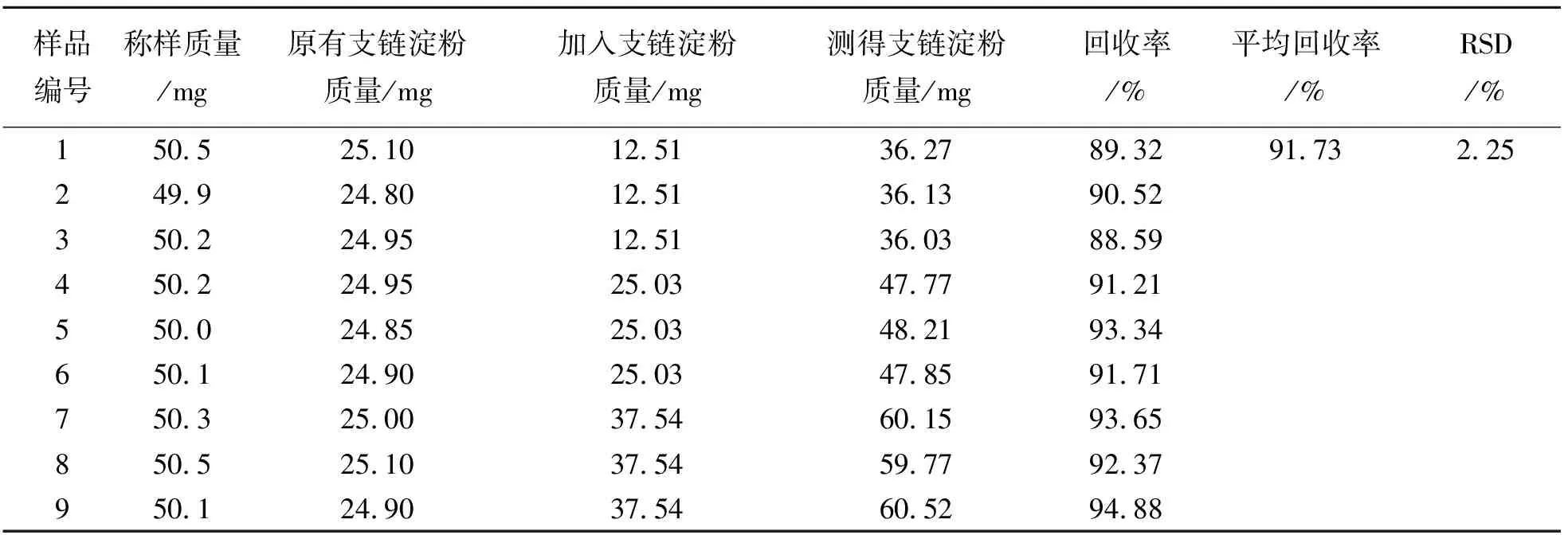
表2 支链淀粉回收率试验结果(n = 9)Table 2 Results of recovery test of amylopectin (n = 9)
3.2.6 定量限和检出限
依据ICH指导原则中Q2(R1)分析方法的验证方法学内容,根据一定量空白响应的标准偏差(σ)和被测物标准曲线的斜率(S)来计算定量限(QL=10×σ/S)和检出限(DL=3.3×σ/S). 通过绘制直链和支链淀粉双波长标准曲线以确定斜率S,另准确移取10份1.0 mL不加样品的提取液作为空白对照溶液,于511、542、563、722 nm 4个波长处测定吸光度A511 nm、A542 nm、A563 nm、A722 nm,求出这10份空白对照溶液响应值的标准偏差σ,结果如表3、4所列.
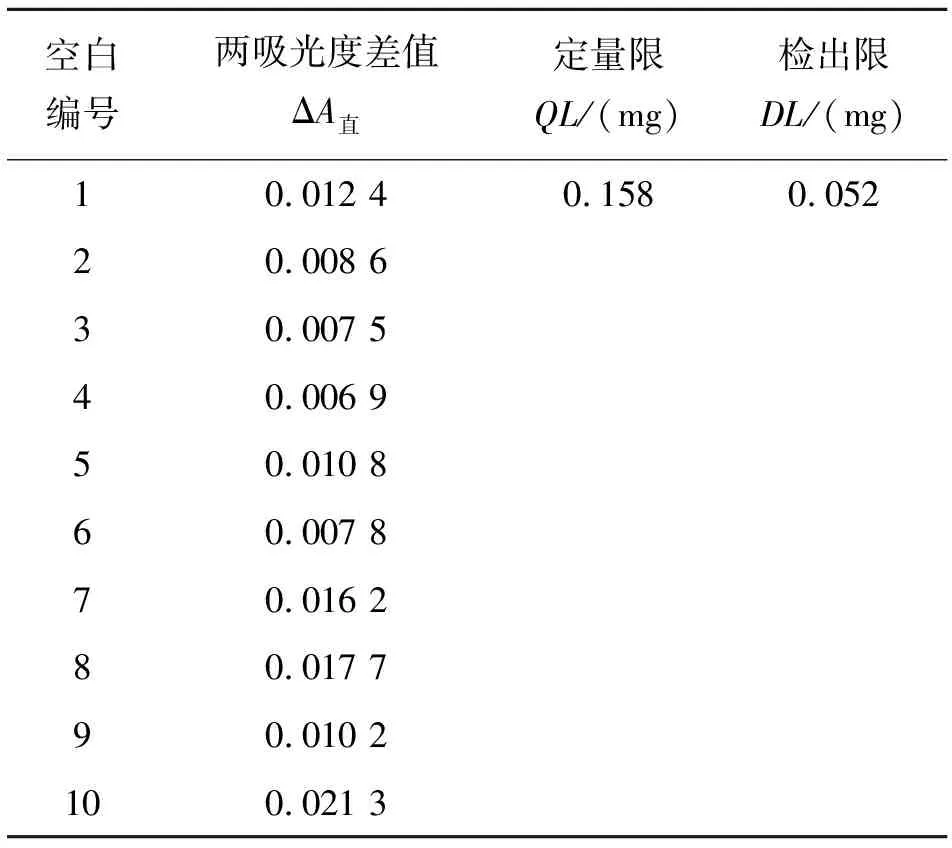
表3 直链淀粉定量限和检出限试验结果(n = 10)Table 3 Results of quantitative limit and detection limit test of amylose (n = 10)

表4 支链淀粉定量限和检出限试验结果(n = 10)Table 4 Results of quantitative limit and detection limit test of amylopectin (n = 10)
3.3 青稞中直链和支链淀粉的含量测定
将粉碎过250 μm孔径筛的青稞粉末100 mg置于25 mL容量瓶中,加入0.5 mL无水乙醇,涡旋以润湿样品. 加入1.0 mL质量浓度为1.0 mol/L的氢氧化钠溶液,涡旋混匀后置沸水浴中加热2 min,再取出涡旋30 s,如此重复3~5次后冷却至室温,定容至25 mL,摇匀,过滤,制得淀粉提取液. 准确移取淀粉提取液1.0 mL置于另一25 mL容量瓶中,分别加入15 mL蒸馏水,并以浓度为1 mol/L的冰乙酸溶液调节pH为3.5,然后加入0.25 mL碘试剂,再加蒸馏水定容,摇匀,制得淀粉测定液. 静置15 min后,分别测定两吸光度差值即ΔA直和ΔA支,并分别在直粉、支链淀粉双波长标准曲线上,查得两种淀粉测定液各自的两吸光度差值所对应的淀粉质量,分别计算出青稞中直链和支链淀粉的含量,二者之和为青稞总淀粉含量,结果如表5所列. 直链和支链淀粉及总淀粉的含量(以干基计,按GB/T 20264、GB/T 21305测定水分)的质量分数ω,分别按式⑴、式⑵、式⑶进行计算:
(1)
(2)
ω=ω1+ω2
(3)
式中:ω1—青稞中直链淀粉(以干基计)的含量,单位为克每百克(g/100g);ω2—青稞中支链淀粉(以干基计)的含量,单位为克每百克(g/100g);ω—青稞中总淀粉(以干基计)的含量,单位为克每百克(g/100g);m1—从双波长直链淀粉标准曲线上查得供试品溶液中直链淀粉质量,单位为毫克(mg);m2—从双波长支链淀粉标准曲线上查得供试品溶液中支链淀粉质量,单位为毫克(mg);V1、V2—移取制备直链和支链供试品溶液体积,单位为毫升(mL);V—样品显色定容总体积,单位为毫升(mL);m—试样的质量,单位为毫克(mg);wm—试样的含水量,%.
每个样品取两个平行样进行测定,以其算术平均值作为测定结果,保留小数点后1位. 在重复条件下两次独立测定结果的绝对差值不得超过算术平均值的5%.
由表5可见,青海境内青稞中支链淀粉含量均高于直链淀粉含量,约高出5.4倍. 来自青海称多的湟源蓝青稞总淀粉含量最高为75.4 g/100g DW,来自青海玉树的长芒白青稞总淀粉含量最低为64.0 g/100g DW.
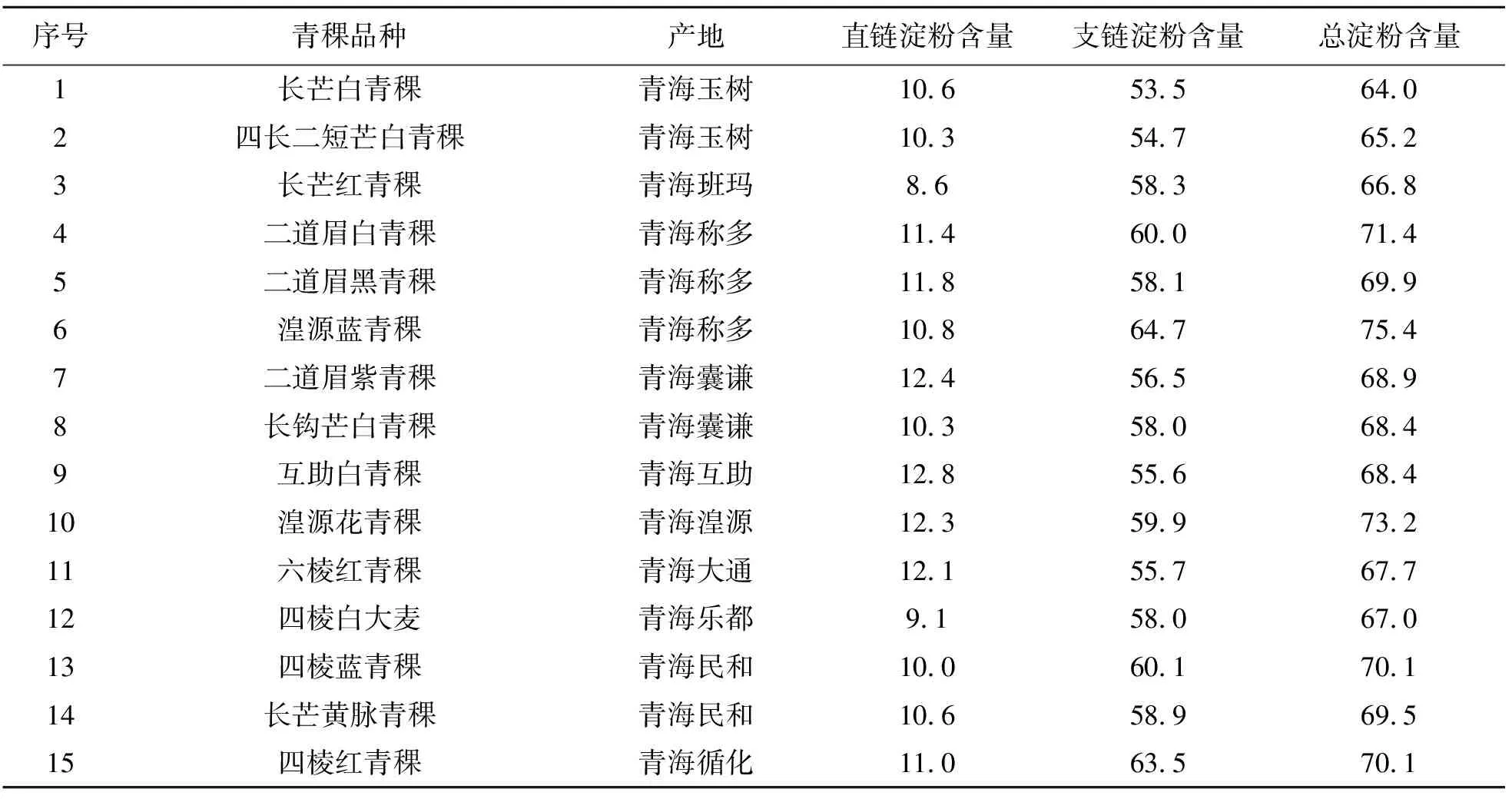
表5 青海境内不同产地和品种青稞中直链和支链淀粉的含量结果(n = 3)Table 5 Determination results of amylose and amylopectin in hullessbarley samples collected from different habitats and varieties in Qinghai (n = 3) /(g/100 g DW)
3.4 不同设备检测比对验证
中国科学院西北高原生物研究所分析测试中心实验室抽检了一种青稞样品(来自青海玉树的长芒白青稞,由青海大学农牧科学院送检). 分别使用研制的便携式食品直链和支链淀粉速测仪和目前分析测试中心实验室使用的Varian Cary 300 Bio型单波长双光束分光光度计测定此样品中直链和支链淀粉的含量,以进行不同设备检测之间的比对验证试验,每台设备均测定6次,以确定检测结果的重现性,结果如表6所列. 由表6可见,不同设备检测结果的RSD在0.58%~1.79%之间,不同设备之间检测直链和支链淀粉的RSD分别为3.30%、2.21%,结果表明使用所研制设备的检测系统适用性良好.

表6 使用不同设备测定的青稞中直链和支链淀粉含量(n = 3)Table 6 Determination results of amylose and amylopectin in hullessbarley samples using different equipments (n = 3) /(g/100 g DW)
3.5 实验室间比对验证
中国科学院西北高原生物研究所分析测试中心实验室抽检了二种青稞样品(分别来自青海湟源的湟源花青稞和青海玉树的长芒白青稞,由青海大学农牧科学院送检),统一制备,进行这二种青稞样品中直链和支链淀粉的含量测定,同时发送至中国科学院西北高原生物研究所生态中心实验室和青海省水文地质工程地质环境地质调查院检测实验室进行实验室间比对验证试验,每个实验室均测定6次,以确定研制的便携式食品淀粉速测仪与其他实验室设备检测的重现性,结果如表7~9所列. 由表7~9可见,实验室内检测结果的RSD均低于2.5%,不同实验室间(均与中国科学院西北高原生物研究所分析测试中心实验室比较)检测结果的RSD均低于4.2%,结果表明使用所研制设备的检测系统适用性良好,检测具有良好的重现性.

表7 分析测试中心实验室测定的二种不同青稞中直链和支链淀粉含量(n = 3)Table 7 Determination results of amylose and amylopectin in two different hullessbarley samples by Laboratory of Analytical Testing Center (n = 3) /(g/100 g DW)
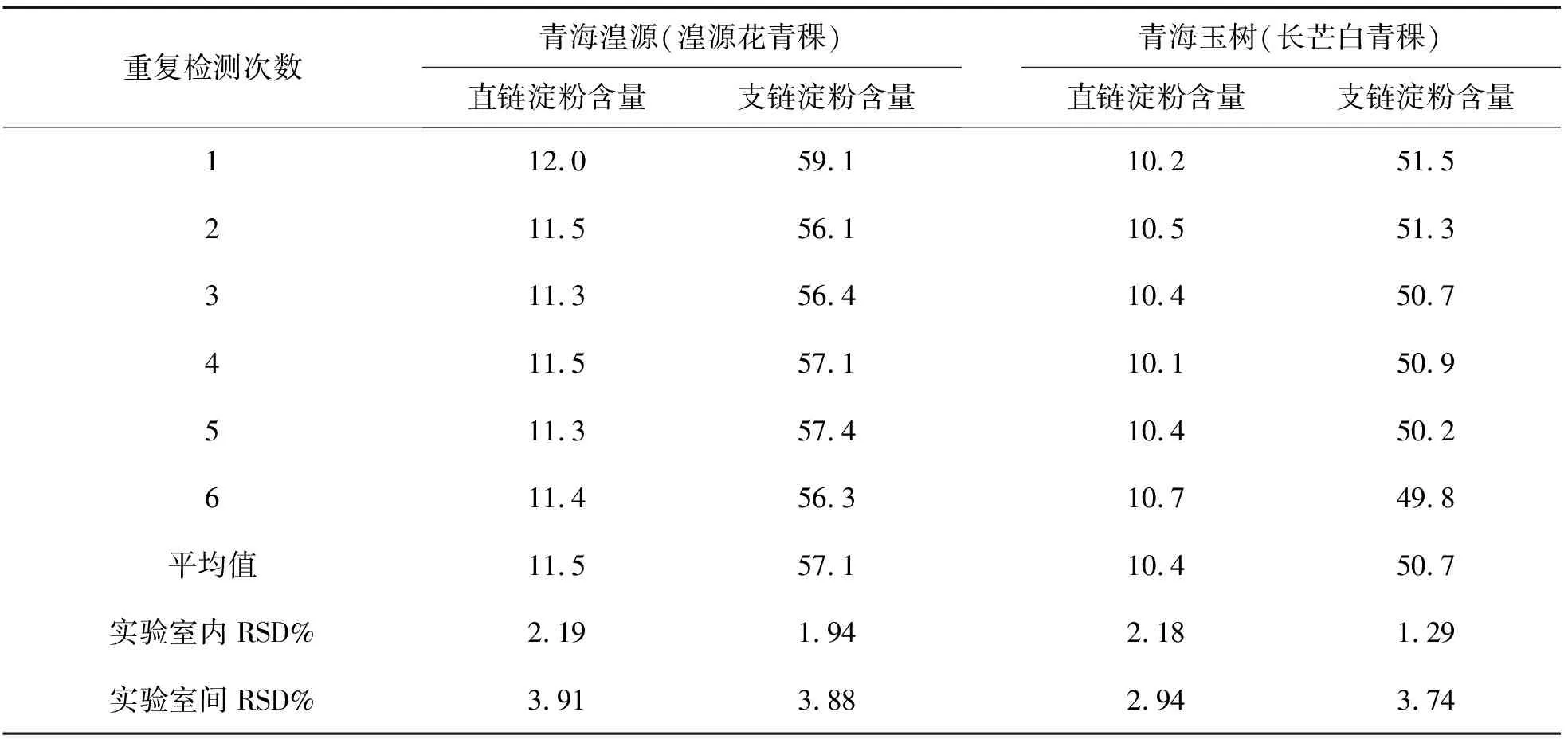
表8 1#实验室测定的二种青稞中直链和支链淀粉含量(n = 3)Table 8 Determination results of amylose and amylopectin in two different hullessbarley samples by Lab #1 (n = 3) /(g/100 g DW)
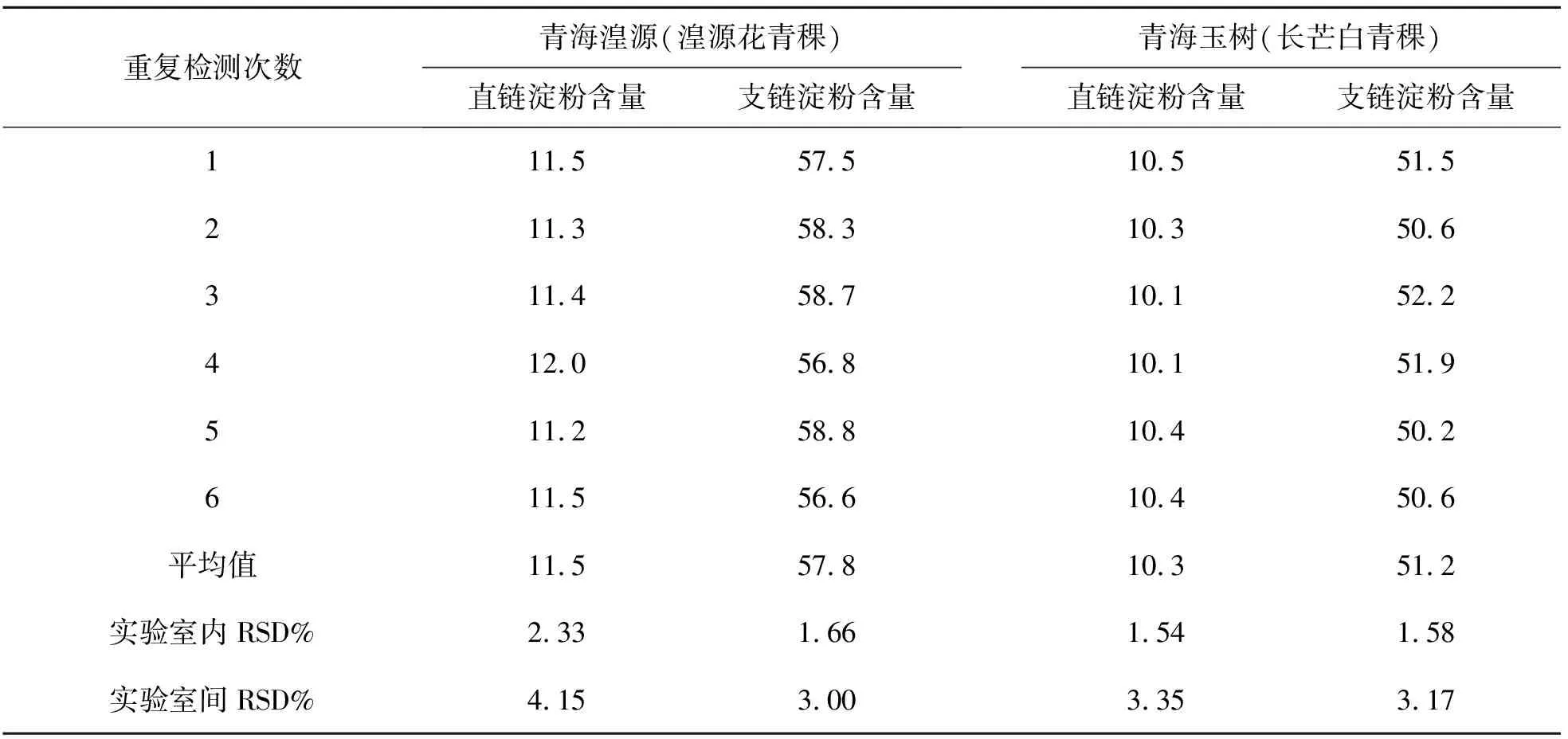
表9 2#实验室测定的二种青稞中直链和支链淀粉含量(n = 3)Table9 Determination results of amylose and amylopectin in two different hullessbarley samples by Lab #2 (n = 3) /(g/100g DW)
4 结论
研制的便携式食品直链和支链淀粉速测仪是一款小型、便于携带的双波长分光光度计. 依据等吸收双波长消去法原理,确定直链淀粉的测定和参比波长分别为563 nm和511 nm,支链淀粉的测定和参比波长分别为542 nm和722 nm. 验证试验结果表明:使用研制的便携式食品直链和支链淀粉速测仪进行两种淀粉含量检测,其线性关系良好,检测过程简单、快速、准确,测定时只在同一吸收池中比色,样品溶液本身又是自己的参比对照溶液,无需再用空白溶液作参比,只需测定二次即可得到ΔA直和ΔA支,提高了样品的检测效率,为方便、快速、准确地检测大批量样品中两种淀粉提供了技术支撑,具有很强的应用推广价值.

