粪菌低温保存的研究进展
(1 上海理工大学生物系统热科学研究所 上海 200093) 2上海交通大学医学院附属新华医院环境与儿童健康教育部和上海市重点实验室 上海 200092)
近年来,宏基因组测序技术和生物信息学的发展使人类进一步认识了肠道菌群。肠道菌群对炎症[1]、代谢性疾病[2]、肥胖[3]、精神障碍[4]等疾病有重要影响,研究相关微生物组成和变化有助于预防、诊断并最终治愈多种疾病。粪便采集为肠道菌群的研究提供了一种非侵入性采样方法,广泛的用于宏基因组研究。过去10年,关于粪便微生物与人类健康的双向关系取得了很多研究成果[5]。
粪菌移植和疾病科学研究的需求推动了粪菌库的建设。然而,粪便样本采集后,储存和运输的最佳条件仍然不明确。通常,粪便样本需要在-20 ℃或更低温度下冷冻储存,然后通过冷链转移到实验室。但是这种操作在偏远的野外地区或一些欠发达地区不易实现,还可能大幅增加成本,于是人们开始研究干燥保存等其他方式,保存效果因物种、样本暴露的温度和时间等不同而变化[6]。
本文阐述了低温保存微生物及细胞的相关机制,总结了粪菌保存的主要作用,回顾了关于粪菌采集和保存方法的研究成果,研究影响其保存效果的主要因素,并对未来粪菌保存的可行方法和研究方向进行展望,希望能有助于研究人员建立更合理的保存方案。
1 低温保存的机制
1.1 低温损伤
低温保存在活细胞和组织中的应用彻底改变了生物及医学领域。在生物和医学中,低温范围比较广,可以从稍低于正常体温(37 ℃)直到-196 ℃。成功的低温保存需要在超低温下冷冻细胞,在冷冻过程中水转变为冰所带来的生物和物理变化是造成损害的主要原因,而并非低温本身。P. Mazur等[7]提出了冷冻损伤的“两因素假说”,即“溶液损伤”和“胞内冰损伤”。刘威等[8]详细讨论了关于胞内冰形成的主要机制。这两类损伤不仅会造成细胞形态和功能的改变,还会使胞内生物大分子(如DNA、RNA、蛋白质和脂类等)降解或突变,造成细胞的无效保存[9]。
综合两方面的因素,必然存在最佳冷却速率,表征细胞的最佳存活率。冷冻保存技术可分为两类:程序法慢速冷冻和玻璃化保存,如图1所示。

图1 细胞存活率与冷却速率的关系
1.2 低温保护剂的作用机理
低温保存是生物样本长期保存的重要方法,而低温保护剂(cryoprotectant,CPA)可以保护细胞免受渗透损伤,维持细胞的正常结构和功能,并对生物大分子产生一定保护作用[9]。S. Sariözkan等[10]将大鼠的精子冷藏保存在4 ℃,发现棉子糖、海藻糖和果糖有助于保护精子的运动性、形态和DNA完整性。J. Botling等[11]认为RNAlater试剂能更有效地阻止冻存样本的RNA降解,保持生物大分子的完整性。
按保护剂是否能进入细胞内,可将其分为渗透型和非渗透型两种。常用的渗透型保护剂有甘油、乙二醇、二甲基亚砜、乙酰胺等。这类保护剂多属低分子物质,在溶液中易结合水分子,发生水合作用,增加溶液黏性,弱化水的结晶过程[12]。保护剂可以替代胞外电解质渗透入细胞,当细胞外冻结时,能够减轻细胞皱缩程度,减小渗透肿胀,从而降低冻融对细胞的伤害[13]。非渗透型保护剂包括糖类和一些大分子物质(葡聚糖、聚乙二醇、聚乙烯醇等)。这类物质能溶于水,但不能进入细胞。其加入到溶液后可使溶液呈过冷状态,抑制冰晶形成,降低特定温度下的电解质浓度,从而起到保护作用。
还有一些天然的保护剂,如冰成核剂(ice-nucleating agents,INA)和抗冻蛋白(anti-freeze proteins,AFP)[14]。冰成核剂可以控制冰的形成位置,在合适的位置适度促进冰的形成,耐冷性林蛙(rana sylvatica)血浆中的蛋白质已被证明具有INA特性[15]。AFP能保证某些物种在零下温度的环境中生存。不像其他的保护剂,AFP以非依数性的方式迟滞水溶液的冰点,而不影响其熔点,其活性取决于冰点和熔点的差值大小。AFP能够抑制冰晶的生长是依靠一种吸附-抑制机制,可与特定表面的冰晶结合,从热力学和动力学角度而言,均不利于冰晶生长。AFP还能维持细胞膜的稳定性,有助于抑制复温过程的重结晶。因此,在低温保存中将AFP结合其他保护剂一起使用意义重大。“阻冰”的概念启发人们寻找能够发挥这种功能的合成化合物,如R. C. Deller等[16]发现聚乙烯醇有类似的作用,这类保护剂可能在未来具有更广泛的研究和应用价值。
2 粪菌的低温保存
2.1 粪菌低温保存的应用
2.1.1 临床应用——粪菌移植
粪菌移植(fecal microbiota transplantation,FMT)是将健康人的粪便处理为混悬液状态,以某种途径移植到患者胃肠道内,利用正常粪便中的功能菌群,在患者体内重建具有多样性的肠道菌群,对肠道及肠道外的疾病实现有效诊疗[17]。近几年FMT已成为生物医学和临床医学的研究热点。
肠道菌群异常是导致各种肠道疾病的重要原因。严重的肠道细菌感染一般均使用抗生素治疗,但当所有可用的抗生素都无济于事时,粪菌移植可能是唯一的希望。FMT成为医学突破,不是技术或理论的突破,而是认识的突破[18]。FMT治疗复发性艰难梭菌感染(clostridium difficile infection,CDI)已被列入《临床诊疗指南》[19]。最近一项研究显示,FMT对于CDI的总体治愈率可达92%[20],其有效性和安全性在进一步研究中得到了证实[21-22]。
许多研究揭示了FMT在治疗炎症性肠病[23]、肠易激综合征[24]、便秘[25]、代谢综合征[26]等疾病中的潜在治疗价值。
FMT推荐使用新鲜粪菌液,但在临床应用中通常无法随时随地获得新鲜健康的样本,为了进行异地治疗或延长粪菌的有效期,有必要提前对其进行采集和保存。如何实现粪菌的有效储存,如今还面临较大的挑战[27]。将粪菌冷冻于-80 ℃是常用的技术方法之一。Jiang Z. D. 等[28]对患者进行相同供体的FMT时,发现新鲜菌液和冷冻菌液的有效性相似,而与新鲜样本相比,冻干样本的功效略低。因此,粪菌的保存方法是影响FMT临床治疗效果的重要因素之一。
2.1.2 科学研究
保存的粪菌除了可用作临床治疗外,在人类生命健康的研究中也有重要作用。粪便样本广泛用于宏基因组研究,旨在阐明人类健康与肠道微生物群之间的关系[29];在大规模流行病学研究中,用有效的手段保存粪便样本,进行微生物群落分析,从而展开前瞻性研究[30];在非靶向性代谢组学分析中,粪便样本也有普遍的应用价值[31]。
粪菌还可用于评估野生动物的健康,研究宿主和环境之间的相互作用。包括粪便类固醇激素分析[32]、寄生虫检测[33]和种群的遗传相关性[34]等。但常见的保存方法(如-80 ℃下冷冻)不适用于野外采集。因此许多研究都在优化野生动物的粪便保存方案,表明新型保存方法的探索是未来的研究方向之一。
2.2 粪菌的低温保存方法
影响粪菌有效性的因素较多,如样本的收集、运输、均质化[35]、保存和二次取样等。为了满足临床应用及科研需求,保持菌种的优良特性非常重要,这就需要长期保持菌种不发生变异,即菌种的形态、遗传特性、功能等不发生改变。在微生物的众多保存方法中,冷冻保存法和冷冻干燥保存法是公认的长期保存微生物菌种最安全、可靠的方法[36]。粪菌的低温保存方法可分为4类:冷冻保存、冷冻干燥保存、冷藏保存、其他非低温保存。
2.2.1 冷冻保存
冷冻保存一般是将均质化后的等分粪便试样置于-196 ℃(液氮)、-80 ℃或-20 ℃的环境中进行保存。这种方法通常被视为微生物的“黄金保存法”[37],因为低温可有效抑制微生物生长,并保持较高的DNA浓度。
液氮超低温保存法已成功应用于乳酸菌、酵母菌、微型藻类和原生动物等生物体的保存[36]。乳酸菌是粪便样本中的主要菌群之一,其保存效果对样品的保存有直接影响。F. Fonseca等[38]首次研究了冷却速度和保存温度对乳酸菌活性的影响,发现以甘油作为保护剂,乳酸菌以任何冷却速率保存时,胞内均无冰晶形成,将其直接浸入液氮中获得的高冷却速率会使细胞活力的损失降到最低。因此液氮保存是一种有效的方法,但目前关于粪菌液氮保存的具体研究还较少。
冷冻保存粪菌样本的目的有两个:1)为了保存菌种的活性;2)保存样本中稳定的DNA或其他生物标志物。第一个目的可用于FMT以替代新鲜粪菌,解决异地治疗的问题。Tang Guihua等[39]证明了在复发性或难治性CDI患者中,冷冻FMT与新鲜FMT一样有效。S. P. Costello等[40]研究发现,用于治疗复发性艰难梭菌感染的粪菌微生物可以安全地在10%甘油中冷冻储存至少6个月,而不会失去临床功效或活力,第一次FMT对于复发性艰难梭菌感染的治愈率为88%,病症复发后的再次FMT治愈率为100%。第二个目的用于各种科学研究。F. Fouhy等[41]将新鲜分离的粪菌在干冰上快速冷冻或在-80 ℃下冷冻7 d,然后提取DNA并与新鲜样本对照,发现种群分布没有显著差异,快速冷冻的样本保持了微生物群落的完整性。
一些研究也将用于细胞的传统低温保护剂应用于粪菌的低温保存中,比较常用的是甘油。M. Aguirre等[42]将制备的人粪便样本重悬在含有甘油的保护剂中,然后在-80 ℃下储存,结果与新鲜粪便样本的细菌代谢活性和微生物群落分布高度一致,并建议将冷冻后的粪便物质作为新鲜粪便替代物用于体外发酵研究。K. R. Horng等[43]使用甘油与磷酸缓冲盐溶液保存样本,发现在-80 ℃保存时能够明显提高样本DNA浓度和香农多样性指数。F. M. Kerckhof等[44]使用3种低温保护剂(二甲基亚砜(dimethyl sulfoxide,DMSO)、DMSO+海藻糖和DMSO+胰蛋白酶大豆肉汤)对样本进行的-80 ℃超低温保存,发现粪便中微生物的活性没有因为CPA的添加而增大,但是这种方法能够保持较好的群落结构(通过基因测序确定)。
除了传统保护剂外,还有很多特殊保护剂的组合能够实现样本在略高温度(-20 ℃)下稳定保存。Qiao Ying等[45]开发了一种使用天然深共晶溶剂(natural deep eutectic solvents,NADES)冷冻保存乳酸菌的新方法,研究了在-20 ℃下,24 h短期和180 d长期低温保存期间乳酸菌的存活率,证明了由甘油和L-脯氨酸制备的NADES 能提高细胞膜结构的完整性并有效(P<0.05)维持嗜热链球菌内两种酶的活性。可见对于微生物的保存还有很多保护剂待开发,将一些新型高效的保护剂用于粪菌保存可能会有更好的效果。
2.2.2 冷冻干燥保存
冷冻干燥保存法利用了干燥、低温和隔绝空气的条件,降低微生物新陈代谢的速度,使细胞的生命活动处于半永久性休眠状态,可以长时间保存且避免细菌的污染和变异。L. Bircher等[46]定量对比了冷冻和冻干保存的效果以及保护剂对6种厌氧肠道微生物活力和适应性的影响,发现添加蔗糖和菊粉能提高菌种冻干后的细胞活力和完整细胞的比例。K. Elahe等[47]在膳食矿物质平衡的研究中将粪菌冷冻干燥,并在-20 ℃下保存10年,发现其微生物特征依然能保持稳定。
供体粪菌的冷冻已简化FMT治疗复发性CDI的过程,冻干的粪菌也可能达到类似的效果。Jiang Z. D. 等[48]将冷冻和冻干的FMT样本储存长达7个月,其微生物群的组成和治疗功效没有发生显著改变。将粪菌冻干保存后,还可制作成包封的胶囊以治疗疾病。C. Staley等[49]将粪菌进行冻干并包封,使用蔗糖、海藻糖和甘露醇作为低温保护剂,在冻干机(-20 ℃的搁板温度冷冻36 h,在30 ℃下干燥6 h)中处理后保存于20 ℃直至使用,发现冻干制剂满足所有预设目标,包括物理化学性质、包封容易性、不同温度下的稳定性以及体内外微生物群的活力。但也有研究者认为冻干粪菌效果没有冷冻的效果好[28]。
2.2.3 冷藏保存
冷藏保存法是在4 ℃的冷藏箱内保存样本,同时将有机化学溶剂作为保护剂以限制其他细菌的生成,在一定程度上杀死细菌,抑制酶的活性[33]。最常见的用于粪菌保存的保护介质有乙醇、甲醇、RNAlater、FTA(flinders technology associates)卡、粪便隐血试验(fecal occult-blood test,FOBT)卡和OMNIgene Gut试剂盒等,这些是更加适合现场的保存方法,但保存有效期较短。与冷冻相同,用乙醇或甲醇进行冷藏保存是另一类有效的粪菌DNA保存方法,但由于这些试剂是“危险化学品”,在偏远地区不容易订购或运输。RNAlater是一种保存RNA和DNA的无害液体。与乙醇相比,RNAlater的运输限制虽然较少,但其可能会随时间降解,从而降低DNA的浓度[43]。推测粪便样本中残留的RNAlater可能干扰DNA提取过程中的细胞裂解和蛋白质消化,从而抑制DNA分离[43]。FTA卡易携带,在现场样品收集时最方便。FOBT卡是临床经常用的保存方法,容易买到,价格便宜、体积小,且易于使患者接受。
S. J. Song等[50]用5种方法(70%乙醇、95%乙醇、RNA later、FTA卡和OMNIgene Gut试剂盒)保存人类和狗的粪便标本,时间长达8周,他们发现3种方法(95%乙醇、FTA卡和OMNIgene Gut试剂盒)可以在4 ℃下乃至室温稳定保存样本,且不建议使用70%乙醇。DNA在95%~100%的乙醇中保存效果最好,因为高浓度乙醇能更快速的渗透细胞膜并使DNA酶失活。他们的实验包含了1 200多个样本,为研究者提供了较为全面的参考。M. Papaiakovou等[51]使用实时荧光定量PCR技术评价7种市售产品在不同温度下保存钩虫DNA的有效性,发现在4 ℃时,60 d的保存周期内,保存试剂对DNA扩增效率没有显著影响,即使不添加保护剂,也可以使样本稳定7周以上。
很多研究者自主研发了粪菌保存液。Hao Lilan 等[52]研发了一种基于离子液体的试剂,该试剂可以在4 ℃下7 d的储存期内稳定保存粪便样本中微生物群的组成。这说明传统商业试剂的保存效果还有提升改进的空间。
以上的保护剂同样适用于更高的保存温度,如室温。但保存温度越高,可保存的时间就越短,建议在有条件的情况下,使用零下或4 ℃的低温保存。在很多4 ℃保存粪菌的研究中,都只将DNA浓度或群落结构作为测量指标,而没有考虑微生物的活性,说明这些方法可能仅仅为了保证样本的遗传物质不发生改变以进行科学研究,但想要长时间维持较高的菌群活性,还需要在冷冻方案的优化上继续探索。
2.2.4 其他非低温保存
样本的快速干燥能抑制微生物的DNA降解。最简单的干燥保存法是将样本去除杂质后直接在温度较高的烘箱中烘干,该方法简单易行,烘干后的样本易于携带和运输。但干燥保存法也有一定的缺陷,比如烘干的最佳温度和时间难以掌握,会影响样本中菌群的稳定性,且烘箱不便于携带。P. J. Johnson等[53]评估了有可充电盒的便携式干燥剂室的实用性,旨在研究快速干燥的样本中微生物群落结构的变化,他们在室温下将样本置于该干燥剂系统中24 h或72 h,然后转移至-80 ℃冰箱,发现与快速冷冻样本相比,此装置中保存的样本仅显示出微小群落变化,而在室温下放置相同时间的样本经历了几次有氧菌或兼性厌氧菌的过度生长。
对常见的保存方法进行总结,如表1所示。可以发现每种方法都各有利弊,在实际运用过程中,要结合实验条件及研究目的进行合理选择,将某几种方法结合使用也是可行的。
3 影响保存效果的主要因素
3.1 保存温度
粪菌采集和保存的一般原则[59]为:1)避免冷冻-解冻循环:冷冻-解冻循环是导致粪便样本DNA降解的关键因素,可能导致宏基因组DNA质量差。2)避免反复温度波动:剧烈的温度波动是粪便样本中很多细菌致死的主要原因,它可以杀死微生物并加剧DNA的降解。3)缩短运输时间:防止微生物不正常的增多或减少,而低温保存可延长运输时间。
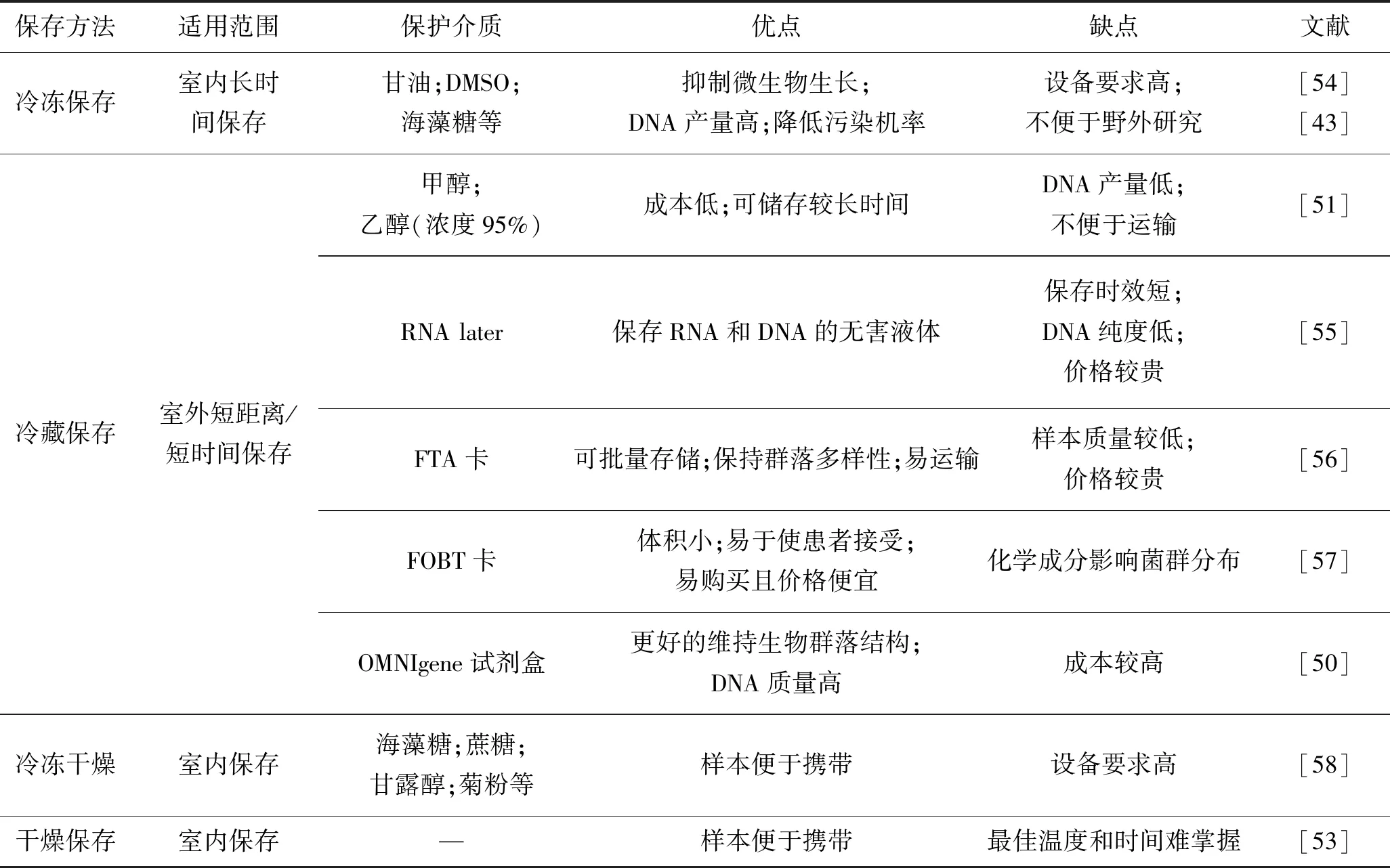
表1 粪便样本常用保存方法的对比
因此,控制运输过程中的温度十分重要。有研究表明,在4 ℃保存条件下,运输时间为24~48 h,微生物组成没有显著变化[60],如果样本可以在4 h内到达实验室则无需保存[61],一旦样本到达实验室,应该在-80 ℃下长期冷冻保存。在-80 ℃冷冻后,粪便样本可保持稳定的微生物群落长达2年[62],-20 ℃下的样本贮存时间至少可以达到数月[63]。S. J. Song等[50]研究了6种温度情况下粪便中微生物,包括-20 ℃、4 ℃、室温、4 ℃转移到室温、冻融循环(-20 ℃~室温)和野外条件下经常遇到的高温波动(4~40 ℃)。这6种温度,每种都对应样本保存时所面临的实际温度变化情况,具有研究价值。
在冻结样本之前,建议将粪便分成若干等分,可以防止二次取样时冻融循环对样本的损害[64]。随着样本开始融化,DNA也随之迅速降解,很难预测整个样本的解冻时间。粪便等分吸管技术(fecal aliquot straw technique,FAST)[64],允许简单且可重复的二次取样。
3.2 保存方法和保存时间
储存方法和储存时间会影响粪便样本中的核酸质量和菌群分布,从而影响微生物组相关数据。V. L. Hale等[56]研究表明保存方法和时间显著改变DNA浓度和纯度,香农多样性指数在保存方法和周数之间也存在显著差异。J. S. Lim等[65]将猪粪储存在-20、4、20、37 ℃的环境下,每隔7 d取样测试,共保存28 d,结果表明,随着温度和储存时间的增加,粪便中细菌群落的丰富度不断降低。
3.3 其他
样本在处理前是否经过均质化,也影响保存结果及后续检测[35],因为粪便中不同采样点的微生物群体不同。实验前可以通过涡旋增强保护剂对粪便的渗透[43]。保存一段时间后的样本若需要进一步应用,可将样本复温,并通过离心的方法分离出缓冲液。
4 结论
本文对低温保存这一过程进行了综述,解释了低温保存的机制,阐述了粪菌保存的意义,归纳了不同情况下样本低温保存方法的成果进展,并提出影响其保存效果的重要因素,得出如下结论:
1)目前的保存方法还存在很多问题:运输温度的允许波动范围和粪便样本的允许转运持续时间仍然是不确定的,需要更多的数据来形成共识;一些保护剂的机理不明确,有待进一步探索。
2)探索新型保护剂,降低保护剂毒性,提高保存效果。在细胞的低温保存中探索出了很多新型高效的保护剂,比如海藻糖[67]和聚乙烯醇[17]等,它们能够保护细胞免受低温损伤。M. Hasan等[68]将抑制冰重结晶的聚合物(聚乙烯醇和聚乙二醇)作为CPA,与使用甘油的保存结果相比,解冻后大肠杆菌产量增加了4倍,且使用的CPA浓度更低。如果将此类保护剂用于粪菌的冷冻保存,可能会得到更好的保存效果,这可以成为未来的研究思路之一。
3)粪菌只有通过冷冻保存才具有较高活性,其他的方法只是保证其中的生物大分子(如DNA,RNA和蛋白质等)不发生变异,或维持了微生物群落的稳定性。而低温保存领域的研究者尚未介入粪菌的活菌保存研究。除了优化保护剂的种类以外,还可以深入研究不同的降温程序对粪菌保存后的成活率、DNA浓度及种群分布等的影响。
4)随着低温生物学和肠道微生物学的发展,不断改进和开发新的粪菌保存方法,能在很大程度上推动粪菌样本库的建立和粪菌移植的临床应用。

