miR-2053 在口腔黏膜修复中对成纤维细胞的影响及其机制研究
余美婵 陈凯炎 刘思源
口腔黏膜的基本结构与皮肤相似,由上皮细胞和包括成纤维细胞、血管、淋巴管和神经在内的黏膜组成[1]。口腔黏膜能抵抗病原体、外源性物质和机械应力[2]。口腔黏膜愈合过程与皮肤伤口愈合基本相同,包括止血、炎症、增殖和胶原基质重塑阶段[3]。但是,两者的区别在于口腔黏膜愈合更快且不会导致瘢痕形成[4]。成纤维细胞是肉芽组织的重要组成部分,在黏膜修复中具有重要作用[5]。微小核糖核酸(microRNA,miRNA)是内源性小的非编码RNA(长度为19~22 nt),在不同的生理和病理过程中发挥关键作用,包括发育、增殖、分化、凋亡和癌变[6]。最近,miRNA 在皮肤伤口愈合过程中的作用逐渐显现,许多miRNA 通过调节角质形成细胞迁移参与再上皮化[7]。miR-2053 是表皮中一种丰富的角质形成细胞特异性miRNA[8]。通过调节PI(3)k 途径,在促进新生儿皮肤干细胞扩增方面具有重要作用[9],但在口腔黏膜修复中的作用和机制尚不明确。本研究拟探索miR-2053 在口腔黏膜修复中对成纤维细胞的影响及其作用机制,为口腔黏膜创伤治疗提供理论依据。
1 资料与方法
1.1 研究对象
2018 年1 月至2018 年12 月就诊于我科的初诊患者40 例(实验组),其中口腔扁平苔藓(Oral Lichen Planus,OLP)10 例、灼口综合征(Burning Mouth Syndrome,BMS)10 例、复发性口腔溃疡(Recurrent Aphthous Uicer,RAU)10 例,以及其他口腔黏膜病(如口腔黏膜纤维化、慢性唇炎、白斑等)10例。实验组中男、女各20 例,年龄(52.43±12.76)岁。对照组为本院体检中心健康体检者40 例,无全身系统疾病,未检出口腔黏膜病。对照组中男、女各20例,年龄(52.60±13.19)岁。两组一般情况比较无统计学差异(P>0.05),具有可比性。两组均在无菌条件下取少许口腔黏膜组织,-80 ℃保存。本研究由我院伦理委员会批准,所有受试者均知情同意。
纳入标准:①年龄>18 周岁;②符合《口腔黏膜病学》[10]中所列出的疾病症状,如复发性口腔溃疡、肉芽肿性唇炎、灼口综合征等。排除标准:①口腔内同时出现两种以上黏膜疾病者;②认知障碍患者;③有严重全身系统疾病者。
1.2 仪器与试剂
DMEM-F12 培养液(Hyclone,美国),胎牛血清(GIBCO,美国),青霉素和链霉素双抗混合液、BCA检测试剂盒(碧云天,中国),胰蛋白酶、cDNA 逆转录试剂盒Ⅱ试剂盒(Taraka,日本),CCK-8(同仁,日本),Trizol(BBI,中国),Collagen Ⅰ一抗、Collagen Ⅲ一抗(CST,德国),MMP-1 一抗、MMP-13 一抗(Santa,美国),ECL 显色液(南京诺唯赞生物科技有限公司),总RNA 提取分离试剂盒、miRcute miRNA 第一链合成试剂盒、miRcute miRNA 荧光定量检测试剂盒(天根生化科技有限公司)。
CO2培养箱(Sigma,美国),流式细胞仪(Muse,德国),7500Fast PCR(Thermo,美国),酶标仪(Molecular Device,美国),低速离心机(Thermo,美国),WB 电源(伯乐,美国)。
1.3 研究方法
1.3.1 牙龈成纤维细胞的培养与处理
人牙龈成纤维细胞(Human Gingival fibroblasts,HGF-1)购置于美国模式培养物集成库(ATCC)。将复苏后的HGF-1 置于含10%胎牛血清的DMEM/F12 培养基中,培养于37 ℃、5% CO2恒温培养箱中,待细胞进入对数生长期后进行传代,传至3 代后的细胞用于后续实验。本研究设置miR-2053 模拟物组、miRNA 阴性模拟物组及空白对照组(不处理)。以脂质体LipofectamineTM2000 转染HGF-1,miRNA模拟物及阴性模拟物均来自上海吉玛基因公司。
1.3.2 miR-2053 对HGF-1 增殖能力的影响
将各组细胞以2×104cells/mL 接种与96 孔板后处理24 h,以CCK-8 法检测细胞活力。每孔中加入相应体积的CCK-8 试剂,混匀后在37 ℃、5%CO2培养箱内继续培养1.5 h,之后于酶标仪450 nm 波长处测OD 值。细胞存活率=(实验组OD 值/对照组OD 值)×100%。进行3 次独立重复实验。
1.3.3 miR-2053 对HGF-1 迁移能力的影响
应用Transwell 进行细胞迁移能力检测,将各组细胞以4×104cells/mL 的密度置于Transwell 上室中。上室给予含0.2%胎牛血清培养基进行接种,下室给予含10%胎牛血清培养基作为趋化。将Transwell 小室置于6 孔板中,于37 ℃、5%CO2恒温培养箱中培养24 h 后,95%乙醇固定,0.2%结晶紫染色,拍照。细胞相对迁移率=实验组平均迁移距离/对照组平均迁移距离×100%。
1.3.4 miR-2053 对HGF-1 凋亡的影响
各组按照2×105cells/mL 细胞数量接种于12 孔板后,按照Annexin V Dead Cell Kit 说明书进行操作后经Muse 流式细胞仪进行检测,并进行3 次独立重复实验。
1.3.5 实时荧光定量PCR(qRT-PCR)检测
本研究采用总RNA 提取分离试剂盒对不同处理组及口腔黏膜组织进行总RNA 的提取,然后将提取的miRNA 通过miRcute miRNA 第一链合成试剂盒进行cDNA 的合成,mRNA 根据逆转录试剂盒反应说明进行cDNA 合成。通过miRcute miRNA 荧光定量检测试剂盒对miR-2053 的表达量进行检测,内参基因为U6;用Ⅱ试剂盒检测CollagenⅠ、Collagen Ⅲ、MMP-1、MMP-13 的mRNA 表达量,内参基因为GAPDH。依据2-△△ct 计算各miRNA 及mRNA 的相对表达量(表1)。

表1 荧光定量PCR 引物序列Table 1 Fluorescence quantitative PCR primer sequences
1.3.6 Western-blot 检测相关蛋白的表达
按照蛋白提取试剂盒说明书提取组织蛋白,BCA 法测定蛋白浓度,用Western-blot 法测定βactin(内 参)、Collagen Ⅰ、Collagen Ⅲ、MMP-1、MMP-13 的蛋白表达情况。
1.4 统计学方法
应用EpiData 对全部实验数据进行录入整理,定量数据以()表示。应用SPSS 22.0 软件进行统计学分析。符合正态分布且方差齐性检验合格后,采用单因素方差分析(one-way ANOVA),与对照组比较采用Dunnett 法;不符合正态分布则用非参数检验进行分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 miR-2053 的表达情况
与对照组比较,实验组miR-2053 在口腔黏膜组织中的表达量明显升高(P<0.05)(图1)。
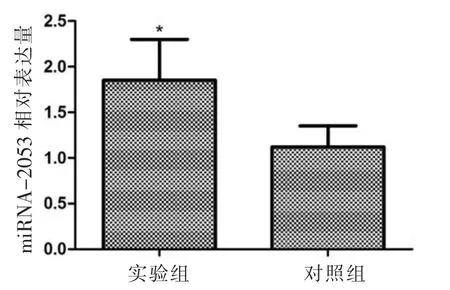
图1 miR-2053 在各组中的相对表达量(*:与对照组相比,P<0.05)Fig.1 Relative expression level of miR-2053 in each group(*:compared with control group,P<0.05)
2.2 miR-2053 在各组HGF-1 中的表达量
HGF-1 经不同处理后,通过RT-PCR 对miR-2053 表达量进行验证。与阴性模拟物组及对照组比较,miR-2053 模拟物转染组中miR-2053 表达量明显升高(P<0.05);而阴性模拟物组与对照组相比无明显差异(P>0.05)(图2)。
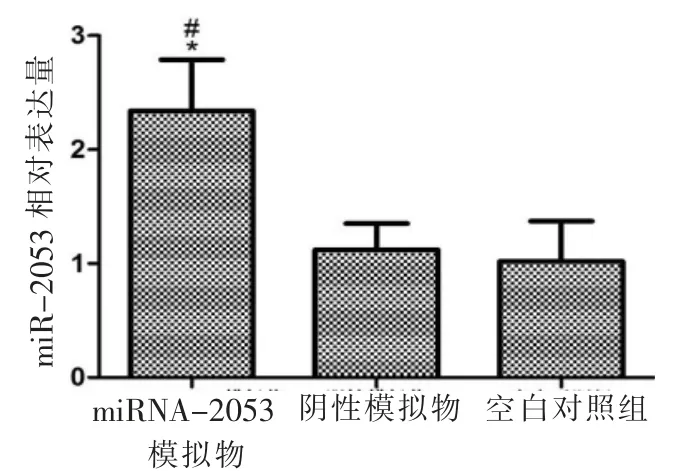
图2 不同处理方法处理后HGF-1 细胞miR-2053 相对表达量(*:与对照组比较,P<0.05;#:与阴性模拟物组比较,P<0.05)Fig.2 Relative expression levels of miR-2053 in HGF-1 cells after treated by different methods (*:compared with control group,P<0.05;#:compared with negative analogue group,P<0.05)
2.3 HGF-1 细胞活力情况
与阴性模拟物组及对照组比较,转染miR-2053后的细胞存活率明显下降(P<0.05);而阴性模拟物组与对照组相比无明显差异(P>0.05)(图3)。
2.4 HGF-1 细胞凋亡情况
与阴性模拟物组及对照组比较,转染miR-2053后的细胞凋亡率明显升高(P<0.05);而阴性模拟物组与对照组相比无明显差异(P>0.05)(图4)。
2.5 HGF-1 细胞迁移能力
与阴性模拟物及对照组比较,转染miR-2053 后的HGF-1 细胞迁移率明显升高(P<0.05);而阴性模拟物与对照组相比无明显差异(P>0.05)(图5)。
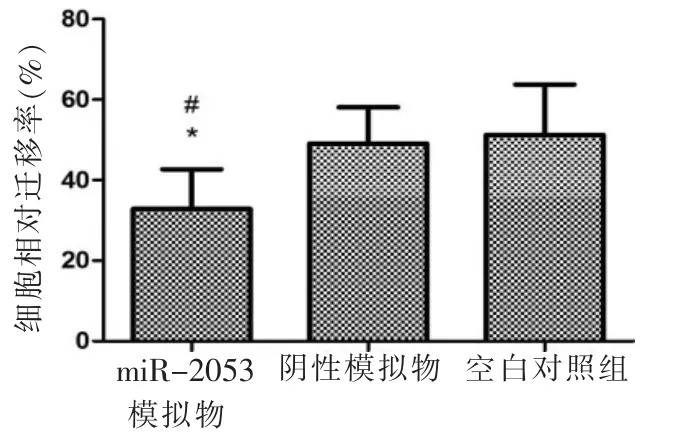
图5 不同处理方法处理后HGF-1 细胞迁移率(*:与对照组比较,P<0.05;#:与阴性模拟物组比较,P<0.05)Fig.5 HGF-1 cell migration rate after treated by different methods (*:compared with control group,P<0.05;#:compared with negative analogue group,P<0.05)
2.6 Real-time PCR 检测CollagenⅠ、Collagen Ⅲ、MMP-1、MMP-13 基因表达情况
本研究通过对组织重塑中的关键基因检测,验证miR-2053 对其的影响。结果显示,与阴性模拟物组及对照组比较,转染miR-2053 后HGF-1 细胞的Collagen Ⅰ、Collagen Ⅲ、MMP-1、MMP-13 基因相对表达量均明显降低(P<0.05)(图6)。
2.7 Western-blot 检 测Collagen Ⅰ、Collagen Ⅲ、MMP-1、MMP-13 蛋白表达情况
对相关蛋白进行检测后发现,与阴性模拟物组及对照组比较,转染miR-2053 后HGF-1 细胞的Collagen Ⅰ、Collagen Ⅲ、MMP-13 蛋白相对表达量均出现明显降低(P<0.05),而MMP-1 蛋白表达虽有下降趋势但无统计学意义(P>0.05)(图7)。
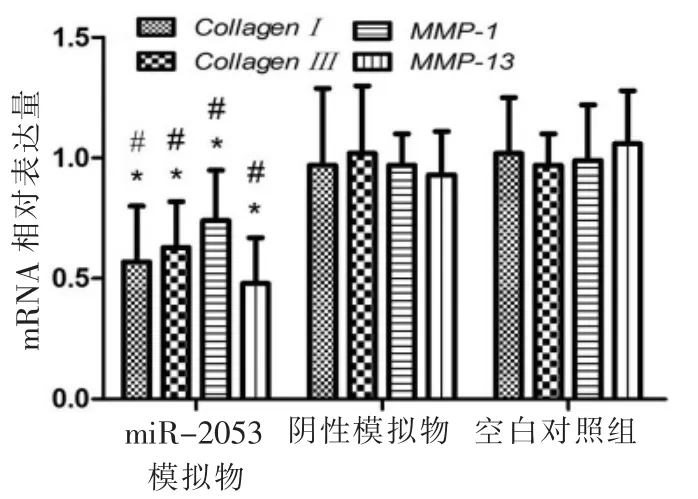
图6 转染miR-2053 对组织重塑相关基因表达的影响(*:与对照组比较,P<0.05;#:与阴性模拟物组比较,P<0.05)Fig.6 Effect of transfection of miR-2053 on the expression of genes involved in tissue remodeling (*:compared with control group,P<0.05;#:compared with negative analogue group,P<0.05)
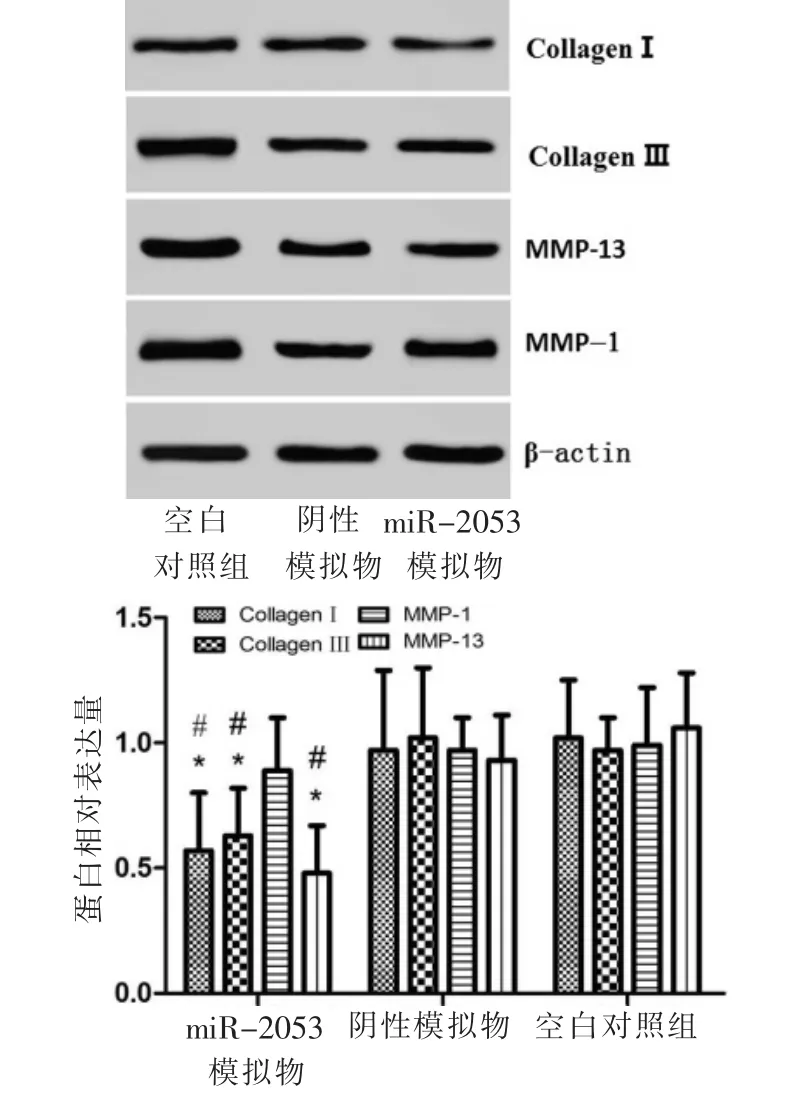
图6 转染miR-2053 对组织重塑相关基因表达的影响(*:与对照组比较,P<0.05;#:与阴性模拟物组比较,P<0.05)Fig.6 Effect of transfection of miRNA-2053 on the expression of genes involved in tissue remodeling (*:compared with control group,P<0.05;#:compared with negative analogue group,P<0.05)
3 讨论
口腔黏膜病多发于中老年人群,主要发生在口腔黏膜及其软组织上,常以口腔软组织上的斑纹、充血及糜烂为主要临床表现[11]。牙龈成纤维细胞向损伤区域的迁移,是对损伤组织的修复反应。这些细胞通过填充该区域并分泌愈合所需的细胞外基质成分进行修复,在口腔黏膜病的治疗中具有重要意义[12]。目前,miRNA 在疾病中的作用越来越受到重视,但在口腔黏膜病中的作用机制尚不明确。miR-2053 是表皮中表达最丰富的皮肤miRNA 之一,已证实其对成纤维细胞的迁移及表皮的修复具有重要作用[13-14]。因此,本研究首先对miR-2053 在实验组及对照组中的表达进行检测,结果显示miR-2053 的表达在实验组中明显升高,表明miR-2053 在口腔黏膜病中扮演着重要的角色。因此,我们进一步通过miR-2053 转染的方式使其过表达,检测其对HGF-1 的细胞活力、凋亡及迁移能力的影响,并通过对组织修复相关转录因子及蛋白的检测进一步对其机制进行探讨。
与对照组及阴性模拟物组比较,转染miR-2053的人牙龈成纤维细胞模型的细胞活力及迁移率均明显下降(P<0.05),而凋亡显著增高(P<0.05),表明过表达miR-2053 对HGF-1 存在一定程度的损伤。已有研究显示,miR-2053 能够导致角质形成细胞迁移能力下降[15],与本研究结果一致。虽然本研究结果可以看出miR-2053 在口腔黏膜病患者的组织中表达增高,且能够通过影响HFG-1 的一般情况而影响疾病的进程,但其机制仍需进一步探讨,因此选择对牙周组织重塑起关键作用的相关转录因子作进一步研究。
牙周组织重塑在口腔黏膜疾病中扮演重要的角色,是一种复杂的机械和生物力学反应过程[16]。本研究选择的Collagen Ⅰ、Collagen Ⅲ、MMP-1、MMP-13 基因在牙周组织重塑中起重要作用[12]。与对照组及阴性模拟物组比较,转染miR-2053 后的HGF-1中4 种基因的表达量均明显下降(P<0.05);在对蛋白水平的进一步检测中发现,与对照组及阴性模拟物组比较,转染miR-2053 后的HGF-1 的CollagenⅠ、Collagen Ⅲ、MMP-13 蛋白相对表达量均明显降低(P<0.05),而MMP-1 蛋白表达虽有下降趋势但无统计学意义(P>0.05)。陈盈哲等[12]采用不同细胞因子处理成纤维细胞,同样发现Collagen Ⅰ、CollagenⅢ、MMP-1、MMP-13 在口腔黏膜修复中的作用,与本研究结果一致。Collagen Ⅰ、Collagen Ⅲ作为调节组织重构的关键转录因子,在表皮修复中具有重要作用,而miR-2053 可能通过影响其表达从而影响口腔黏膜病的进程。MMP-1、MMP-13 作为间质胶原酶,通过特异性降解胶原蛋白从而发挥作用。虽然本研究中MMP-1 蛋白水平表达并未出现明显改变,但其基因水平表达出现降低,可能由于转录时间的存在从而导致基因出现变化但蛋白还未明显改变。这种现象在既往研究中同样发生过[17]。
综上所述,我们认为miR-2053 可能通过影响Collagen Ⅰ、Collagen Ⅲ、MMP-1、MMP-13 基 因及蛋白的表达,进而影响人牙龈成纤维细胞的活力、凋亡及迁移能力,从而影响口腔黏膜病的康复及病程。因此,今后或许可以利用与其相关的抑制药剂为口腔黏膜病的靶向治疗提供新的方向。

