肝血管平滑肌脂肪瘤的诊断及治疗选择(附130例回顾性分析)
李超,梁磊,王明达,邢昊,徐新飞,黄彬,沈锋,吴孟超,杨田
(海军军医大学第三附属医院 上海东方肝胆外科医院,1.肝胆外科,2.放射科,上海 200438)
肝血管平滑肌脂肪瘤(hepatic angiomyolipoma, HAML)是一种由平滑肌细胞、脂肪细胞及增生血管组成的间叶组织肿瘤[1]。由于构成比例的差异,其影像学检查缺乏特异性表现,故术前诊断困难,误诊率较高[2]。Klompenhouwer等[3]回顾性研究表明HAML术前确诊率仅为28.2%。目前大部分报道的HAML病例为良性肿瘤,但仍有一些研究表明HAML可能存在恶变、复发及死亡可能[4-6]。而且,也有研究报道HAML肿瘤病灶自发性破裂的病例[7-9]。因此目前对于HAML的诊断和治疗仍没有共识。我们将上海东方肝胆外科医院2012年1月到2018年12月收治的130例行肝切除术的HAML病例进行回顾性分析,旨在总结HAML的疾病特点,提出合适的治疗方案。
资料与方法
收集130例行肝切除术治疗的HAML病人的临床资料,包括:性别、年龄、临床症状、肝炎、肝硬化、脂肪肝、肿瘤直径、肿瘤数量、肿瘤位置、影像学特征、术后病理等。本研究通过了医院伦理委员会的批准,病人及家属均签署知情同意书。
本组130例病人中,男性33例,女性97例;年龄18~72岁,平均44.4岁。实验室检查:肝功能,血常规,肿瘤标志物[甲胎蛋白(AFP)、癌胚抗原(CEA)、癌抗原(CA)19-9],所有病人均未见明显异常。个别病人转氨酶稍高于正常值,予以保肝治疗后均恢复正常。病人术前均至少行一次肝脏增强MRI或CT检查。术后病理均由两位病理科医师双盲诊断。所有病人均门诊或电话随访。
结 果
一、病人基线特征
130例病人中,仅有15例出现临床症状,其中2例表现为上腹部隐痛,13例表现为腹部不适。其余115例均为常规体检发现。22例病人乙型肝炎表面抗原阳性,1例病人丙型肝炎阳性。7例病人合并肝硬化,14例病人合并脂肪肝。所有病人术前肿瘤标志物AFP、CEA、CA19-9均为阴性,肝功能分级均为Child-Pugh A级。具体见表1。
二、影像学特征
如表1所示,130例病人中大多数为单发病灶(94.6%),仅有7例(5.4%)病人为多发病灶。大部分病灶发生于肝右叶(54.6%),肿瘤直径1.1~18.4 cm(平均5.6 cm)。术前影像学诊断仅有18例(13.8%)病人确诊为HAML,其余诊断为肝癌(58.5%)、肝血管瘤(11.6%)、局灶性结节增生(7.7%)、肝腺瘤(4.6%)及肝错构瘤(3.8%)。肿瘤分型为脂肪瘤型(56例,43.1%)、肌瘤型(33例,25.4%)、血管瘤型(13例,10.0%)及混合型(28例,21.5%)。脂肪瘤型:CT及MRI检查可见明显的脂肪组织及条索状、斑片状软组织影,增强后脂肪组织无强化,软组织影可见明显强化。典型的脂肪瘤型HAML较易诊断。肌瘤型:以平滑肌成分为主,CT呈不均等的低密度软组织影;MRI检查T1WI低信号,T2WI高信号,肿瘤内部信号混杂。增强后呈渐进性强化。血管瘤型:由畸形血管组成,脂肪含量少。CT能显示点状血管钙化;MRI检查T1WI、T2WI均呈低信号钙化,增强扫描明显的动脉瘤样强化。
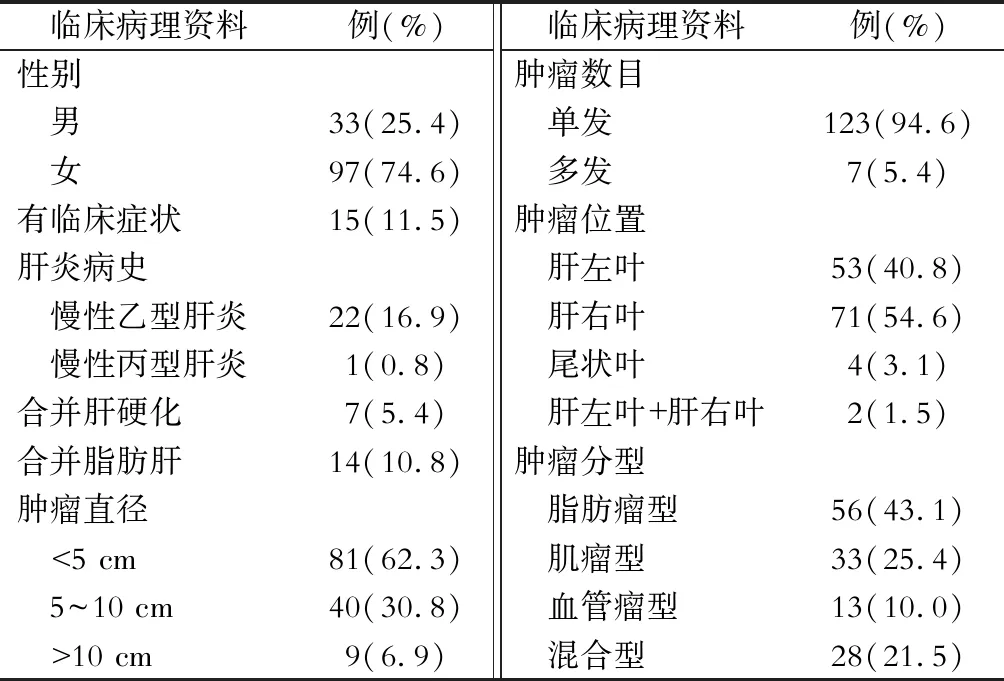
表1 130例肝血管平滑肌脂肪瘤病人的临床病理资料
三、病理特征
肉眼观,大部分肿瘤标本呈棕黄色(92例,70.8%),质地软。镜下可见成熟的脂肪细胞、平滑肌细胞及扩张的小血管。免疫组化染色表明,所有病人中HMB45均呈阳性(图1)。93.7%(75/80)病人(SMA)呈阳性。此外,在部分病人中S-100(66.7%)、CD34(73.9%)、Desmin(20.9%)等也呈阳性表达。见表2。
四、随访
所有病人均行手术切除治疗,诊断均由术后病理证实。术后无病人发生死亡及严重并发症。所有病人均门诊或电话随访,腹部超声、肝脏增强CT或MRI为常规随访检查。术后半年内每2~3个月复查一次,其后每3~6个月复查一次。本组病例术后随访5~77个月(中位时间37个月),3例病人出现肿瘤复发(3/130,2.3%),其中1例病人术后病理提示肿瘤与周围肝组织有“浸润性”边界、瘤旁见小灶瘤细胞生长,术后严格随访13个月出现肿瘤复发。另外2例病人分别为术后36个月和50个月复发。
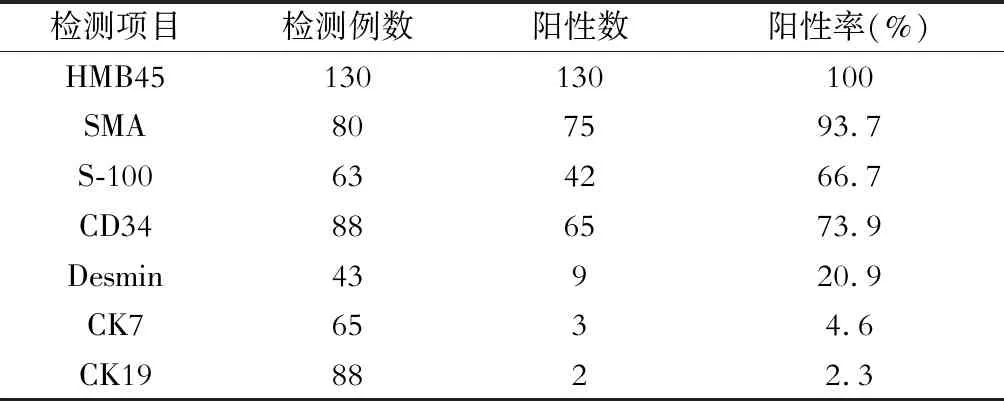
表2 免疫组化检查结果
讨 论
HAML是一种少见的来源于血管旁上皮细胞的肿瘤[10],多见于成年女性,然而目前并未有研究表明性激素对HAML的发生及生长起促进作用[11]。血管平滑肌脂肪瘤作为一种间叶组织肿瘤,最好发于肾脏,且半数以上的肾血管平滑肌脂肪瘤与结节性硬化症相关(tuberous sclerosis complex, TSC)。1976年Ishak第一次对肝脏原发的血管平滑肌脂肪瘤进行了报道[1]。据文献报道[12-13],在肝脏中仅有5%~15%的血管平滑肌脂肪瘤与TSC相关,其发病机制目前仍未完全明确。由于HAML组成成分的不同,其影像学差异极大。而且大多数的HAML多无早期症状,血清学多无异常,其术前明确诊断极为困难。
在我们的研究中,大部分病人是通过体检发现的,仅有15例(11.5%)病人出现临床症状,以腹部隐痛、腹部不适为主。由于大部分HAML病人术前无特异性症状,且实验室检查(肝炎、AFP、肝功能、CA19-9、CEA)多为阴性,因此术前主要通过影像学进行诊断。然而,本组研究中术前通过影像学明确诊断的病例仅有18例(13.8%),确诊率与既往文献报道大致相当[3,14]。HAML的影像学特征主要表现为成熟的脂肪组织和中央厚壁的供血血管。由于其构成成分的差异,对于脂肪瘤型HAML诊断较为容易,然而对于脂肪含量稍低的HAML典型表现较少,易与肝脏其他肿瘤混淆。18F-FDG PET/CT目前在良恶性肿瘤的鉴别中发挥着越来越重要的作用,在良性肿瘤中FDG的摄取明显降低。对于同肝细胞癌(HCC)难以鉴别的HAML,PET/CT可以提高术前诊断率,从而使病人避免不必要的手术治疗[15]。Klompenhouwer等[3]研究表明,组织活检合并免疫组化HMB45染色可使HAML的诊断率提高到78.1%。正如本研究中,所有病人术后病理免疫组化HMB45均为阳性,93.7%(75/80)的病人SMA呈阳性。此外,除HMB45与SMA染色阳性外,MART-1、A103、S-100、Melan-A及CD34染色阳性对于HAML的诊断也有一定的帮助[16-17]。
在我们的研究中,有3例(2.3%)病人出现了肝切除术后肿瘤复发。自1989年Nguyen等[18]报道了第一例恶性HAML以来,一些复发及转移的恶性HAML病例也时有报道[3,19-20]。一项回顾性研究[3]也表明HAML术后复发率为2.4%,术后死亡率为0.8%。因此,鉴于HAML潜在的恶性可能,即便目前许多治疗策略(手术、栓塞、射频、化疗、肝移植及保守治疗)应用于临床上,但对于HAML的最佳治疗方案仍存在争议[21-22]。通过对130例手术病人的分析及先前经验的总结,我们认为对于临床症状明显、肿瘤可能压迫肝内大血管及主干胆管、肿瘤呈浸润性生长、高增殖活性、非典型上皮样结构及难以明确诊断的HAML,需尽早行肝切除手术治疗,其预后良好。介入栓塞治疗仅限应用于明确诊断的HAML病人。对于肿瘤体积巨大,弥漫多发性的HAML,肝移植可使病人获得长期生存[23-24]。对于肿瘤直径<5 cm,血清学(肝炎、肿瘤标志物、肝功能)无异常,诊断明确的HAML病人,可以行保守观察治疗。对于HAML病人,不管选择何种治疗方案,由于其潜在的恶性可能,都应该进行严格且长期的随访。
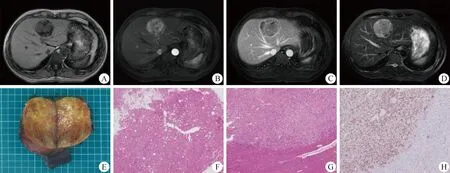
图1 肝血管平滑肌脂肪瘤的影像学及病理学特征 A~D.T1WI示块状低信号影,其内可见少量高信号,边缘不清;T2WI示混杂较高信号,增强后动脉期明显不均匀强化,脂肪成分不强化,内见索条状强化小血管,门脉期及延迟期减退呈混杂低信号;E.肿瘤大体标本,呈黄白色,周边无明显包膜;F、G.肿瘤HE染色(×40),可见增生脂肪细胞、少量上皮样细胞及畸形血管,肿瘤周边无明显包膜,肿瘤与正常肝组织呈假性浸润生长;H.HMB45染色阳性
总之,HAML影像学差异性极大,严重影响了其术前诊断。术前行18F-FDG PET/CT、组织穿刺活检及免疫组化染色对于提高诊断率具有重要作用。对于临床症状明显、肿瘤呈浸润性生长、高增殖活性、非典型上皮样结构及难以明确诊断的HAML需及时行手术治疗,其手术预后较好。由于HAML潜在的复发及转移可能,术后仍需长期的严格随访。

