心肌酶谱检测在预测中暑患者病情严重程度中的应用价值
曾志锋, 傅钦珊, 刘 瑞
(解放军陆军第74集团军医院, 广东 惠州, 516001)
中暑患者临床主要表现为高热、大汗、恶心、抽搐等,严重者还会发生晕厥、脱水等,威胁生命安全[1]。中暑具有病情复杂、病起较急、死亡率较高等特点,且在短期内易累及中枢神经、循环、凝血等多个器官及系统[2]。研究[3]发现,中暑会对细胞膜及其内部结构造成损伤,导致机体细胞结构、功能发生变化,同时对细胞膜结构通透性造成损伤,进一步对心肌细胞造成损害。心肌酶谱能有效反映心肌缺血、坏死情况及细胞膜通透性[4]。本研究分析中暑患者心肌酶谱变化情况,探讨其对疾病严重程度的预测价值,现报告如下。
1 资料与方法
1.1 一般资料
回顾性选择本院2017年5月—2018年5月收治的中暑患者70例作为观察组,其中观察A组为轻、中度中暑患者55例,观察B组为重度及重症中暑患者15例。纳入标准: ① 均符合《职业性中暑的诊断标准》[5]中暑诊断及分型标准; ② 年龄>18岁,性别不限; ③ 临床病史资料齐全; ④ 精神及意识清楚,能配合完成所有研究项目。排除标准: ① 合并严重基础疾病、心脑血管疾病、恶性肿瘤等; ② 免疫功能低下; ③ 存在精神异常、意识障碍等。选择同时间段在本院进行健康体检人群106例作为对照组,均已排除其他病史。观察组男58例,女12例; 年龄18~45岁,平均(21.70±4.41)岁。对照组男83例,女23例; 年龄18~45岁,平均(22.06±4.84)岁。2组受试者一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
受试者入组后均于入院24 h内抽取外周静脉血5 mL, 离心后取血清置于-20 ℃冰箱保存。观察组患者根据病情实施系列治疗(早期快速降温、早期快速扩容、积极脏器功能支持等),待其体温恢复正常(平均住院时间为4 d)后,抽取外周静脉血5 mL, 离心后取血清置于-20 ℃冰箱保存,于入院24 h获取血清样本同时进行心肌酶谱检测。检测指标为谷草转氨酶(AST)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、肌酸激酶同工酶(CKMB)、α羟丁酸脱氢酶(α- HBDH), 检测仪器为 Vitros DT system 型自动分析仪。
1.3 观察指标
统计观察组治疗前后分别与对照组心肌酶谱变化情况,对比观察组治疗前后心肌酶谱变化情况,并分析治疗前心肌酶谱各项指标对轻症及重症中暑患者预测价值。
1.4 统计学方法

2 结 果
2.1 观察组与对照组心肌酶谱变化情况比较
观察组治疗前血清AST、LDH、CK、CKMB、α- HBDH含量均显著高于对照组(P<0.05), 见表1。观察组治疗后与对照组比较,血清α- HBDH含量差异无统计学意义(P>0.05), 观察组治疗后血清AST、LDH、CK含量均显著高于对照组(P<0.05), 血清CKMB含量显著低于对照组(P<0.05), 见表2。

表1 观察组治疗前与对照组心肌酶谱情况比较 U/L
AST: 谷草转氨酶; LDH: 乳酸脱氢酶; CK: 肌酸激酶; CKMB: 肌酸激酶同工酶; α- HBDH: α羟丁酸脱氢酶。
与对照组比较, *P<0.05。

表2 观察组治疗后与对照组心肌酶谱情况比较 U/L
AST: 谷草转氨酶; LDH: 乳酸脱氢酶; CK: 肌酸激酶; CKMB: 肌酸激酶同工酶; α- HBDH: α羟丁酸脱氢酶。
与对照组比较, *P<0.05。
2.2 观察A组与观察B组治疗前后心肌酶谱变化情况比较
观察A组与观察B组治疗前血清CK、α- HBDH含量差异无统计学意义(P>0.05); 观察A组治疗前血清AST、LDH、CKMB含量均显著低于观察B组(P<0.05); 观察A组治疗后血清AST、LDH、CK、CKMB、α- HBDH含量改善均显著优于治疗前(P<0.05), 观察B组治疗后血清AST、LDH、CK、CKMB含量改善均显著优于治疗前(P<0.05); 观察A组、观察B组治疗后血清AST、LDH、CK、α- HBDH含量差异无统计学意义(P>0.05), 观察A组治疗后血清CKMB含量显著低于观察B组(P<0.05), 见表3。

表3 观察A组与观察B组治疗前后心肌酶谱变化情况比较 U/L
AST: 谷草转氨酶; LDH: 乳酸脱氢酶; CK: 肌酸激酶;
CKMB: 肌酸激酶同工酶; α- HBDH: α羟丁酸脱氢酶。
与治疗前比较,*P<0.05; 与观察A组比较, #P<0.05。
2.3 治疗前心肌酶谱各项指标预测轻症及重症中暑患者价值的ROC曲线分析
ROC曲线分析结果显示,治疗前血清AST曲线下面积0.729(95%CI=0.610~0.828), LDH曲线下面积0.685(95%CI=0.563~0.791), CK曲线下面积0.650(95%CI=0.527~0.760), CKMB曲线下面积0.862(95%CI=0.759~0.933), HBDH曲线下面积0.628(95%CI=0.505~0.741), 见表4、图1。
3 讨 论
中暑是指机体长期受热导致出现的一系列症状,主要因体温调节中枢功能障碍、汗腺功能衰竭、水电解质过量丢失等导致中枢神经、心血管功能障碍,根据疾病程度可分为轻症、重症2大类[6-7]。中暑患者出现的高热表现,不仅对机体细胞、代谢等造成不利影响,也会造成机体脏器功能损伤,而心脏是较易受伤害的器官之一[8]。研究[9-11]发现,人体体温高于42℃时会使体内酶活性丧失,对大脑皮质造成不可逆的伤害,同时体温过高出现的出汗、脱水、酸中毒等表现,均可造成肌肉痉挛,损害肌细胞完整性,进而对心肌细胞造成伤害。心肌酶谱检测是临床上对急性心肌梗死、心肌炎等疾病辅助诊断方式之一,当心肌细胞出现损伤时,细胞膜结构会遭到破坏,其通透性明显增加,导致大量心肌酶释放进入血液[12-14]。因此,心肌酶谱对心肌损伤检测的特异性及敏感性均较高。
本研究对比健康人群与中暑患者治疗前后心肌酶谱检测结果发现,中暑患者治疗前后血清AST、LDH、CK含量均高于健康人群,血清CKMB含量在治疗前高于健康人,治疗后明显降低且低于健康人群; 血清α- HBDH含量在治疗前高于健
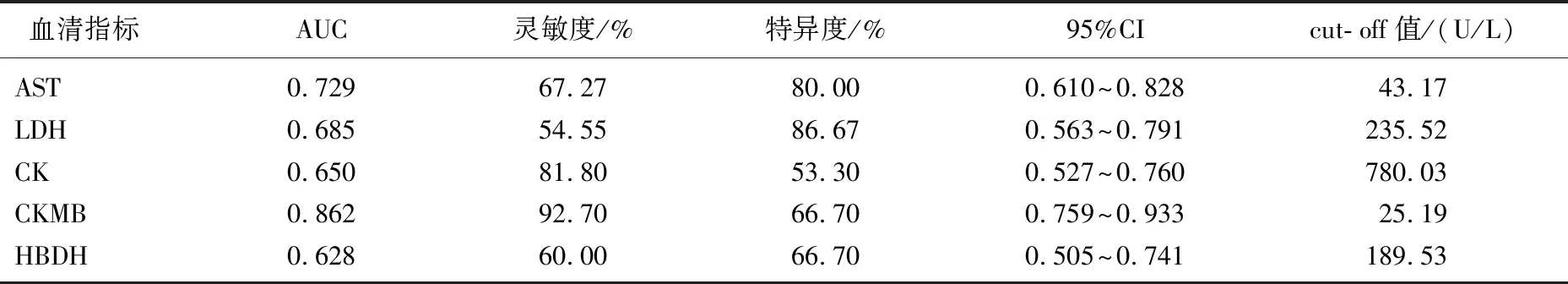
表4 治疗前心肌酶谱各项指标预测轻症及重症中暑患者价值的ROC曲线分析
AST: 谷草转氨酶; LDH: 乳酸脱氢酶; CK: 肌酸激酶; CKMB: 肌酸激酶同工酶; α- HBDH: α羟丁酸脱氢酶; AUC: 曲线下面积。
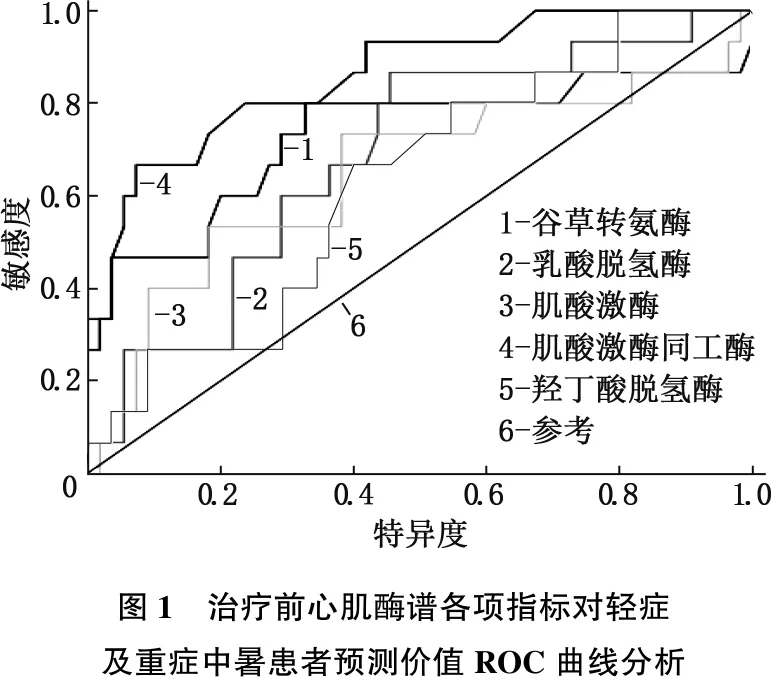
图1 治疗前心肌酶谱各项指标对轻症及重症中暑患者预测价值ROC曲线分析
康人,而治疗后与正常人无显著差异,这与俞建峰[15]研究结果类似,提示中暑可能会导致心肌细胞受损进入血液,导致血清心肌酶水平发生明显变化,且治疗后有一定程度改善。范华杰等[16]研究显示,心肌酶CKMB是中暑患者血清中水平变化最大的酶,本研究结果与此基本一致。本研究还发现,中、轻度中暑患者治疗前血清AST、LDH、CKMB含量低于重度及重症患者,而治疗后中、轻度患者血清心肌酶谱检测结果均明显改善,重度及重症患者仅AST、LDH、CK、CKMB含量发生改变,且中、轻度中暑患者治疗后仅血清CKMB含量低于重度及重症患者,故血清CKMB含量在中暑患者治疗前后变化最明显。本研究ROC曲线分析发现,AST、LDH、CK、CKMB、α- HBDH各曲线下面积依次为0.729、0.685、0.650、0.862、0.628,其中CKMB曲线下面积最大,提示其可作为中暑患者早期心肌酶检查的生物标志物。
综上所述,中暑患者心肌酶谱检测结果均与正常人存在差异,经ROC分析发现治疗前心肌酶谱变化对中暑患者病情判断有一定的指导意义,且血清CKMB水平随疾病变化最为明显。

