过表达CLPTM1L降低95-D肺癌细胞对吉西他滨的敏感性
孙亦鹏 倪振华 吴颖颖 陈清阁 毕俊杰 林玉华 王雄彪
肺癌是我国发病率和死亡率最高的恶性肿瘤之一,严重威胁人类健康,而化疗药物耐药是临床治疗肺癌疗效不佳的关键问题[1]。因此,寻找耐药基因、研究其潜在的机制,进而靶向治疗是一种合理的思路方法。唇腭裂跨膜蛋白1样蛋白(Cleft lip and palate transmembrane 1 like,CLPTM1L)与耐药密切相关。该基因最初是在筛查顺铂耐药相关基因时发现的,因此又称为CRR9(Cisplatin resistance related protein,CRR9),其在顺铂耐药的卵巢癌细胞中表达上调[2]。进一步研究发现,CLPTM1L在肺癌中的表达显著增加,并且其表达量与肺癌细胞对顺铂和喜树碱的敏感性相关[3-4]。吉西他滨是治疗肺癌的一线化疗药物,常用于联合铂类等抗癌药物治疗肺癌,临床疗效显著。为此本研究以肺癌细胞95-D为研究对象,观察CLPTMIL基因表达变化与肺癌细胞吉西他滨敏感性的关系,并探讨其可能的机制。
1 材料与方法
1.1 实验试剂
RPMI 1640培养基和胎牛血清购自Invitrogen公司;Caspase-3/7和Caspase-9活性检测试剂盒购自Promega公司;CCK-8试剂购自同仁化学公司;蛋白裂解液购自Thermo公司;CLPTM1L抗体购自Novus、Santa公司;p-4E-BP1抗体、β-actin抗体购自CST公司;吉西他滨购自Selleck公司;肺癌95-D细胞购自中科院细胞所。
1.2 实验方法
1.2.1 肺癌细胞95-D培养 人95-D肺癌细胞用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的RPMI 1640培养液,培养在37℃、5%CO2的培养箱中,隔天换液。
1.2.2 CLPTM1L基因过表达慢病毒制备及感染 由上海吉凯公司克隆CLPTM1L基因的编码区序列,构建病毒质粒,转染293T细胞,制备慢病毒颗粒。培养95-D细胞至对数生长期接种于24孔板,每孔5×104个细胞,在polybrene(浓度5 mg/L)存在的条件下分别以感染复数(MOI)=100的慢病毒感染细胞,感染72 h后收集细胞,通过有限稀释法筛选单克隆,以成功感染的单克隆细胞为CLPTM1L过表达组,以正常95-D细胞为对照组。
1.2.3 荧光定量PCR检测CLPTM1L mRNA表达水平 采用Trizol提取细胞总RNA,按照SuperScript III试剂盒说明书逆转录成cDNA,采用Roche荧光定量PCR试剂盒检测CLPTM1L mRNA表达水平,反应条件为:94℃ 10 min,94℃ 30 s,60℃ 1 min,共40个循环,以GAPDH基因作为内参,引物序列见表1。
1.2.4 免疫细胞化学法检测CLPTM1L蛋白表达 收集95-D CLPTM1L过表达组和对照组细胞,以每孔7 000个细胞接种于96孔板中,细胞培养过夜后吸弃孔内上清液,加入4%多聚甲醛固定10 min,然后用含0.1% Triton X-100的PBS溶液清洗3次,加入CLPM1L抗体4℃孵育过夜,之后用含0.1% Triton X-100的PBS溶液清洗3次,加入荧光二抗于37℃温箱放置1 h,加入DAPI进行核染色,最后在荧光显微镜下观察。

表1 引物序列表
1.2.5 CCK-8检测细胞增殖 收集95-D CLPTM1L过表达组和对照组细胞,以每孔7 000个细胞接种于96孔板中。细胞培养过夜后,分别加入不同浓度吉西他滨(0 nM、2.5 nM、5 nM和10 nM)处理细胞48 h,之后吸弃孔内上清液,每孔加入CCK-8溶液10 μL,继续培养2 h,选择450 nm波长在酶标仪上测定各孔吸光光度值。
1.2.6 Caspase-3/7和Caspase-9活性检测 收集95-D CLPTM1L过表达组和对照组细胞,以每孔7 000个细胞接种于96孔板中。细胞培养过夜后,分别加入不同浓度吉西他滨(0 nM、2.5 nM、5 nM和10 nM)处理细胞48 h,每孔加入100 μL Caspase-3/7或Caspase-9底物,混合孵育3 h后采用Promega GloMax 20/20发光检测仪检测各孔吸光光度值。
1.2.7 Western blot检测蛋白表达变化 取等量蛋白样本进行聚丙烯酰胺凝胶电泳,然后将蛋白转移至PVDF膜上,TBST+5%BSA封闭液封闭2 h。将膜分别与CLPTM1L、p-4E-BP1、β-actin一抗4℃孵育过夜,然后TBST洗涤3次,每次10 min,之后加入HRP标记的山羊抗兔或抗鼠IgG二抗,室温孵育2 h。用TBST洗膜3次,每次10 min,最后加入ECL发光液,于Bio-Rad化学发光成像系统中曝光显影。
1.3 统计学分析
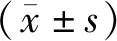
2 结果
2.1 CLPTM1L过表达细胞株构建
用CLPTM1L过表达慢病毒感染肺癌95-D细胞,将细胞分为CLPTM1L过表达组和对照组。荧光定量PCR结果显示,与对照组相比,CLPTM1L过表达组CLPTM1L mRNA(12.42±6.40,P=0.036)显著增高;Western blot和细胞免疫荧光结果显示,过表达组CLPTM1L蛋白高于对照组(P<0.01)(图1)。
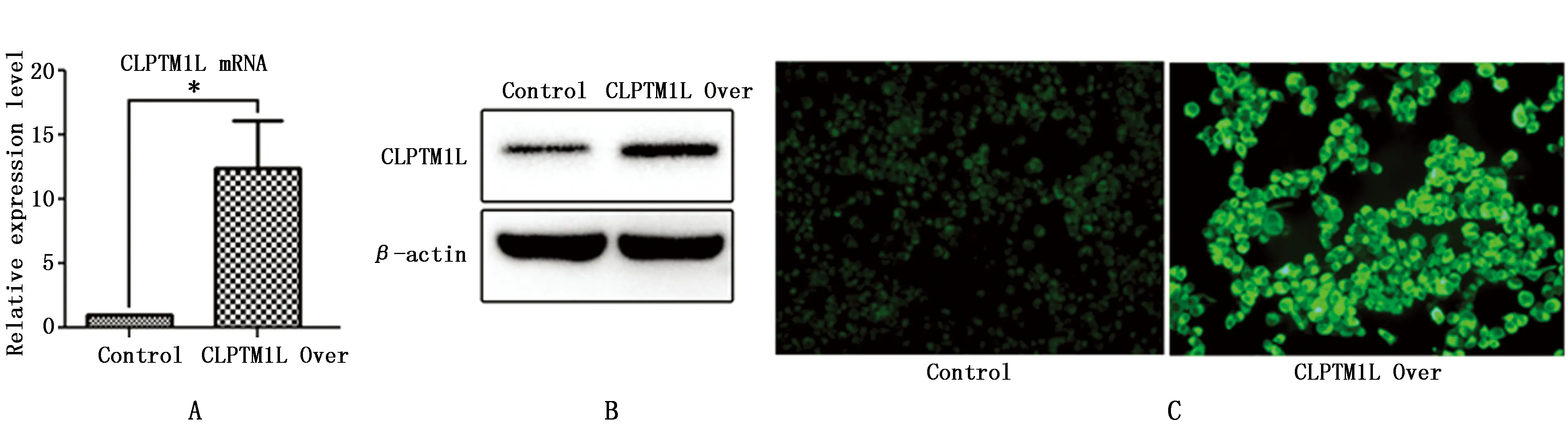
图1 慢病毒感染95-D后CLPTM1L mRNA和蛋白表达变化
2.2 CLPTM1L过表达对吉西他滨抑制95-D细胞增殖的影响
CCK-8细胞增殖实验显示,在对照组内,与吉西他滨0 nM组相比,2.5、5和10 nM组的细胞增殖能力显著降低(P<0.01);与对照组相比,CLPTM1L过表达组的细胞增殖能力显著升高(P<0.01)(图2)。说明CLPTM1L过表达后抑制了吉西他滨对肺癌细胞的杀伤作用。

图2 吉西他滨处理CLPTM1L过表达组和对照组细胞后细胞增殖的变化
2.3 CLPTM1L过表达对吉西他滨激活95-D细胞内Caspase-3/7和Caspase-9的影响
本研究检测了吉西他滨作用于CLPTM1L过表达组和对照组后细胞内Caspase-3/7和Caspase-9的激活情况。结果显示,在对照组内,与0 nM组相比,吉西他滨2.5、5、10 nM组的Caspase-3/7和Caspase-9活性显著增高(P<0.01);与对照组相比,CLPTM1L过表达组的Caspase-3/7和Caspase-9活性显著降低(P<0.01)(图3)。说明CLPTM1L过表达后抑制了吉西他滨诱导肺癌细胞凋亡的作用。
2.4 CLPTM1L过表达对p-4E-BP1的影响
研究表明,真核翻译起始因子4E结合蛋白1(Eukaryotic translation initiation factor 4E(eIF4E)-binding protein 1,4E-BP1)在肺癌细胞中高表达,可抑制肿瘤细胞对化疗药物的敏感性[5]。因此本研究检测了CLPTM1L过表达组和对照组细胞内4E-BP1的磷酸化状态,结果显示,与对照组相比,CLPTM1L过表达组p-4E-BP1表达水平显著升高(3.41±0.22,P<0.01)(图4)。
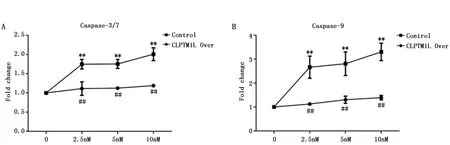
图3 吉西他滨敏作用于CLPTM1L过表达组和对照组后细胞内Caspase-3/7和Caspase-9活性的变化
图4 CLPTM1L过表达对p-4E-BP1的影响
3 讨论
CLPTM1L基因位于人染色体5p15.33,其与肺癌的关系最初是在肺癌的全基因组关联分析(Genome wide association study,GWAS)中发现的。2008年McKay等[6]报道了一项关于肺癌的GWAS研究,他们的研究结果指出5p15.33区域上的rs402710位点(CLPTM1L基因第9内含子)是肺癌的易感位点,可显著增加肺癌的发病风险。同时英国的学者发现CLPTM1L基因内另一位点rs401681的多态性与肺癌发病相关[7]。国内学者也证实在中国人中CLPTM1L是肺癌预后不良的标志物[8-10]。之后越来越多的报道揭示CLPTM1L是一个重要的肺癌易感基因[11]。然而,尽管已经证实CLPTM1L与肺癌密切相关,但是关于CLPTMIL的功能研究并不多。最初被发现时报道CLPTM1L与卵巢癌中顺铂耐药有关[2]。Ni等[3]研究发现CLPTM1L的表达水平与肺癌细胞对顺铂的敏感性相关。近年来,Clarke等[12]也发现CLPTM1L的高表达可导致胰腺癌细胞对化疗药耐药。本研究发现,CLPTM1L过表达可逆转吉西他滨对肺癌细胞增殖的抑制、抑制吉西他滨诱导细胞凋亡蛋白Caspase-3和Caspase-9的激活。因此过表达CLPTM1L可降低95-D肺癌细胞对吉西他滨的敏感性,而影响癌细胞对抗癌药物敏感性很可能就是CLPTM1L基因的主要功能。
对CLPTM1L调节肿瘤耐药机制的深入探究可使得靶向CLPTM1L的药物开发、进而为临床服务成为可能。近年来,4E-BP1在肿瘤的发生、发展和化疗药耐药中的重要作用日益受到关注。在非小细胞肺癌中,4E-BP1的高磷酸化均与高侵袭性、低生存率显著相关[13]。Roh等[14]亦发现p-4E-BP1在小细胞肺癌组织中高表达,并且其与胞质p-AKT可作为肺癌不良预后的重要指标。4E-BP1还是PI3K/Akt/mTOR通路下游的靶分子之一,而AKT/mTOR的异常激活是一种重要的致癌机制[16]。此外,4E-BP1与肿瘤细胞的药物敏感性关系密切。在前列腺癌细胞中,4E-BP1低表达的细胞对药物MLN0128(mTOR抑制剂)更敏感,而在耐药的前列腺癌细胞中下调4E-BP1的表达可增加细胞对MLN0128的敏感性;抑制4E-BP1表达增加了细胞对雷帕霉素的敏感性[17]。进一步研究显示,4E-BP1与翻译起始因子eIF4E的结合是4E-BP1介导肿瘤药物敏感性的重要机制。4E-BP1低磷酸化时与eIF4E紧密结合,4E-BP1磷酸化增高可使其与eIF4E解离,从而促进蛋白的翻译。在肺癌细胞中,敲低eIF4E可减少帽依赖性复合物形成,从而增加癌细胞对吉西他滨的敏感性[18]。本研究发现,过表达CLPTM1L后显著增加了4E-BP1的磷酸化,表明CLPTM1L抑制肺癌细胞对吉西他滨的敏感性很可能是通过增加4E-BP1的磷酸化,降低其与eIF4E结合实现的。
综上所述,本研究发现过表达CLPTM1L可抑制95-D肺癌细胞对吉西他滨的敏感性。CLPTM1L过表达可逆转吉西他滨对肺癌细胞的增殖的抑制、抑制吉西他滨诱导肺癌细胞的凋亡,其机制可能是促进了4E-BP1的磷酸化水平。

