几种茶多糖降血糖活性的研究
刘丹奇,任发政,,李景明,侯彩云,*
几种茶多糖降血糖活性的研究
刘丹奇1,任发政1,2,李景明2,侯彩云1,2*
1. 北京食品营养与人类健康高精尖创新中心,中国农业大学食品科学与营养工程学院,北京 100083;2. 食品质量安全北京实验室,中国农业大学食品科学与营养工程学院,北京 100083
研究和对比白茶多糖(White tea polysaccharide,WTP)、绿茶多糖(Green tea polysaccharide,GTP)和红茶多糖(Black tea polysaccharide,BTP)的成分、降血糖效果及机理。分别选取寿眉、龙井、白琳工夫作为白茶、绿茶和红茶的代表,测定分析茶多糖提取物的成分和分子量。以链脲佐菌素诱导小鼠糖尿病模型,二甲双胍作为阳性对照,研究茶多糖降血糖效果,qPCR测定小鼠肝脏中相关基因表达水平。结果表明,所选白茶、绿茶和红茶多糖的绝对重均分子量分别为18 180、19 470、8 745 Da。所选茶多糖提取物均具有降血糖功效,白茶、绿茶和红茶多糖干预组小鼠的血糖下降率分别为53.2%、52.8%及61.6%。茶多糖均可改善小鼠葡萄糖耐量,调节糖代谢相关基因表达,并且存在一定差异。
茶多糖;降血糖;糖代谢
糖尿病是一种常见的非传染性内分泌代谢紊乱疾病,已成为当前影响人类健康的第三大疾病[1]。当前糖尿病常用治疗药物如磺酰脲类和双胍类等,尽管疗效好、见效快,但易带来多种毒副作用[2],往往导致胰岛素依赖。因此寻求日常食物中的辅助治疗功能成分成为研究热点。
民间已有采用粗老茶治疗糖尿病的记载。张阳春等[3]研究表明,茶多糖(Tea polysaccharide,TPS)可能是粗老茶治疗糖尿病的主要药理成分。Zhou等[4]对茶叶提取物、粗茶多糖和茶多糖的降血糖效果进行了研究,得出茶多糖是茶叶中主要降血糖因子的结论。茶多糖是茶叶中存在的一类具有多种生物活性的多糖复合物,多为与蛋白质结合的酸性糖蛋白[5]。目前已有研究表明茶多糖具有降血糖[1]、抗氧化[6]、降血脂[7]、抗癌[8]、免疫调节[9]、抗疲劳[10]等多种生物功效。茶叶种类对茶多糖的降血糖活性会产生影响[11],但相关研究较少,且多集中于绿茶、红茶、乌龙茶等茶类[12],白茶多糖缺少深入研究和对比。本研究选取寿眉白茶多糖作为研究对象,与龙井绿茶多糖、白琳工夫红茶多糖的成分和降血糖效果进行研究和对比,并进一步探究其潜在作用机制。
1 材料与方法
1.1 材料、试剂与试验动物
白茶多糖提取物(White tea polysaccharide,WTP)、绿茶多糖提取物(Green tea polysaccharide,GTP)、红茶多糖提取物(Black tea polysaccharide,BTP),定购于陕西杨凌慈缘生物技术有限公司,参照文献[13]中的工艺进行提取。
链脲佐菌素(Streptozotocin,STZ)、葡聚糖标准品(美国Sigma公司);盐酸二甲双胍片[中美(上海)施贵宝制药有限公司];异丙醇、氯仿、无水乙醇等(分析纯,北京化工厂有限责任公司);DEPC水、Trizol试剂(碧云天生物科技有限公司);5X All-In-One RT MasterMix试剂盒、EvaGreen 2X qPCR MasterMix-No Dye试剂盒(美国abm公司);引物[生工生物工程(上海)股份有限公司]。
SPF级雄性4周龄ICR小鼠[许可证号SCXK(京)2016-0002,北京斯贝福生物技术有限公司];45%脂肪供能高脂高糖饲料(北京华阜康生物科技股份有限公司)。小鼠于屏障环境动物房[温度(22±2)℃,湿度(50±5)%,压差20~50 Pa,12 h昼夜交替]进行试验。
1.2 仪器与设备
Wyatt Technology DAWN EOS多角度激光光散射仪;Biometra T-personal梯度PCR仪;Roche lightcycler 96荧光定量PCR仪等。
1.3 方法
1.3.1 茶多糖提取物分子量的测定
采用尺寸排阻色谱和多角度激光光散射仪联用装置(SEC-MALLS)测定样品的绝对重均分子量。选用Shodex OHpak SB-806MHQ(8 mm×300 mm,13 μm)色谱柱,示差折光检测器检测。多角度激光光散射仪波长为658.0 nm,柱温25℃,流动相为0.1 mol·L-1氯化钠+叠氮化钠的水溶液,洗脱流速为0.5 mL·min-1,进样量200 μL,样品溶液浓度1 mg·mL-1,用0.2 μm滤膜过滤。用Mn=40 000 Da的葡聚糖标准品作为对照。
1.3.2 茶多糖提取物的理化成分测定
分别采用苯酚-硫酸比色法[14]测定茶多糖含量,考马斯亮蓝试剂盒法测定蛋白质含量,福林酚法[15]测定茶多酚含量。
1.3.3 动物试验
小鼠置于屏障环境动物房适应性喂养7 d后,随机选取10只作为正常对照组(NC)喂养小鼠维持饲料,其余小鼠换为45%高脂高糖饲料,连续喂养4周后,隔夜禁食12 h,使粉末状STZ溶解于pH为4.2~4.5的柠檬酸盐缓冲液,小鼠腹腔注射STZ溶液110 mg·kg-1,1周后测定血糖,空腹血糖(Fasting blood glucose,FBG)≥11.1 mmol·L-1视为造模成功[16]。将造模成功的小鼠按照FBG随机分组:模型对照组(MC)、阳性对照组(PC)、WTP干预组、GTP干预组和BTP干预组,每组10只小鼠。
茶多糖干预组参照已有研究[12],制定小鼠每日灌胃剂量为300 mg·kg-1。PC组选用药物盐酸二甲双胍,根据成年人的每日最大剂量(1.0~1.5 g),换算成小鼠每日用药剂量为:250 mg·kg-1[17]。各干预组灌胃时间均为4周。
1.3.4 葡萄糖耐量试验
4周干预结束前,将所有小鼠隔夜禁食不禁水15 h,取尾尖血测定FBG,作为0时血糖。之后对每只小鼠灌胃葡萄糖1.5 g·kg-1,记录灌胃后30、60、90、120 min血糖,并绘制时刻-血糖折线图[18],按照以下公式计算折线图的曲线下面积(Area under the curve,AUC)。
AUC/mmol·h-1·L-1=(/2++++/2)/2
式中,、、、、分别表示0、30、60、90、120 min时刻的血糖值。
1.3.5 生化指标检测
4周干预结束后,将所有小鼠禁食12 h,采血后处死。将血样在4℃,4 000 r·min-1离心15 min,分离血清样本,按照试剂盒说明书方法测定血清中胰岛素含量(Fasting insulin,FIS)。
1.3.6 胰腺组织病理学分析
小鼠断颈处死后剖取胰腺组织,置于4%多聚甲醛固定液固定48 h,常规取材,脱水,石蜡包埋,制片(4 μm厚),HE染色,光学显微镜观察胰腺组织的病理学变化,并于200倍视野拍照。
1.3.7 实时荧光定量PCR检测
测定基因:叉头转录因子(Forkhead boxo1,Foxo1)、葡萄糖-6-磷酸酶(Glucose-6-phosphatase,G6Pc)、磷酸烯醇式丙酮酸羧化酶(Phosphoenolpyruvate carboxykinase,PEPCK)和硫氧还蛋白互作蛋白(Thioredoxin interacting protein,TXNIP),引物序列如表1所示。
1.4 数据处理
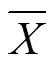
2 结果与分析
2.1 茶多糖提取物的分子量测定结果
先采用1.3.1所述方法对葡聚糖标准品进行测定,确定方法的精确度后对3种样品进行测定,结果如图1所示。
图谱表明,TPS均含有杂峰,且峰形较宽,不具有单一对称的峰形,三者均为不均一的杂多糖。根据测定方法换算出WTP、GTP及BTP的绝对重均分子量分别为18 180 Da、19 470 Da及8 745 Da。三者分子量的差异推测与原料种类有关。绿茶在杀青工序时就已经使酶失活了,白茶和红茶经过了不同程度的氧化,利用了各种氧化酶、水解酶的作用,使得糖链和肽链都相对较短[11],可能使重均分子量减小。
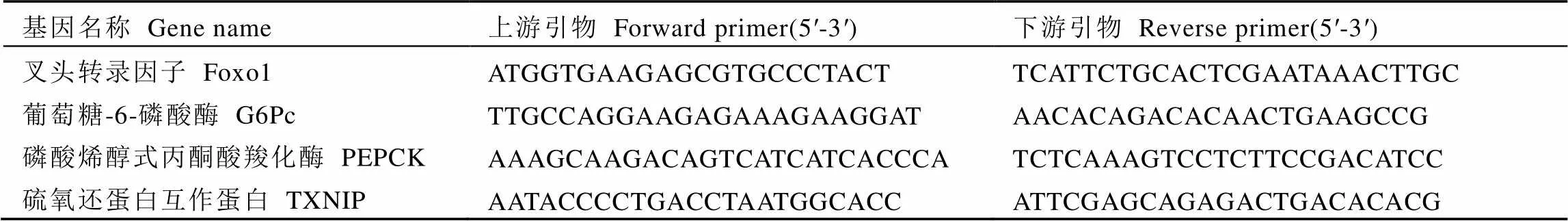
表1 引物序列
2.2 茶多糖提取物的主要成分
由表2可见,3种茶多糖提取物的主要成分含量均无显著差异。
2.3 茶多糖提取物降血糖作用的相关测定结果
2.3.1 对糖尿病小鼠体重、始末血糖及胰岛素抵抗指数(HOMA-IR)的影响
造模成功后的小鼠均出现糖尿病典型的多尿、多饮、多食、体重减轻症状[20]。胰岛素抵抗作为糖尿病的发病基础,表现为胰岛素作用的靶器官对胰岛素的敏感性下降,机体代偿性分泌过多胰岛素产生高胰岛素血症的状态[21]。改善小鼠的胰岛素抵抗水平可有效提高胰岛素敏感性,从而改善高胰岛素血症。衡量的指标之一为胰岛素抵抗指数,计算公式参照文献[22]:HOMA-IR=FBG×FIS/22.5。对小鼠体重变化、始末血糖及HOMA-IR的测定结果如图2所示。
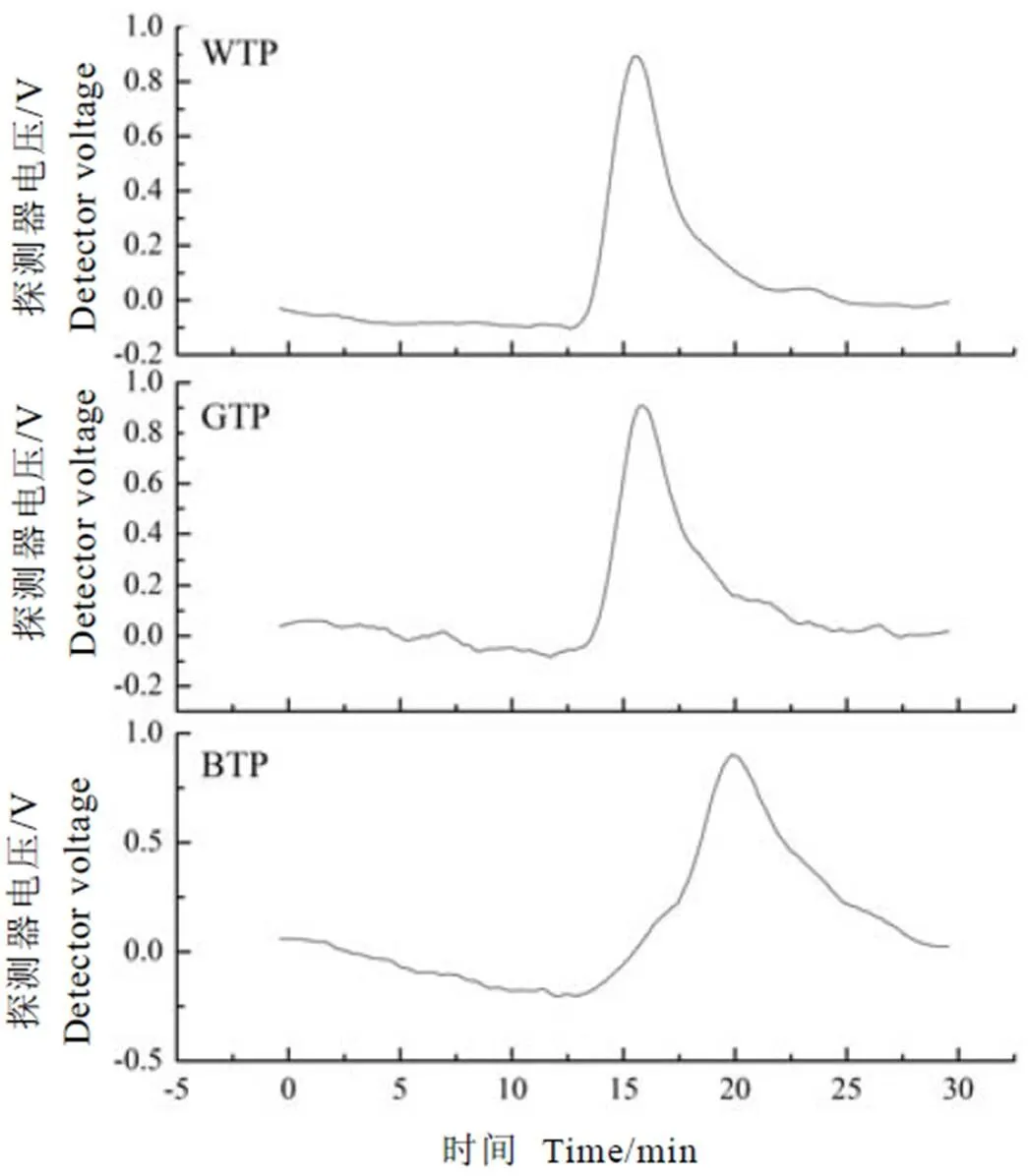
图1 茶多糖提取物的分子量测定结果

表2 茶多糖提取物的主要成分
注:表格每列字母不同表示差异显著,<0.05,字母相同表示差异不显著,
Note: The difference in the letter in each column of the table indicates that the difference is significant,<0.05, and the same letter indicates that the difference is not significant
由图2-A可见,NC组体重较稳定,MC及PC组波动幅度较大,整体呈下降趋势。多糖干预组整体体重在第3、4周趋于平缓。为明显区分组间差异,以造模成功后的第1周体重为起始体重,计算各组的体重增长百分比,如图2-B所示。MC组呈现负增长,推测与糖尿病模型诱导有关。TPS组的体重增长百分比均显著高于MC组(<0.05),PC组极显著高于MC组(<0.01),表明它们都有利于缓解糖尿病造成的体重下降情况。
由图2-C可知,小鼠在造模成功后测定初始FBG,各组间无显著差异(>0.05)。经4周喂养后,MC组FBG有所升高,但并未达到显著水平(>0.05),药物和多糖干预组FBG均降低,PC组、WTP组、GTP组和BTP组的血糖下降率分别为53.2%、53.2%、52.8%、61.6%。由此可知WTP组降血糖效果和PC组相当,逊于BTP组,略优于GTP组。
由图2-D可见,小鼠造模成功后的IR值明显增加,其中MC组极显著高于NC组(<0.01)。药物组及多糖干预组极显著低于MC组(<0.01),均有很好的缓解胰岛素抵抗效果,其中BTP组效果最优,WTP组效果略逊于GTP组和BTP组,但未达到显著差异水平(>0.05)。
注:(A)体重;(B)体重增长比;(C)始末血糖;(D)胰岛素抵抗指数;*表示与正常组相比,P<0.05,**表示P<0.01;#表示与模型组相比,P<0.05,##表示P<0.01
2.3.2 茶多糖提取物对糖尿病小鼠葡萄糖耐量的影响
口服葡萄糖耐量试验(Oral glucose tolerance test,OGTT)作为一种用以了解胰岛细胞功能和机体对血糖调节能力的葡萄糖负荷试验,具有衡量降血糖效果的意义[23]。小鼠在4周喂养结束后进行该试验,记录小鼠2 h内血糖变化如图3-A所示。NC组小鼠血糖在120 min时恢复正常,MC组血糖下降较为缓慢,表现出明显的葡萄糖不耐受。为区分其他干预组的组间差异,对曲线AUC进行计算,结果如图3-B所示。GTP组AUC显著低于MC组(<0.05),显示出较好的改善小鼠葡萄糖耐量的效果;PC组、WTP组和BTP组AUC则极显著低于MC组(<0.01),三者之间无显著差异(>0.05),其中BTP效果最优,PC组次之,WTP组略逊于PC组,GTP组最差。
2.3.3 小鼠胰腺组织的病理学分析
小鼠胰腺组织HE染色结果如图4所示。NC组小鼠胰岛形状规则,胰岛细胞分布均匀,腺泡细胞形态正常,组织未发生病变。MC组小鼠胰岛形状不规则,腺泡大量消失,并伴有组织增生,可见较多丝网状物质,整体表明MC组胰岛损伤严重,有脂肪变性征兆。PC组胰岛形状不规则,大量胰岛细胞胞质疏松或呈空泡状,局部胰岛附近可见淋巴细胞浸润,整体表明小鼠胰岛细胞损伤较严重,可见二甲双胍药物对改善小鼠胰腺组织病变的效果并不明显。
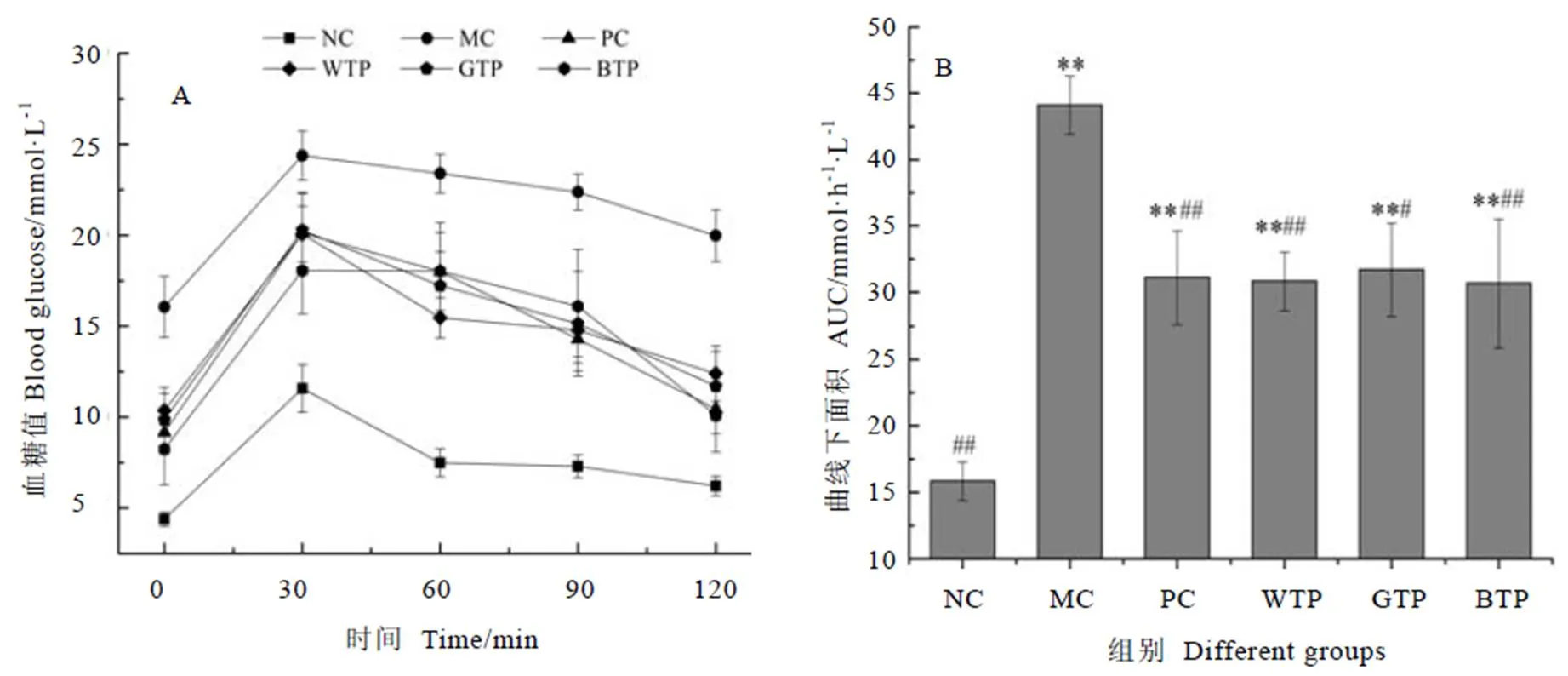
注:(A)2 h内血糖变化;(B)血糖曲线下面积。*表示与正常组相比,P<0.05,**表示P<0.01;#表示与模型组相比,P<0.05,##表示P<0.01

图4 小鼠胰腺组织病理学分析
组小鼠局部导管周围结缔组织中可见少量炎性细胞浸润;BTP组小鼠一处胰岛周围少量炎性细胞灶性浸润,未见其他明显异常。整体表明,试验所选茶多糖提取物均能改善小鼠胰腺组织的病理状态,但未能使其恢复正常,组间差异也并不明显。多糖干预组在改善小鼠胰腺组织病变方面明显优于二甲双胍药物组。
2.3.4 茶多糖提取物对糖尿病小鼠肝组织相关基因表达的影响
为探究茶多糖提取物的潜在降血糖机理,对小鼠肝脏中有关基因的相对表达量进行定量测定,结果如图5所示。
基因是胰岛细胞的一种关键调控因子,对其增殖存在抑制作用[24],进而导致胰岛素分泌减少,使血糖升高。由图5-A可知,MC组的基因相对表达量极显著高于NC组(<0.01),干预组与MC组相比均极显著下调了基因相对表达量(<0.01),其中BTP组效果最优。由此可见,茶多糖能够通过下调基因的相对表达量这一途径降低小鼠高血糖水平。
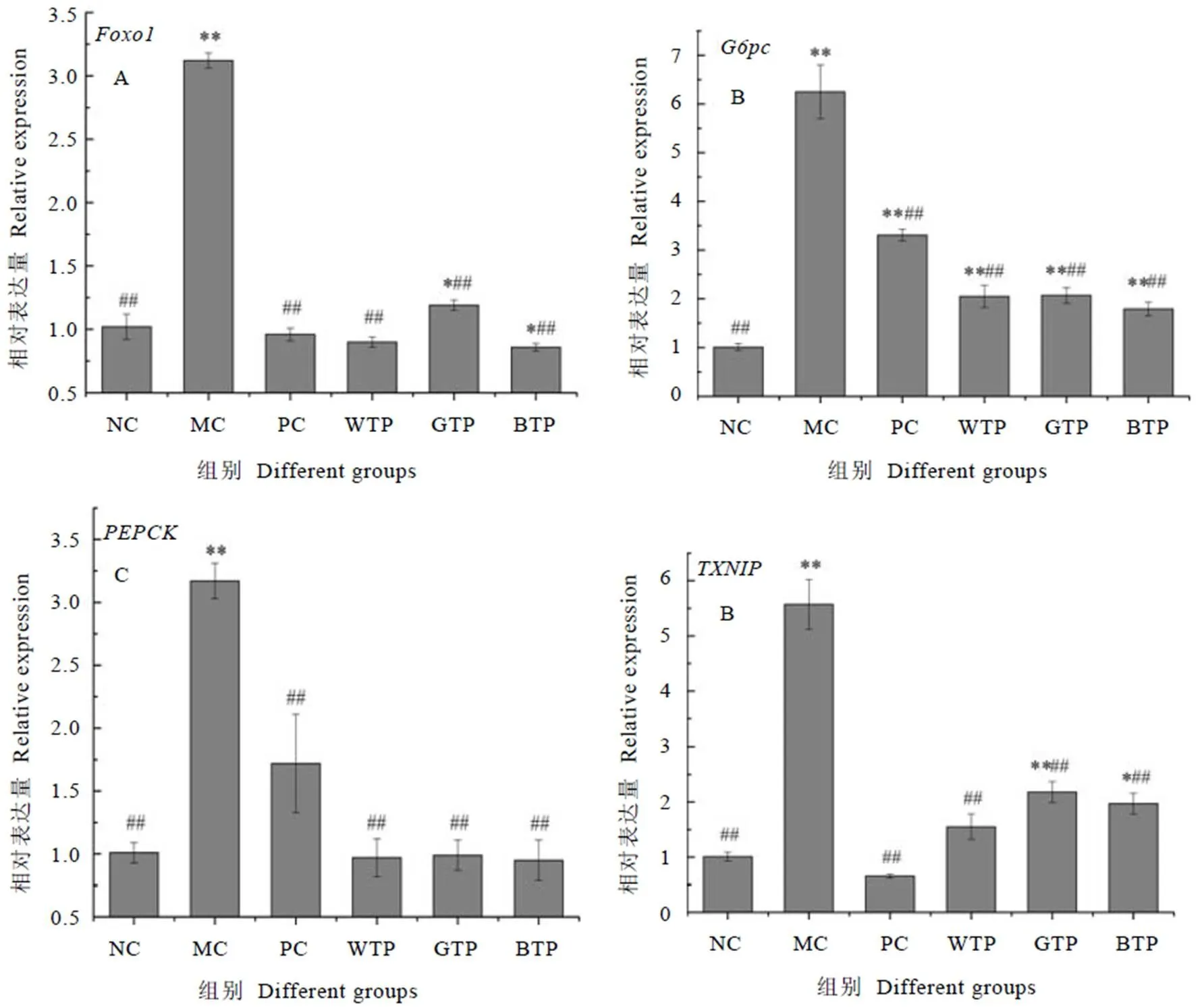
注:(A)叉头转录因子基因;(B)葡萄糖-6-磷酸酶基因;(C)磷酸烯醇式丙酮酸羧化酶基因;(D)硫氧还蛋白互作蛋白基因。*表示与正常组相比,P<0.05,**表示P<0.01;#表示与模型组相比,P<0.05,##表示P<0.01
基因和基因均为糖异生途径调控基因,在肝脏中表达量的增加会促进非糖物质转化为葡萄糖,进而转运至血管中提高血糖水平[25]。由图5-B和图5-C可知,MC组的两种基因相对表达量均极显著高于NC组(<0.01),药物和多糖干预组与MC组相比均能够极显著下调两种基因的相对表达量(<0.01),但各组之间无显著差异(>0.05)。其中,BTP组效果最优。这表明茶多糖能够通过抑制糖异生途径关键基因表达降低小鼠血糖水平。
基因是一种细胞炎症因子,其表达量的增加会促进胰岛细胞的凋亡[26]。由图5-D可知,MC组的相对表达量极显著高于NC组(<0.01),与MC组相比,药物与多糖干预组均能极显著下调基因相对表达量(<0.01)。多糖组效果均明显弱于PC组,其中WTP组在多糖干预组中效果最优,表明白茶茶多糖在消除炎症因子,保护胰岛细胞方面具有优势。
3 结论
本文选取的茶多糖提取物均具有改善小鼠糖尿病症状的作用,降血糖效果存在差异。其中红茶多糖在降低小鼠空腹血糖水平、降低胰岛素抵抗指数、改善葡萄糖耐量等方面具有优势;白茶多糖在改善小鼠体重减轻情况等方面具有优势。
试验所选茶多糖提取物均可下调和基因的表达量,抑制葡萄糖的生成,进而降低血糖;同时,茶多糖均可下调基因的表达,减弱对胰岛细胞的抑制,从而改善糖尿病症状,其中红茶多糖效果最优。此外,茶多糖对细胞炎症分子基因的表达也有抑制作用,缓解胰岛细胞的凋亡,其中白茶多糖效果最优。整体表明,茶多糖可通过调控糖代谢途径和调控胰岛细胞途径发挥降血糖活性。
茶多糖的分子量范围、单糖组成、糖链结构等均为影响其生物活性的因素[27]。原料来源、提取方法等都会对茶多糖的基础理化结构造成影响,进而影响生物活性。本试验选取的茶多糖提取物降血糖效果整体规律与茶叶氧化程度较为一致(红茶>白茶>绿茶),分子量由大到小分别为绿茶多糖、白茶多糖和红茶多糖。推测茶叶原料的发酵氧化可能使得糖链缩短,导致茶多糖提取物重均分子量的降低,进而提高了茶多糖提取物的降血糖活性。茶多糖在不同生化指标和基因表达调节中呈现的不同优势为针对性选择降血糖的物质提供了参考。
茶多糖的降血糖活性会受到很多因素影响,降糖作用途径较多,靶点也不止一处[25],剂量、纯度、结构、吸收方式等因素对其降血糖活性的影响以及茶多糖的其他作用途径和降糖靶点有待进一步研究。
[1] 宋林珍, 朱丽云, 高永生, 等. 茶多糖的结构特征与降血糖活性[J]. 食品科学, 2018, 39(19): 162-168.
[2] Bergenstal R M, Wysham C, Macconell L, et al. Efficacy and safety of exenatide once weekly versus sitagliptin or pioglitazone as an adjunct to metformin for treatment of type 2 diabetes (DURATION-2): a randomised trial [J]. Lancet, 2010, 376(9739): 431-439.
[3] 张阳春, 杨敏, 蔡成永, 等. 粗老茶治糖尿病的药理成分分析[J]. 中草药, 1995(5): 255-257.
[4] Zhou X, Wang D, Sun P, et al. Effects of soluble tea polysaccharides on hyperglycemia in alloxan-diabetic mice [J]. Journal of Agricultural & Food Chemistry, 2007, 55(14): 5523-5528.
[5] 邵淑宏. 乌龙茶多糖理化性质及抗氧化、降血糖活性研究[D]. 杭州: 浙江大学, 2015.
[6] Wang Y F, Li Y F, Liu Y Y, et al. Extraction, characterization and antioxidant activities of Se-enriched tea polysaccharides [J]. International Journal of Biological Macromolecules, 2015, 77: 76-84.
[7] 张芸, 倪德江, 陈永波, 等. 乌龙茶多糖调节血脂作用及其机制研究[J]. 茶叶科学, 2011, 31(5): 399-404.
[8] He N, Shi X, Zhao Y, et al. Inhibitory effects and molecular mechanisms of selenium-containing tea polysaccharides on human breast cancer MCF-7 cells [J]. Journal of Agricultural & Food Chemistry, 2013, 61(3): 579-588.
[9] Ferreira S S, Passos C P, Madureira P, et al. Structure-function relationships of immunostimulatory polysaccharides: A review [J]. Carbohydr Polym, 2015, 132: 378-396.
[10] 蒋成砚, 谢昆, 薛春丽, 等. 普洱茶多糖抗疲劳作用研究[J]. 安徽农业科学, 2012, 40(1): 154-155.
[11] 倪德江, 谢笔钧, 宋春和. 不同茶类多糖对实验型糖尿病小鼠治疗作用的比较研究[J]. 茶叶科学, 2002, 22(2): 160-163.
[12] 倪德江, 陈玉琼, 谢笔钧, 等. 绿茶、乌龙茶、红茶的茶多糖组成、抗氧化及降血糖作用研究[J]. 营养学报, 2004(1): 57-60.
[13] 孙苏军, 纪海玉, 白云, 等. 坦洋工夫红茶多糖提取工艺优化及其抑制肿瘤活性分析[J]. 食品科学, 2018, 39(4): 254-260.
[14] 张媛媛, 张彬. 苯酚-硫酸法与蒽酮-硫酸法测定绿茶茶多糖的比较研究[J]. 食品科学, 2016, 37(4):158-163.
[15] 中华人民共和国国家质量监督检验检疫总局. 茶叶中茶多酚和儿茶素含量的检测方法: GB/T 8313—2008[S]. 北京: 中国标准出版社, 2008.
[16] Islam M S, Loots T D. Experimental rodent models of type 2 diabetes: a review [J]. Methods & Findings in Experimental & Clinical Pharmacology, 2009, 31(4): 249. DOI: 10.1358/mf.2009.31.4.1362513.
[17] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072.
[18] 玄光善, 潘士佳, 南姬. 桑叶有效成分降糖作用研究[J]. 食品科学, 2011, 32(7): 323-326.

[20] 闫济民. 糖尿病的典型症状[J]. 中国慢性病预防与控制, 2009, 16(4): 25.
[21] 李秀钧, 钱荣立. 胰岛素抵抗及其临床意义[J]. 中国糖尿病杂志, 1999(3): 163-167.
[22] Tang W P, Li S M, Liu Y, et al. Anti-diabetic activity of chemically profiled green tea and black tea extracts in a type 2 diabetes mice model via different mechanisms [J]. Journal of Functional Foods, 2013, 5(4): 1784-1793.
[23] Garancini M P, Calori G, Ruotolo G, et al. Prevalence of NIDDM and impaired glucose tolerance in Italy: an OGTT-based population study [J]. Diabetologia, 1995, 38(3): 306-313.
[24] 黄荷, 夏宁. Foxo1对糖尿病胰腺β细胞的作用[J]. 内科, 2009, 4(3): 404-407.
[25] Wu J J, Shi S S, Wang H J, et al. Mechanisms underlying the effect of polysaccharides in the treatment of type 2 diabetes: A review [J]. Carbohydrate Polymers, 2016, 144: 474-494.
[26] Shalev A. Lack of TXNIP protects β-cells against glucotoxicity [J]. Biochemical Society Transactions, 2008, 36(5): 963-965.
[27] 陈小强, 叶阳, 成浩, 等. 不同方法提制的茶叶粗多糖的光谱分析.[J]. 光谱学与光谱分析, 2009, 29(4): 1083-1087.
Comparative Study on the Structure and Hypoglycemic Activity of Several Tea Polysaccharides
LIU Danqi1, REN Fazheng1,2, LI Jingming2, HOU Caiyun1,2*
1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. Beijing Laboratory for Food Quality and Safety, College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China
To study and compare the composition, blood sugar lowering effect and composition of WTP, GTP and BTP. Shoumei, Longjing and Bailingongfu were selected as representatives of white tea, green tea and black tea, and the composition, molecular weight of tea polysaccharides were determined. The mice diabetes model was induced by streptozotocin, metformin was used as a positive control to study the hypoglycemic effect of tea polysaccharides, and qPCR was used to determine the expression level of related genes in mice liver. The results showed thatthe molecular weights of WTP, GTP and BTP are 18 180 Da, 19 470 Da and 8 745 Da, respectively. The selected tea polysaccharides have hypoglycemic effect, the fasting blood glucose decline rates of WTP, GTP and BTP were 53.2%, 52.8% and 61.6%, respectively. Tea polysaccharides can all improve glucose tolerance, down-regulate the expression of,,andgenes in mice and there are some differences.
tea polysaccharides, hypoglycemic, sugar metabolism
TS201.4
A
1000-369X(2019)06-652-09
2019-03-11
2019-06-12
北京食品营养与人类健康高精尖创新中心开放基金项目
刘丹奇,女,硕士,主要从事茶叶功能性成分评价方面的研究,951442196@qq.com。
food319@139.com

