2 554例胃息肉病理类型与临床特征分析
周郁芬,罗芳秀,朱时燕,忻笑容,丁燕飞,袁晓琴,吴云林,陈 平
上海交通大学医学院附属瑞金医院北院 1.消化内科;2.病理科,上海 200003
胃息肉是胃黏膜增生性或肿瘤性病变,从周围黏膜增生指向胃肠腔内,分为头部和基底部,病理类型主要包括胃底腺息肉、增生性息肉、炎性息肉和腺瘤性息肉[1]。胃息肉在上消化道内镜检查中的检出率为1%~10%[2-4],属于胃癌的癌前疾病。不同病理类型的胃息肉癌变率各不相同,增生性息肉癌变率为0.4%~2.1%,腺瘤性息肉的癌变率为10%~23.1%[1],既往认为不会发生癌变的胃底腺息肉,也有报道发生癌变的个案。随着我国内镜检查的普及、胃息肉的检出率逐渐提高、质子泵抑制剂(PPIs)的广泛应用及H.pylori的根除治疗,胃息肉的病理类型也随之改变[3, 5-6]。因此本文回顾性分析了在我院胃镜检查时检出的胃息肉患者的临床、内镜和病理特征,分析不同病理类型胃息肉的差异,对于提高临床工作中对胃息肉的识别及后续诊治有一定裨益。
1 资料与方法
1.1 临床资料收集2012年12月至2017年12月上海交通大学医学院附属瑞金医院北院消化内科检出的胃息肉病例。将有病理结果的胃息肉患者纳入研究。对于同一患者分别进行胃镜检查及胃镜治疗的记为1例,并以治疗后胃镜病理为标准,同时排除胃切除术后、上消化道恶性肿瘤的患者,最后共入组2 554例胃息肉患者。年龄(54.94±12.29)岁(8~88岁),男880例,女1 674例,男女比例为1∶1.9。
1.2 方法收集患者的一般情况,如年龄、性别;内镜下特征:部位、数量、大小、巴黎分型;病理结果:是否合并H.pylori感染、萎缩性胃炎、肠化、上皮内瘤变等。年龄按大小分为5组:<30岁、30~39岁、40~49岁、50~59岁、≥60岁;息肉根据部位分为:贲门、胃底、胃体、胃角、胃窦、幽门、多部位;根据息肉的数量分为单发性、多发性;根据大小分为4组:<0.5 cm、0.5~0.9 cm、1~1.9 cm、≥2 cm;根据巴黎分类法,胃内隆起性病灶定义为巴黎0-I,其中带蒂息肉分为巴黎0-Ip型,无蒂息肉分为巴黎0-Is型,介于两者之间分为巴黎0-Isp型(见图1)。根据病理结果分为:炎性息肉、增生性息肉、胃底腺息肉、腺瘤性息肉。当息肉活检病理提示有上皮内瘤变的记为合并上皮内瘤变(见图2),当胃内任意部分活检提示H.pylori感染、萎缩、肠化记录为H.pylori、萎缩、肠化阳性。


图1 内镜下巴黎分型图片
2 结果
2.1 胃息肉病理类型与年龄、性别的关系入组2 554例胃息肉患者中炎性息肉1 015例(39.74%)、增生性息肉916例(35.86%)、胃底腺息肉583例(22.83%)、腺瘤性息肉40例(1.57%)。胃息肉随着年龄的增加而增加,各病理类型息肉间随着年龄变化的差异无统计学意义(χ2=1.54,P=0.82),而不同年龄组别中息肉发生率差异有统计学意义(χ2=11.84,P<0.01)。女性患者中息肉构成比明显高于男性(χ2=15.73,P<0.01)(见表1、图3)。
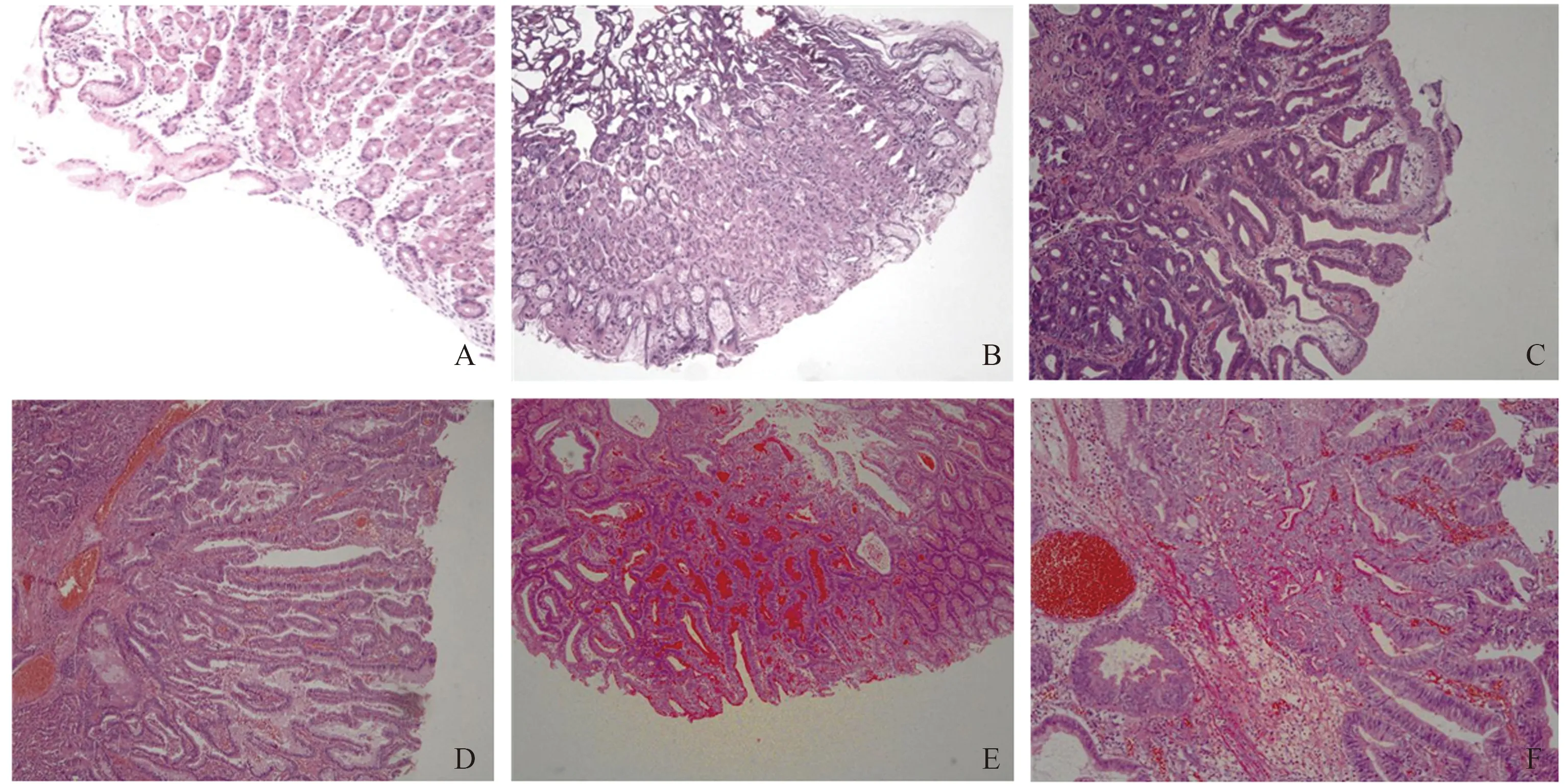
图2 胃息肉病理类型(HE染色,B、E:放大50倍;A、C、D、F:放大100倍)
Fig 2 Gastric polyps pathological picture (HE staining, B, E: 50×; A, C, D, F: 100×)
A: inflammatory polyps; B: gastric gland polyps; C: hyperplastic polyps with low grade intraepithelial neoplasia; D: adenomatous polyps; E: adenomatous polyps with low grade epithelium intrinsic neoplasia; F: adenomatous polyps with focal high-grade intraepithelial neoplasia

表1 胃息肉病理类型与年龄、性别的关系
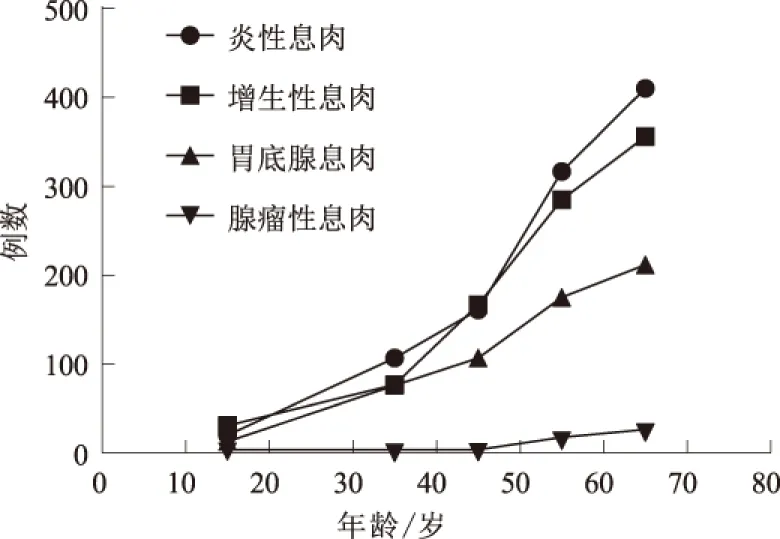
图3 胃息肉病理类型随年龄分布
2.2 胃息肉内镜特征与病理结果的关系入组的2 554例胃息肉患者中,以胃体部息肉最常见(1 024例),其次为胃窦部(583例),多个部位同时发现息肉的有330例。炎性息肉、增生性息肉、腺瘤性息肉以胃体及胃窦为主,其中胃底腺息肉以胃底和胃体为主,腺瘤性息肉发生于多部位比例较高(见表2)。
单发息肉较多发息肉常见,入组患者中共1 705例为单发息肉,腺瘤性息肉多发性息肉相对多见(45%)。息肉按大小分为4组:<0.5 cm、0.5~0.9 cm、1~1.9 cm、≥2 cm,腺瘤性息肉由于总体例数较少,单独按右侧纵轴画图,其余3类息肉(炎性息肉、增生性息肉、胃底腺息肉)均按左侧纵轴画图。图中可见随着息肉大小增大,炎性息肉、增生性息肉、胃底腺息肉均呈下降趋势,而腺瘤性息肉呈上升趋势(见图4)。腺瘤性息肉中巴黎0-Ip型比例较高(42.50%),胃底腺息肉中很少见巴黎0-Ip型(见表3)。
2.3 胃息肉病理类型与H.pylori感染、胃内发生萎缩及肠化的关系H.pylori感染是胃癌的危险因素之一,而胃息肉是胃癌的癌前疾病,故在此分析了胃息肉病理类型和H.pylori感染的相关性。此次入组的患者中,H.pylori感染共561例(21.97%),而胃底腺息肉的H.pylori感染率明显低于其他3组(见表4)。
在合并萎缩及肠化的患者中,炎性息肉发生的比例略微高于其他3组。炎性息肉组患者中发生萎缩及肠化分别为250例(24.63%)、375例(36.95%)(见表4)。

图4 息肉大小与病理类型 息肉大小与病理类型分布有相关性,随着息肉增大,腺瘤性息肉的比例增加
2.4 发生上皮内瘤变的胃息肉特征在入组的2 554例胃息肉中,共有54例(2.11%)胃息肉合并上皮内瘤变,其中2例合并高级别上皮内瘤变。2例高级别上皮内瘤变均发生于胃窦,2例为巴黎0-Is型增生性息肉,大小约1.5 cm;另1例为巴黎0-Ip型绒毛状管状腺瘤,大小约2.5 cm。
各病理类型的胃息肉中,以腺瘤性息肉中发生上皮内瘤变的概率最高,腺瘤性息肉中有14例发生上皮内瘤变(35.00%);以≥2 cm的息肉中发生上皮内瘤变的概率最高,共5例(17.86%),差异有统计学意义(P<0.05)。各巴黎分型中发生上皮内瘤变的差异无统计学意义(P=0.15)(见表5)。

表2 胃息肉病理类型的胃内分布情况

表3 胃息肉病理类型与息肉数量、大小、巴黎分型的的关系
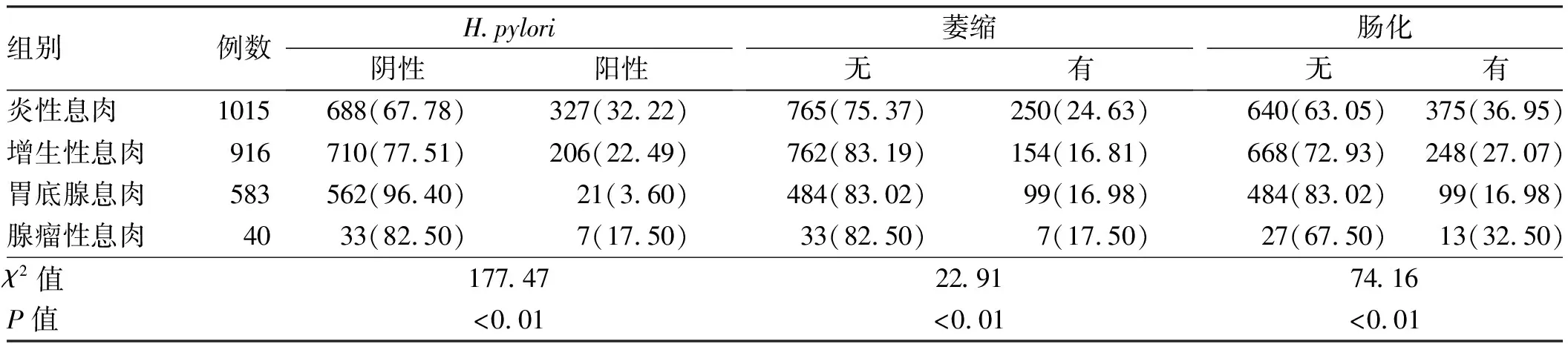
表4 胃息肉病理类型与H.pylori感染、萎缩、肠化间的相关性
3 讨论
胃息肉是胃癌前疾病之一,随着PPIs使用日渐普及,以及H.pylori根除治疗的推广,胃疾病如胃炎类型、胃萎缩情况、胃息肉类型均有所变化。文献报道胃息肉在上消化道内镜检查中的检出率为1%~10%[2-4],我国学者报道的胃息肉检出率为1%~4.20%[3, 6-7]。在一项纳入405 211例患者的研究中发现,胃息肉患者发生胃癌的发病率为58.2/10万人[8]。

表5 病理类型、息肉大小、巴黎分型与上皮内瘤变的关系
大部分学者研究发现,所有类型的胃息肉均表现出明显的年龄依赖性上升[4,7,9]。其中SONNENBERG等[4]研究还发现,胃底腺息肉在70岁以后呈下降趋势、胃增生性息肉在80岁以后呈下降趋势,而腺瘤性息肉随年龄增加呈持续上升趋势。此外,FAN分析了中国过去的10年中观察到胃息肉随年龄分布改变,发现45~59岁的胃息肉患者是10年前的2倍,但60岁及以上的胃息肉患者仅为10年前的一半[6]。本研究也提示,不同病理类型的胃息肉患者数量均随年龄增加而增加,但受入组病例数的限制,本研究中并未对60岁以后的患者进行分组,故未能体现60岁以后患者胃息肉病理的发生趋势。SONNENBERG等[4]认为,女性接受胃镜检查及活检多于男性,与对照组相比,女性优势在胃底腺胃息肉中更为明显,而腺瘤性息肉患者性别差异不明显。本研究中女性胃息肉构成比明显高于男性,但在不同病理类型的胃息肉中并无差异。
胃息肉常见病理类型有增生性、炎性、胃底腺和腺瘤性息肉。胃增生性息肉的发展起因于小凹细胞的过度增殖伴随着其剥脱增加,间质内有少量炎性细胞浸润,当息肉中炎性细胞浸润明显并占主导时,称为炎性息肉。国外的研究中常将增生性和炎性息肉归类为增生性息肉[10-12]。而本研究中仍按增生性、炎性、胃底腺和腺瘤性息肉4种病理类型对胃息肉进行分类。指南推荐对于>1 cm的胃底腺、>0.5 cm的增生性息肉及任何大小的腺瘤性息肉进行治疗[13]。
胃增生性息肉可以是单发(68%~75%)或多发,偶尔发生(孤立息肉)或罕见增生性息肉综合征(50个或更多息肉)的组成部分,而且癌变不仅可以在增生性息肉内出现,增生性息肉周围黏膜还被认为是易发生癌的黏膜标志[1-2, 14]。有研究显示,在过去的10年中胃增生性息肉发生的位置已经发生了变化;息肉的发生率在胃体中增加(19%vs32%),而胃窦减少(46%vs24%)[3]。而本文中胃增生性息肉最常见部位为胃体(35.8%),且单发多见(68.56%),与其他研究者的结论相符。腺瘤性息肉或称胃腺瘤发生癌变率最高,它们的组织学分为管状、绒毛状和管状绒毛状。可以在胃的任何地方找到,但通常在胃窦中发现,这与本研究的结论相同[11]。它们经常出现在萎缩性胃炎和肠上皮化生的背景下,但未证实与H.pylori相关。直径>2 cm的息肉进展为胃癌概率更高,且28.5%~40%的绒毛状腺瘤和5%的管状腺瘤中可发生癌变,腺瘤性息肉和癌变率随着年龄的增长而增加。只有少量(<3%)的胃增生性息肉发生上皮内瘤变[1]。虽然通常认为胃底腺息肉和胃癌关系不大,但也有文献报道胃底腺息肉基础上发生印戒细胞癌的病例报道[15]。本研究提示,约有2.11%胃息肉患者合并上皮内瘤变,炎性息肉患者共19例(1.87%),增生性息肉19例(2.07%),腺瘤性息肉14例(35%),胃底腺中也发现2例发生上皮内瘤变(0.34%),其中腺瘤性息肉、≥2 cm息肉中发生上皮内瘤变比例最高,与腺瘤性息肉癌变率最高这个事实相符。
胃息肉的患病率存在地理差异。在西方国家,胃增生性息肉的发病率下降[2],而在H.pylori流行率高的地区,胃增生性息肉的报道更频繁[1]。近期国内外的一些研究认为,胃底腺息肉的发病率呈上升趋势,甚至有些地区胃底腺息肉成为胃息肉中发病率最高的病理类型,目前考虑胃底腺发病率上升与长期使用PPIs、H.pylori感染率下降有关[3,5,8]。SONNENBERG等[4]研究认为,所有胃息肉患者H.pylori的组织学证据发现频率明显低于非息肉组患者,而胃底腺息肉患者差异更为显著。肠上皮化生及萎缩在腺瘤性息肉中更常见,在胃底腺息肉中比在对照组中更少见。本研究也发现,胃底腺息肉患者H.pylori感染率最低,且低于同期我国的总体H.pylori感染率(37.7%)[3]。但本研究中萎缩及肠化在腺瘤性息肉中发生率并不高,考虑与胃镜活检部位选择导致的选择偏倚有关。
胃息肉是一种常见的胃内病变,虽然临床症状缺乏特异性,但通常胃镜检查就能检出。不同病理类型在内镜下的表现、H.pylori感染率、发生癌变的概率不同,而且近年来胃息肉不同病理类型的发生率有所变化,因此在临床工作中需不断加强总结以提高认识。

