软枣猕猴桃L-半乳糖内酯脱氢酶基因的克隆及原核表达分析
张庆田 范书田 艾军 秦红艳


摘要:为更好了解L-半乳糖内酯脱氢酶及编码基因在软枣猕猴桃中的生理功能及作用,以 ‘魁绿软枣猕猴桃果实cDNA为模板,用RT-PCR及RACE技术,获得L-半乳糖酸-1,4-内酯脱氢酶基因AaGalLDH(GenBank:KP145007.1)。序列分析表明该基因全长为2 394 bp,开放阅读框为1 833 bp,编码610个氨基酸,与其它植物GalLDH氨基酸序列具有78%~95%的同源性。编码的蛋白序列具有GalLDH蛋白家族典型的保守结构域。进一步将该基因连接到原核表达载体并转化大肠杆菌进行诱导表达,经Western Blotting验证,目的基因在pET-28a表达系统中有表达,但基本为不溶性表达。这为进一步研究该酶蛋白的体外表达和功能以及选育高品质软枣猕猴桃品种奠定了基础。
关键词:软枣猕猴桃;L-半乳糖内酯脱氢酶(GalLDH);维生素C;克隆;基因表达
中图分类号:S663.4:Q785文献标识号:A文章编号:1001-4942(2019)11-0001-07
Cloning and Prokaryotic Expression Analysis of L-Galactono-1,
4-Lactone Dehydrogenase in Actinidia arguta
Zhang Qingtian1, Fan Shutian2, Ai Jun2, Qin Hongyan2
(1. Shandong Institute of Pomology, Taian 271000, China;
2. Institute of Special Animal and Plant Sciences, Chinese Academy of Agricultural Sciences, Changchun 130000, China)
Abstract In order to better understand the physiological function of L-galactono-1, 4-lactone dehydrogenase and coding gene in Actinidia arguta, 2 394 bp cDNA encoding L-galactono-1, 4-lactone dehydrogenase (GalLDH) fragment was cloned from fruit of A. arguta Planch by the method of RT-PCR and RACE, named AaGalLDH (GenBank: KP145007.1). Sequence analysis showed that the open reading frame was 1 833 bp, encoding 610 amino acids, and had 78% to 95% homology with other plants GalLDH amino acid sequences. The encoded protein sequence had a typical conservative domain of the GalLDH protein family. The gene was constructed to the prokaryotic expression vector and transformed into E. coli for induction expression. The target gene was expressed in the pET-28a expression system, but it was basically insoluble after Western Blotting verified. This had laid the foundation for further research on the expression and function of the enzyme protein in vitro and the selection of high-quality varieties.
Keywords Actinidia arguta; L-galactono-1, 4-lactone dehydrogenase (GalLDH); Ascorbic acid (AsA); Cloning; Gene expression
維生素C (Vitamin C),又称L-抗坏血酸(L-ascorbic acid, AsA),是一种水溶性的己糖内酯小分子化合物[1,2],具有增强机体免疫力、抑制肿瘤生长[3-6],保护视网膜、治疗眼部疾病[7-10]和抗菌消炎、辅助治疗肾病综合征、预防动脉粥样硬化等作用[11-13]。人体自身无法合成与储存VC,只能从外界食物中得到,因此,VC含量的多少可以作为衡量园艺产品品质的重要指标之一。研究表明,植物中VC合成可能存在4条途径[14],以Smirnoff-Wheeler提出的L-半乳糖合成途径占主导地位[15]。该途径中,L-半乳糖内酯脱氢酶(GalLDH)作为关键酶可直接氧化半乳糖内酯形成AsA,是所有合成相关酶中研究较多的一个酶[16]。
软枣猕猴桃[Actinidia arguta(Sieb.et Zucc.) Planch. ex Miq.]为猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)多年生落叶木质藤本果树,大多分布于我国东北、华北、西北及长江流域,以东北三省的资源最为丰富[17]。其果实品质优良、酸甜适口、风味独特、营养丰富,VC含量高达4.3 mg/g[18]。而较高的VC含量可能预示其存在特殊的合成机制。目前,GalLDH基因已在茶树、美味猕猴桃、毛花猕猴桃等植物中得到克隆,但软枣猕猴桃中未见报道。本研究拟从软枣猕猴桃中克隆GalLDH基因,并解析其基因基础,旨在为下一步开展软枣猕猴桃AsA代谢分子机制奠定基础。
1 材料与方法
1.1 试验材料
供试‘魁绿软枣猕猴桃种植于中国农业科学院特产研究所软枣猕猴桃资源圃。取果实样品,液氮速冻后-70℃保存备用。
1.2 主要试剂
PrimeSTAR? HS(Premix)、cDNA第一链合成试剂盒、胶回收试剂盒、载体连接试剂盒购自宝生物工程(大连)有限公司;RACE 试剂盒购于 Clontech 公司;其它试剂为国产分析纯。
1.3 软枣猕猴桃总RNA的提取和第一链cDNA的合成
总RNA提取缓冲液的配制参照Jaakola等[19]的方法,使用前需65℃预热,并加入3%的β-巯基乙醇。其它提取操作过程参照裴嘉博等[20]的方法进行。取1~5 μg总RNA,参照反转录试剂盒说明书进行操作,合成第一链cDNA。
1.4 软枣猕猴桃GalLDH基因cDNA片段的克隆
根据GenBank中已有植物GalLDH基因保守序列设计引物(F:5′-CTTCTATCTTGCTCGCTGT-3′;R:5′-CGTGCTTGATTGTATGTATCCAC-3′),由吉林省库美生物科技有限公司合成。以第一链cDNA为模板进行PCR扩增。PCR反应体系(20 μL): 第1鏈cDNA 1 μL,引物(10 μmol/L)各1 μL,PrimeSTAR? HS 10 μL,ddH2O 7 μL。PCR扩增条件:94℃ 5 min;94℃ 30 s,55℃ 30 s,72℃ 1 min, 34个循环;72℃延伸10 min。将PCR特异产物回收纯化后送至吉林省库美生物科技有限公司测序。
1.5 软枣猕猴桃GalLDH基因全长克隆
根据得到的GalLDH保守核心区段序列,设计基因特异引物GSP1(3′-RACE引物): 5′-CTATCAGAGAACAAGCACGTA-3′和GSP2 (5′-RACE引物): 5′-CGTCCTTGTCCTTCGGAACCTCA-3′。利用Clontech公司的SMARTTM RACE cDNA Amplification Kit进行扩增,退火温度为65℃。利用1%琼脂糖凝胶电泳检测,胶回收试剂盒回收后测序。利用Vector NTI Suite 9.0软件去除载体序列,将5′-RACE 和3′-RACE 测序结果拼接获得GalLDH基因全长序列。
1.6 序列特征分析
利用DNAStar软件对获得的GalLDH基因全长序列进行开放阅读框(ORF)分析,并得到氨基酸序列。蛋白质的分子量、等电点及基本性质用ProtParam (https://web.expasy.org/protparam/)预测;利用SOPMA 在线程序预测蛋白质二级结构。通过Pfam 32.0(http://pfam.xfam.org/)对蛋白质的结构域进行分析;通过NCBI网站BLAST,选择与软枣猕猴桃GalLDH同源性较高的其它植物GalLDH,用BioEdit软件进行多序列比对,MEGA软件构建系统发育树。
1.7 原核表达载体构建
根据得到的GalLDH基因全长设计原核表达引物 Gal-S:5′-GGAATTCCATATGATGTTCCGAGCTCTCATTCTCCGGCG-3′(下划线为内切酶Nde Ⅰ识别位点)和Gal-AS:5′-ACGCGTCGACTCAAATTTTTTCAGACAGTGGGAATAA-3′(下划线为内切酶SalⅠ识别位点)。PCR扩增产物经电泳检测、切胶回收后,连接到pEASY克隆载体。将测序正确的质粒与pET-28a质粒分别进行双酶切。分别回收酶切目的片段和pET-28a载体片段,并于16℃下连接过夜。连接体系:酶切后的pET-28a 3 μL、酶切后的目的片段3 μL、10×T4 DNA Ligase Buffer 2 μL、T4 DNA Ligase 1 μL、ddH2O 11 μL,后将连接产物转化至DH5α菌株感受态细胞中,提取质粒,经双酶切筛选正确后测序。测序构建成功的表达质粒命名为软枣猕猴桃pET-28a-GalLDH,转化至BL21(DE3) 表达菌株中培养。
1.8 软枣猕猴桃GalLDH基因的原核表达及Western Blotting 验证
取30 μL 大肠杆菌菌株BL21(DE3)转pET-28a-GalLDH菌液涂布于含50 μg/mL Kan的LB平板进行培养,对照大肠杆菌菌株BL21(DE3)转空载体pET-28a(+)进行同样操作。挑取单菌落至2 mL LB培养基(含50 μg/mL Kan)中,37℃进行种培养;分别在玻璃试管中添加5 mL LB培养基(含50 μg/mL Kan),添加种培养菌液100 μL。37℃培养至OD600值约为0.6,添加150 mmol/L IPTG 33 μL(终浓度1 mmol/L IPTG)进行诱导,37℃培养4 h后收集菌体加入320 μL PBS悬浊液并超声波破碎,经离心分离(12 000 r/min,10 min),取各抽提液(全蛋白、上清、沉淀)8 μL,加入2 μL 5×SDS Loading Buffer,99℃加热10 min,进行SDS-PAGE 电泳。
取各抽提液(全蛋白、上清、沉淀)8 μL,加入2 μL 5×SDS Loading Buffer,95℃加热10 min,使用彩色Marker及组氨酸标签Marker,进行SDS-PAGE电泳。将 PVDF膜、滤纸分别剪切成与凝胶相同大小,使用转膜缓冲液处理后,按滤纸、PVDF膜、凝胶、滤纸的顺序依次放在转膜仪电极板之间,开始转膜。将PVDF膜置于含1.5% BSA的10 mL Blocking Buffer中,44℃平放过夜封闭。 使用稀释后的Penta - His Antibody溶液5 mL,进行一次抗体反应1 h。TBST 缓冲液(20 mL)洗涤两次;洗涤TBS 缓冲液冲洗3次。 使用稀释后的HRP- Rabbit Anti- Mouse IgG抗体溶液5 mL,进行二次抗体反应1 h。TBST缓冲液(20 mL)洗涤两次;洗涤TBS缓冲液洗冲洗3次。1 mL TrueBlue Peroxidase Substrate 显色 1 min。
2 结果与分析
2.1 软枣猕猴桃GalLDH基因的RT-PCR扩增
参照其它植物RNA提取方法,本研究提取RNA结果如图1所示,28S和18S条带较亮,且28S亮度约为18S的两倍,表明RNA提取质量较好。以反转录得到的cDNA为模板,经保守区PCR扩增,获得约1 000 bp的特异片断(图2),与预期片段大小相近。产物经测序后利用NCBI中BLAST程序进行同源比对,发现其与美味猕猴桃 (Actinidia deliciosa)和毛花猕猴桃(Actinidia eriantha) GalLDH基因的相似性分别为98%、97%。因此,初步认定扩增片段为软枣猕猴桃GalLDH基因片段。
2.2 cDNA全长序列克隆及生物信息学分析
参照RACE试剂盒说明书分别进行5′-RACE和3′-RACE扩增,扩增产物经回收后克隆测序,再拼接获得cDNA全长。应用DNAStar和ProtParam程序对获得的cDNA全长序列进行开放阅读框分析,得到氨基酸序列。结果显示,该基因全长2 394 bp(GenBank:KP145007.1),开放阅读框1 833 bp,编码610个氨基酸,分子量为69 309.5 Da,等电点为8.68。负电荷残基(Asp+Glu)数为75个,正电荷残基(Arg+Lys)数为81个。不稳定系数为51.41,为不稳定蛋白质。AaGalLDH具有3个跨膜区(transmembrane region),分别位于68~86(19)、265~287(23)、322~343(22)个氨基酸之间;在氨基酸序列123~258之间,AaGalLDH含有1个典型的黄素腺嘌呤二核苷酸结合域(FAD-binding region),在282~603部位含有1个ALO结构域。蛋白质二级结构预测发现,AaGalLDH蛋白以α-螺旋(alpha helix) 和自由卷曲(random coil)结构为主,分别占41.64%、39.34%,延伸链(extended strand)和β-转角(beta turn) 结构分别占13.93%、5.08%。
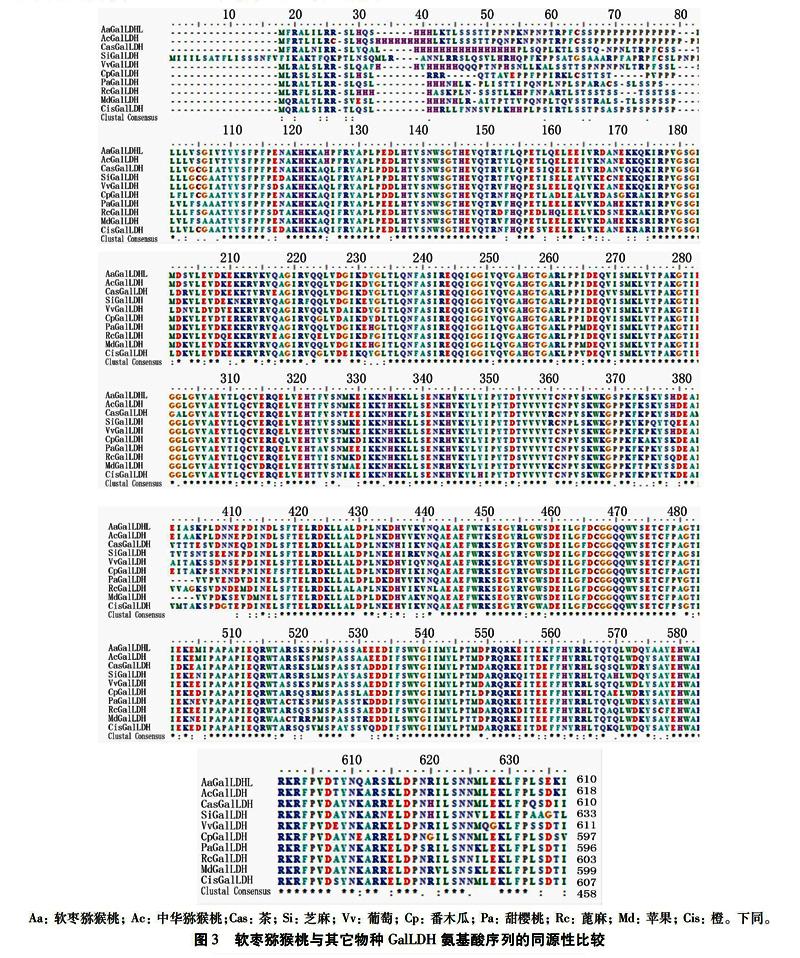
2.3 不同植物GalLDH氨基酸序列比较分析
用推导的软枣猕猴桃GalLDH氨基酸序列與其它物种进行同源性比较得出,其与中华猕猴桃(PSS01756.1) 氨基酸序列相似性为95%、茶(AHB11182.1)为79%、芝麻(XP_011075395.2)为79%、葡萄(ACN59217.1)为80%、番木瓜(XP_021908679.1)为79%、甜樱桃(XP_021830036.1)为79%、蓖麻(EEF30888.1)为79% 、苹果(NP_001315785.1)为78%、橙为(XP_024948405.1)78%。利用BioEdit软件对上述GalLDH序列做多序列比对分析(图3),结果显示3′端序列保守性较高,5′端序列变化明显,差异较大。其中软枣猕猴桃与中华猕猴桃GalLDH氨基酸序列存在18处位点差异,其中15处为单位点置换突变,1处为双位点变化,1处6个组氨酸缺失,1处2个脯氨酸缺失和3个氨基酸置换。系统进化树结果(图4)表明,软枣猕猴桃与中华猕猴桃聚在一起,表明两者GalLDH进化关系最近。茶、葡萄、芝麻与软枣猕猴桃的进化关系也较近,而与甜樱桃、苹果等的进化关系较远。
2.4 软枣猕猴桃GalLDH基因原核表达及Western Blotting杂交鉴定
由图5可以看出,经过IPTG诱导,大肠杆菌菌株BL21(DE3)转pET-28a-GalLDH菌液的重组质粒全细胞、重组质粒沉淀均产生1条约70 kDa的蛋白条带,与理论融合蛋白的分子量一致,表明GalLDH基因已经在大肠杆菌中成功表达;上清液中检测不到目的蛋白。
通过Western Blotting验证,目的基因在pET-28a表达系统中有表达,但基本为不溶性表达(图6)。
3 讨论
抗坏血酸是动植物生长发育所必需的微量营养素,在生命过程中发挥重要生理功能,特别是在抵抗逆境胁迫反应中具有重要作用[21],这也正是人们关心和研究植物合成和积累AsA的主要原因。研究表明,L-半乳糖途径是高等植物合成AsA的主要途径,其在西瓜[22]、番茄[23]、刺梨[24]、枸杞[25]、柚[26]、黄瓜[27]、毛花猕猴桃[28]等果实的AsA代谢机制均已见报道,拟南芥甚至将其作为唯一的AsA合成途径[29]。过表达GalLDH的烟草BY-2细胞系中,GalLDH活性和VC含量呈显著正相关[30]。甜瓜果实生长发育过程中,GalLDH基因的表达也与VC含量的变化趋势正相关, 含量高的组织中基因表达也相对较高[22]。软枣猕猴桃作为VC含量较高的新兴果树,发掘和验证AsA生物合成途径中的关键基因(酶),能够为将来定向育种、调控植物VC含量和提高果实品质提供分子辅助手段。本研究从软枣猕猴桃果实中克隆到AaGalLDH基因全长(GenBank:KP145007.1),其含有1个典型的该基因在所有植物中都保守的FAD结合域‘VGSGLSP和1个ALO结构域;存在有信号肽的切割位点FR/YA,与已克隆的其它植物GalLDH氨基酸序列同源性为78%~95%;AaGalLDH具有3个预测的跨膜区。其中,蛋白位置及氨基酸残基数与番茄、辣椒、烟草、甘薯、白菜均相似,可以推定具有相似的结构与功能[31]。
受环境和自身特性的影响,从植物体内提取某些物质费时费力。随着基因工程技术的发展,利用原核表达系统将外源基因整合到高效表达载体中进行生物大分子的体外制备成为可能,该方法具有高效、快速、规模化生产等特点[32,33],在分子生物学和食品工业领域的应用日益广泛。本研究使用含T7启动子能特异表达目的蛋白的pET系统,成功构建软枣猕猴桃GalLDH基因原核表达载体,经IPTG诱导,在大肠杆菌BL21中成功表达含His标签的重组融合蛋白。为进一步研究GalLDH的体内蛋白水平的表达状况与调控机制、体外表达与制备以及揭示软枣猕猴桃果实高VC含量合成与积累的分子机制奠定基础。
4 结论
本研究首次从软枣猕猴桃中獲得L-半乳糖酸-1,4-内酯脱氢酶基因的ORF序列,该序列全长1 833 bp,编码610个氨基酸,与其它植物GalLDH氨基酸序列具有78%~95%的同源性。将该基因连接到原核表达载体并转化大肠杆菌进行诱导表达,重组GalLDH蛋白在IPTG终浓度1 mmol/L、37℃诱导4 h条件下可高表达。
参 考 文 献:
[1]郭新波, 唐岳立, 孙小芬, 等. 高等植物维生素C和维生素E代谢调控[J]. 植物生理学报, 2011, 47(8): 731-744.
[2]Cruz-Rus E, Amaya I, Sánchez-Sevilla J F, et al. Regulation of L-ascorbic acid content in strawberry fruits[J]. Journal of Experimental Botany, 2011, 62(12): 4191-4201.
[3]Yun J, Mullarky E, Lu C, et al. Vitamin C selectively kills KRAS and BRAF mutant colorectal cancer cells by targeting GAPDH[J]. Science, 2015, 350 (6266):1391-1396.
[4]张琳刚, 刘静. 维生素C对奥沙利铂诱导胃癌BGC-823细胞的增殖抑制和诱导凋亡作用研究[J].中国全科医学, 2016, 19(S1):80-82.
[5]Park S, Ahn S, Shin Y, et al. Vitamin C in cancer: a metabolomics perspective[J]. Frontiers in Physiology,2018,9:762.
[6]金增霜, 李积德. Ki67、P53、Her-2在乳腺癌中的表达及其相关性[J].医学信息, 2010, 23(1): 278-230.
[7]Wei W, Li L, Zhang Y, et al. Vitamin C protected human retinal pigmented epithelium from oxidant injury depending on regulating SIRT1[J]. The Scientific World Journal, 2014, 2014: 750634.
[8]徐丽超, 许静. 维生素C注射液治疗高锰酸钾眼部烧伤的的疗效观察[J].河北医药,2011,33(24):3761-3762.
[9]Domith I, Socodato R, Portugal C C, et al. Vitamin C modulates glutamate transport and NMDA receptor function in the retina[J]. Journal of Neurochemistry,2018,144(4):408-420.
[10]郭刚.维生素C治疗角膜炎、角膜溃疡患者的效果观察[J].中国实用医药, 2018,13(16):139-141.
[11]王廷海, 付研. 维生素C在2型糖尿病合并尿路感染治疗中的疗效观察[J].中国医药导刊, 2015,17(3):280-281.
[12]王晓玉, 李伟. 肾病综合征患者免疫功能紊乱研究进展[J].医学信息:上旬刊,2010,23(10):3714-3715.
[13]Ozkanlar S, Akcay F. Antioxidant vitamins in atherosclerosis-animal experiments and clinical studies[J]. Adv. Clin. Exp. Med., 2012,21(1):115-123.
[14]安华明,陈力耕,樊卫国,等. 高等植物中维生素C的功能、合成及代谢研究进展[J].植物学通报, 2004,21(5):608-617.
[15]牛歆雨,雷玉山,梁东,等. 猕猴桃果实L-半乳糖内酯脱氢酶和脱氢抗坏血酸还原酶cDNA片段的克隆与序列分析[J].西北农林科技大学学报(自然科学版),2007,35(12):57-62.
[16]冯超, 雷莹, 刘永忠. 柑橘L-半乳糖-1,4-内酯脱氢酶基因的克隆[J].华中农业大学学报, 2009,28(6):731-735.
[17]朴一龙,赵兰花. 软枣猕猴桃研究进展[J].北方园艺, 2008(3):76-78.
[18]赵淑兰,袁福贵,马月申,等. 软枣猕猴桃新品种——魁绿[J].园艺学报,1994,21(2):207-208.
[19]Jaakola L, Pirttil A M, Halonen M, et al. Isolation of high quality RNA from bilberry (Vaccinium myrtillus L.) fruit [J]. Molecular Biotechnology, 2001, 19(2): 201-203.
[20]裴嘉博,李晓艳, 李亚东. 越橘果实总RNA提取方法比较研究[J].东北农业大学学报, 2012, 43(10):30-34.
[21]肖妮娜,马锋旺,张军科,等.苹果L-半乳糖脱氢酶基因cDNA全长的克隆与序列分析[J].西北农林科技大学学报(自然科学版), 2007,35(4):175-178,184.
[22]Pateraki I, Sanmartin M, Kalamaki M S,et al. Molecular characterization and expression studied during melon fruit development and ripening of L-galactono-1, 4-lactone dehydrogenase[J]. Journal of Experimental Botany, 2004, 55(403): 1623-1633.
[23]Alhagdow M, Mounet F, Gilbert L, et al. Silencing of the mitochondrial ascorbate synthesizing enzyme L-galactono-1,4-lactone dehydrogenase affects plant and fruit development in tomato[J]. Plant Physiology, 2007, 145(4): 1408-1422.
[24]李良良. 四種非生物因子对刺梨AsA相关基因表达的影响[D].贵阳:贵州大学, 2016.
[25]乔枫,耿贵工,陈志. 枸杞L-半乳糖酸内酯脱氢酶基因的克隆及表达分析[J].西北植物学报,2015,35(11):2141-2147.
[26]刘志发.柚抗坏血酸合成相关酶基因的克隆与表达研究[D].福州:福建农林大学, 2015.
[27]苑志明,劳杉杉,秦智伟,等.黄瓜L-半乳糖-1,4-内酯脱氢酶cDNA全长的克隆和遗传转化[J].东北农业大学学报, 2012, 43(7):100-103.
[28]燕标,吴延军,谢鸣,等.毛花猕猴桃果实L-半乳糖内酯脱氢酶基因cDNA片段的克隆与序列分析[J].浙江农业学报, 2011, 23(3):523-527.
[29]Dowdle J. Ishikawa T. Gatzek S, et al. Two genes in Arabidopsis thaliana encoding GDP-L-galactose phosphorylase are required for ascorbate biosynthesis and seedling viability[J]. Plant Journal, 2007, 52(4): 673-689.
[30]Tokunaga T, Miyahara K, Tabata K, et al. Generation and properties of ascorbic acid-overproducing transgenic tobacco cells expressing sense RNA for L-galactono-1,4-lactone dehydrogenase[J]. Planta, 2005, 220(6):854-863.
[31]董玉梅,密其鹏,焦自高,等.马铃薯GLDH基因的克隆及序列分析[J].园艺学报,2011,38(6):1111-1120.
[32]张鹍飞,牟利,李鹏,等.青稞OMT1基因克隆及原核表达分析[J].核农学报,2017,31(12):2314-2322.
[33]贾彦凤,李林芝,魏家萍,等.鹰嘴豆α-淀粉酶抑制剂基因CL-AI的原核表达、纯化及生物学特性[J].核农学报,2017,31(5):852-861.
收稿日期:2019-07-30
基金项目:山东省农业科学院农业科技创新工程项目(CXGC2016A03,CXGC2018D05);吉林省科技发展计划项目(20170203006NY)
作者简介:张庆田(1981—),男,硕士,助理研究员,主要从事果树资源评价与育种研究。E-mail:88327195@qq.com
通讯作者:秦红艳(1984—),女,博士,助理研究员,主要从事经济植物种质资源评价与利用研究。E-mail:qinyan11@163.com

